
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 于坤朋, 彭程, 林燕玲, 李利君, 倪辉, 李清彪
- YU Kunpeng, PENG Cheng, LIN Yanling, LI Lijun, NI Hui, LI Qingbiao
- 黑曲霉β-葡萄糖苷酶An-bgl3的重组表达及东莨菪苷的转化
- Expression of β-glucosidase An-bgl3 from Aspergillus niger for conversion of scopolin
- 生物工程学报, 2023, 39(3): 1232-1246
- Chinese Journal of Biotechnology, 2023, 39(3): 1232-1246
- 10.13345/j.cjb.220709
-
文章历史
- Received: September 4, 2022
- Accepted: October 27, 2022
- Published: November 3, 2022
2. 福建省食品微生物与酶工程重点实验室, 福建 厦门 361021;
3. 厦门市食品生物工程技术研究中心, 福建 厦门 361021;
4. 海洋食品精深加工关键技术省部共建协同创新中心, 辽宁 大连 116034
2. Fujian Provincial Key Laboratory of Food Microbiology and Engineering, Xiamen 361021, Fujian, China;
3. Research Center of Food Biotechnology of Xiamen City, Xiamen 361021, Fujian, China;
4. Collaborative Innovation Center of Seafood Deep Processing, Dalian 116034, Liaoning, China
东莨菪素(scopoletin)又称东莨菪内酯,属香豆素类化合物,化学名为6-甲氧基-7-羟基香豆素[1];不仅具有抗肿瘤[2-3]、抗炎及镇痛[4]、降血压血脂[5]、保肝[6]、增强记忆[7]和解痉等药理活性;还具有杀虫、杀螨、抑菌等农用生物活性[8]。东莨菪素在自然界分布广泛,存在于丁公藤茎、拟南芥全株、茯苓[9-10]等植物中,可采用溶剂从植物中萃取得到;如Tripathi等[11]采用溶剂萃取的方法从青蒿茎中提取东莨菪素的提取得率为0.3%;Tzeng等[12]采用超临界二氧化碳萃取法的提取率为54.4%;Sramska等[13]采用超声辅助萃取法的提取率为52%;Jokić等[14]采用超临界流体萃取的方法从意大利蜡菊中提取东莨菪素,提取得率为6.31%。徐飞等[15]采用甲醇提取法和孙雅丽等[16]采用乙醇超声提取法提取率分别是5%和1%。目前,采用溶剂法从植物组织中提取东莨菪素耗费时间长,提取率不高,还消耗较多的有机试剂和能源[1, 17],因此,研究如何高效提高东莨菪素得率及减少提取过程中的消耗具有重要的研究意义。
相关研究表明,植物组织中同时存在东莨菪苷和东莨菪素两种结构类似物,且东莨菪苷的含量大于东莨菪素的含量[18]。从来结构来看,两者构型区别只是东莨菪苷比东莨菪素多一个葡萄糖基,因此,从理论上来看通过酶或者酸水解去除东莨菪苷上的末端的葡萄糖基则有可能增加植物组织中东莨菪素的提取得率。采用酸水解可能会导致大量的副产物生成,从而影响产物的东莨菪素的分离纯化效率。因此,相比酸法技术,酶技术在东莨菪素提取中可能更具优势。
β-葡萄糖苷酶(β-glucosidase, EC 3.2.1.21)是一类水解末端的非还原性β-d-葡萄糖苷键进而释放葡萄糖和相应配基的糖苷水解酶[19],在食品、医药制造、生物能源、动物饲料等方面具有广泛的应用价值[20-22]。相关研究报道,β-葡萄糖苷酶除了能够水解β-葡萄糖苷,还能够水解β-半乳糖苷,有些酶甚至能水解木糖苷、果糖苷、蔗糖、纤维二糖等多种糖苷[23-24],但是目前使用β-葡萄糖苷酶针对于东莨菪苷的研究还未见报道。现已研究的β-葡萄糖苷酶大多具有底物广谱性,能够水解较多种类型的底物,可能会增加提取物中成分的复杂性。因此,选择对东莨菪苷具有特异性且性质优良的β-葡萄糖苷酶是酶法提取东莨菪素的重要研究方向。
在前期研究中,我们对16个黑曲霉(Aspergillus niger)来源β-葡萄糖苷酶水解底物性能进行了测定,发现大多数酶具有底物广谱性,其中基因序列登录号为XP_001398259.2的β-葡萄糖苷酶An-bgl3可能对东莨菪苷具有特异水解活性。本文基于以上研究背景,对来源于A. niger的β-葡萄糖苷酶An-bgl3进行了异源表达、纯化,分析了该酶与东莨菪苷的构效关系,研究了重组β-葡萄糖苷酶An-bgl3的相关性质及对东莨菪苷的转化效果,为酶法提取制备东莨菪素提供β-葡萄糖苷酶资源参考。
1 材料与方法 1.1 材料和试剂大肠杆菌DH5α菌株(Escherichia coli) DH5α、毕赤酵母GS115菌株(Pichia pastoris) GS115、含pPIC9K载体的E. coli DH5α均由实验室保藏。含带有目的基因β-葡萄糖苷酶的PUC-57-An-bgl3-Amp的E. coli DH5α委托金唯智生物科技(苏州)有限公司合成。丁公藤对照药材(YZ-120901-1 g)购自厦门陶烁生物科技有限公司。东莨菪苷(B20307-20 mg)和东莨菪素(B20309-20 mg)标准品购自上海源叶生物科技有限公司。
PrimeSTAR HS DNA Polymerase、Taq DNA聚合酶、高效感受态细胞制备试剂盒、T4 DNA连接酶、限制性内切酶NotⅠ和Avr Ⅱ购自TaKaRa (大连)有限公司。限制性内切酶PmeⅠ购自NEB公司。Easy Ⅱ Protein Quantitative Kit、EasyTaq Mix购自北京全式金生物技术股份有限公司。质粒小提试剂盒和DNA纯化回收试剂盒购自天根生化科技(北京)有限公司。
1.2 仪器和设备Agilent 1260 Infinit高效液相色谱仪,安捷伦科技公司;Biometra TAdvanced基因扩增仪,耶拿有限公司;DK-8D数显恒温水浴锅,常州国华电器有限公司;FE28pH计,METTLER TOLEDO公司;SW-CJ-2FD双人单面超净工作台,苏州净化设备有限公司;Centrifuge 5417R小型高速冷冻离心机,Eppendorf有限公司;K10金属浴,杭州奥盛有限公司;GEAI 600凝胶成像仪,GE公司;1652100电穿孔仪,BIO-RAD有限公司;Avanti J-26S XP立式高速冷冻离心机,BECKMAN公司;YXQ-LS-30SH立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂。
1.3 方法 1.3.1 β-葡萄糖苷酶基因An-bgl3的克隆利用SignalP 4.0 Server (http://www.cbs.dtu.dk/services/SignalP-4.0/)在线软件分析β-葡萄糖苷酶(An-bgl3)基因序列,获得信号肽位置,并在后续构建重组质粒时去除信号肽。运用DNAMAN软件分析基因序列,选择酶切位点Avr Ⅱ和Not Ⅰ,设计引物(An-bgl3-F: 5′-CCGGAATTCGTGCAGAATGCCTCCAGACC-3′; An-bgl3-R: 5′-ATTTGCGGCCGCAACAACCCAAAACGCCC-3′),划线部分为酶切位点。引物和DNA测序均由铂尚生物技术(上海)有限公司完成。
以PUC-57-An-bgl3-Amp质粒为模板,在PrimeSTAR HS DNA Polymerase的作用下,以An-bgl3-F和An-bgl3-R为引物进行聚合酶链式反应(polymerase chain reaction, PCR)扩增目的基因,扩增程序为:95 ℃ 4 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min 30 s,进行30次循环;72 ℃ 10 min;4 ℃保存。反应结束后采用1%的琼脂糖凝胶电泳检测PCR扩增产物,参照DNA纯化回收试剂盒说明书纯化回收PCR产物。PCR扩增产物和pPIC9K质粒分别经Avr Ⅱ和NotⅠ酶切回收后,通过T4 DNA连接酶连接,转化至E. coli DH5α感受态细胞中,菌液PCR筛选阳性克隆子后进行测序。将测序正确的重组质粒命名为pPIC9K-An-bgl3。参照质粒小提试剂盒提取重组质粒pPIC9K-An-bgl3,备用。
1.3.2 β-葡萄糖苷酶An-bgl3的诱导表达、纯化及质谱鉴定将菌株接入BMGY培养基中,30 ℃、200 r/min培养24 h,使OD600值为1.3−1.5。静置6−8 h重悬,弃去上清,收集上述菌体,在无菌条件下将其全部转接入BMMY培养基中,30 ℃、200 r/min培养7 d,每24 h补加0.5% (体积分数)甲醇诱导表达。培养后的菌液离心收集,即为粗酶液。通过Phenyl疏水柱、Q Sepharose层析、Superdex 200 Increase 10/300 GL层析等步骤纯化重组β-葡萄糖苷酶An-bgl3。
纯化过程中总活力、比活力、纯化倍数、回收率的计算方法如下:
总活力=活力单位数/mL酶液×总体积(mL);
比活力=活力单位数/mg蛋白=总活力单位数/总蛋白mg;
纯化倍数=每次比活力/第一次比活力;
回收率(产率)=(每次总活力/第一次总活力)×100%。
蛋白浓度的测定:根据全式金生物的Easy Ⅱ Protein Quantitative Kit说明书配制工作液,以牛血清白蛋白溶液为标准溶液,测定样品的蛋白浓度。重组蛋白的分子量通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)测定。
质谱鉴定:重组蛋白的鉴定是使用蛋白质内切酶trypsin对蛋白质多肽样品进行酶解,然后使用液相色谱质谱联用仪(liquid chromatograph mass spectrometer, LC-MS/MS)对酶解后的样品进行分析。再通过MASCOT等质谱匹配软件对LC-MS/MS数据进行分析,获得目标蛋白质多肽分子的定性鉴定信息。
1.3.3 β-葡萄糖苷酶An-bgl3酶活的测定先配制浓度为5 mmol/L东莨菪苷的母液,再稀释成一系列浓度的东莨菪苷溶液,通过Agilent 1260 Infinit型高效液相色谱仪(high performance liquid chromatography, HPLC)测定东莨菪苷标准曲线。检测条件为:色谱柱Agilent ZORBAX SB-C18,5 μm (4.6 mm×150 mm),柱温28 ℃,进样量10 μL,检测波长为347 nm;以乙腈(A)和0.1%磷酸缓冲液(B)为流动相进行梯度洗脱,流速为1.0 mL/min,梯度洗脱条件为(0−10 min, 15%−34% A; 10−20 min, 34% A; 20−30 min, 34%−15% A)。
酶活的测定:600 μL的pH 4.0的2 mmol/L的东莨菪苷溶液与100 μL的An-bgl3酶液在55 ℃条件下反应20 min后,于沸水浴10 min终止反应,冷却至室温经微孔过滤后反应液通过HPLC检测东莨菪苷的含量。
酶活定义:在最适反应条件下,1 min内转化1 μmoL东莨菪苷时所需的β-葡萄糖苷量为一个酶活单位(IU)。
1.3.4 β-葡萄糖苷酶An-bgl3的底物偏好性及动力学参数分别测定重组β-葡萄糖苷酶An-bgl3与2 mmol/L的不同的底物(对硝基苯基-β-d-吡喃葡萄糖苷、对硝基苯基-α-d-吡喃葡萄糖苷、对硝基苯基-N-乙酰基-β-d-吡喃葡萄糖苷、对硝基苯基-β-d-吡喃半乳糖苷、栀子苷、水杨苷、虎杖苷、七叶苷、东莨菪苷、苦杏仁苷、甘草苷、纤维二糖、蔗糖、麦芽糖)在55 ℃反应20 min后的酶活力来研究该酶的底物特异性。
测定重组β-葡萄糖苷酶An-bgl3与50 mmol/L pH 4.0的不同浓度(1−6 mmol/L)东莨菪苷底物溶液在55 ℃反应20 min后的酶活,利用Lineweaver-Burk plot法计算获得Km值和Vmax值。
1.3.5 温度、pH对β-葡萄糖苷酶An-bgl3酶活的影响在pH 5.0条件下,通过测定重组β-葡萄糖苷酶An-bgl3在40−75 ℃温度范围内(每隔5 ℃)的酶活力来探究该酶的最适温度。将一定量的酶液于55 ℃水浴锅孵育,每隔30 min取样,于最适条件下测定其残余酶活力来探究其温度稳定性。
用50 mmol/L的不同pH (pH 3.0−6.0)的柠檬酸盐缓冲液与(pH 6.0−8.0)磷酸盐缓冲液配制2 mmol/L的东莨菪苷底物溶液。参照酶活的测定方法测定重组β-葡萄糖苷酶An-bgl3与上述不同pH值的底物反应时的酶活力来探究该酶的最适pH。通过测定酶液在不同pH条件下(pH 3.0−8.0)于4 ℃放置24 h后的残余酶活来研究该酶的pH稳定性;以未处理的酶活为100%,计算其相对酶活。
1.3.6 金属离子、抑制剂、表面活性剂及有机试剂对An-bgl3酶活的影响在最适反应条件下,分别采用1 mmol/L和10 mmol/L的Mg2+、Na2+、Mn2+、Al3+、Fe3+、K+、Cu2+、Cd2+、Fe2+、Ba2+、Zn2+、Ca2+等金属离子,在4 ℃条件下反应24 h,测定重组β-葡萄糖苷酶An-bgl3的残余酶活力来探究金属离子对酶活力的影响,以未被金属离子处理的酶活力为100%。
在最适反应条件下,分别采用1 mmol/L和10 mmol/L的EDTA、SDS、CTAB、Urea、Triton X-20、Tween-80和Triton-X 100等抑制剂和表面活性剂,在4 ℃条件下反应24 h,测定重组β-葡萄糖苷酶An-bgl3的残余酶活力来探究抑制剂和表面活性剂对酶活力的影响,以未被抑制剂和表面活性剂处理的酶活力为100%。
在最适反应条件下,分别测定该酶在不同浓度(10%、20%、40%、60%)的甲醇、乙醇存在时的残余酶活力来探究有机试剂对于重组β-葡萄糖苷酶An-bgl3酶活力的影响,以未处理的酶活力为100%。
1.3.7 An-bgl3酶与东莨菪苷的结合模式分析使用RobeTTaFold (http://robetta.bakerlab.org/)对蛋白模型进行预测,POCASA服务器计算口袋的体积(https://g6altair.sci.hokudai.ac.jp/g6/service/pocasa/),通过AutoDock Vina、Discover Studio和Pymol进行可视化分析。
1.3.8 An-bgl3酶对于植物粗提物中东莨菪苷的转化实验取丁公藤(Erycibe obtusifolia Benth)样品粉末30 mg,使用4 mL的蒸馏水溶解(其中含有含量为10%的甲醇),溶解完毕后作为底物溶液取600 μL加入200 μL的An-bgl3酶液在55 ℃的条件下反应20 min,再转入沸水浴反应10 min,之后过0.22 μm的微孔滤膜,按照1.3.3中的液相方法进行进样分析。
1.3.9 数据分析与统计所有实验均重复平行3次,使用Excel 2016 (微软公司,美国)进行绘图,采用SPSS 21.0进行数据分析。
2 结果与分析 2.1 β-葡萄糖苷酶An-bgl3基因的克隆表达、纯化及质谱鉴定将葡萄糖苷酶An-bgl3基因构建在pPIC9K载体中,然后在毕赤酵母中异源表达。通过Phenyl疏水柱、Q Sepharose HP阴离子交换柱、Superdex 200 Increase 10/300 GL凝胶过滤柱对重组β-葡萄糖苷酶An-bgl3粗酶液进行纯化,得到纯度较高的酶液。由表 1可看出,该重组蛋白的纯化倍数为29.4倍,比活达到3 747.0 U/mg。SDS-PAGE分析结果见图 1,可观察到对应于约120 kDa单一条带,从SDS-PAGE切出相应的条带,将胰蛋白酶水解产物进行质谱(MS)分析。通过LC-MS/MS鉴定分离重组β-葡萄糖苷酶,再由MASCOT等质谱匹配软件对LC-MS/MS数据进行分析,获得目标蛋白质多肽分子的定性鉴定信息,得到待测蛋白条带的氨基酸序列信息,结果表明该蛋白与前期克隆表达的序列一致,表达纯化得到了黑曲霉β-葡萄糖苷酶An-bgl3蛋白。
| Purification steps | Total activity (U) | Total protein (mg) | Specific activity (U/mg) | Purified fold | Recovery rate (%) |
| Hydrophobic column | 61 272.6 | 402.3 | 152.3 | 1.2 | 75.2 |
| Superdex 200 Increase 10/300 GL | 41 347.2 | 58.1 | 310.8 | 2.4 | 50.7 |
| Q sepharose | 14 261.8 | 4.5 | 3 183.4 | 25.0 | 17.5 |
| Superdex 200 Increase 10/300 GL | 9 723.6 | 2. 6 | 3 740.0 | 29.4 | 11.9 |
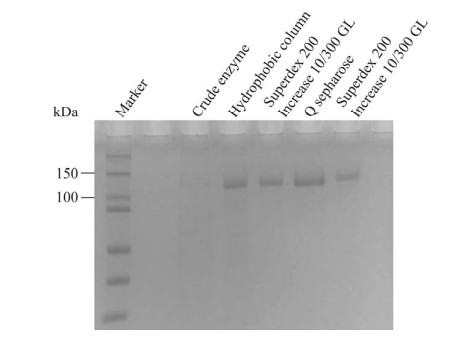
|
| 图 1 纯化蛋白的SDS-PAGE图 Fig. 1 SDS-PAGE profile of the purified proteins. |
| |
重组β-葡萄糖苷酶An-bgl3仅对香豆素类糖苷底物东莨菪苷和七叶苷具有水解能力(表 2),且对东莨菪苷的水解能力最强,对于其他底物对硝基苯基-β-d-吡喃葡萄糖苷、对硝基苯基-α-d-吡喃葡萄糖苷、对硝基苯基-N-乙酰基-β-d-吡喃葡萄糖苷、对硝基苯基-β-d-吡喃半乳糖苷、栀子苷、水杨苷、虎杖苷、苦杏仁苷、甘草苷、纤维二糖、蔗糖、麦芽糖等均未检测出活性,通过测定重组β-葡萄糖苷酶An-bgl3对不同东莨菪苷浓度的初始反应速率,利用Lineweaver-Burk plot法(图 2)计算获得酶促反应参数Km值和Vmax值分别为7.05 mmol/L和250 μmol/(min·mL)。
| Substrate type | Specific activity of An-bgl3 (U/mL) | Relative activity of An-bgl3 (%) |
| P-nitrophenyl-β-d-glucopyranoside | ND | ND |
| P-nitrophenyl-α-d-glucopyranoside | ND | ND |
| P-nitrophenyl-N-acetyl-β-d-glucopyranoside | ND | ND |
| P-nitrophenyl-β-d-galactopyranoside | ND | ND |
| gGeniposide | ND | ND |
| Salicin | ND | ND |
| Polydatin | ND | ND |
| Esculin | 29.64±0.1 | 76.5 |
| Scopolin | 38.72±0.1 | 100.0 |
| Amygdalin | ND | ND |
| Liquiritin | ND | ND |
| Cellbiose | ND | ND |
| Sucrose | ND | ND |
| Maltose | ND | ND |
| ND: No enzyme activity was detected. | ||
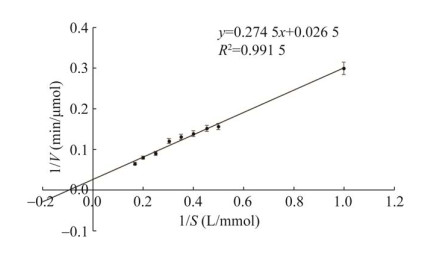
|
| 图 2 β-葡萄糖苷酶An-bgl3对东莨菪苷的Lineweaver-Burk双倒数曲线 Fig. 2 Lineweaver-Burk plot of β-glucosidase An-bgl3 for scopolin. |
| |
以东莨菪苷为底物,探究重组β-葡萄糖苷酶An-bgl3在40−75 ℃条件下的酶活力(图 3A)。重组β-葡萄糖苷酶在40−75 ℃范围内均有活性,说明该酶有良好的温度适应性,其最适反应温度为55 ℃。在最适温度55 ℃的条件下孵育30 min后,重组β-葡萄糖苷酶An-bgl3的残余酶活力仅为38% (图 3B)。本研究β-葡萄糖苷酶An-bgl3最适pH为4.0 (图 3C),在pH 4.0−8.0的范围内,酶活力能够保持90%以上(图 3D)。
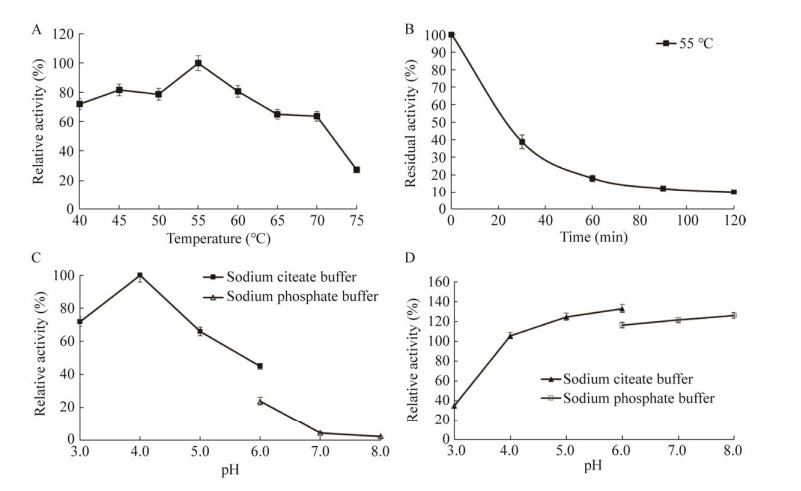
|
| 图 3 β-葡萄糖苷酶An-bgl3的最适温度(A)、温度稳定性(B)、最适pH (C)、pH稳定性(D) Fig. 3 Effect of temperature and pH on recombinant β-glucosidase An-bgl3. A: Optimal temperature. B: Temperature stability. C: Optimal pH. D: pH stability. |
| |
以东莨菪苷为底物,测试金属离子、抑制剂和表面活性剂对酶活性的影响(表 3、表 4)。1 mmol/L的金属离子对重组An-bgl3的酶活力基本没有影响。10 mmol/L的Fe2+和Mn2+离子对重组An-bgl3酶活力有明显的激活作用,其酶活分别提高了1.74倍和1.20倍,10 mmol/L的Fe3+、Al3+对该酶有抑制作用,残余酶活力为70%左右。10 mmol/L的Tween-20、Tween-80和Triton X-100对重组An-bgl3的酶活力有较为明显的抑制作用,抑制效果为30%左右。重组An-bgl3对低浓度的甲醇、乙醇等有机试剂有一定的耐受性(表 5),当反应环境中存在10%的有机试剂时,该酶活力基本不受影响,当浓度增加到20%时,重组An-bgl3的酶活力受到一定的抑制作用,残余酶活力为75%左右;随着浓度的进一步增大,抑制效果越明显。
| Type of metal ions | Relative activity (%) | |
| 1 mmol/L | 10 mmol/L | |
| Mg2+ | 88.3±0.1 | 111.90±0.2 |
| Na2+ | 93.2±0.1 | 83.10±0.2 |
| Mn2+ | 101.0±0.1 | 222.40±0.1 |
| Al3+ | 95.9±0.3 | 70.80±0.1 |
| Fe3+ | 93.7±0.2 | 67.58±0.1 |
| K+ | 95.0±0.1 | 84.00±0.6 |
| Cu2+ | 95.4±0.2 | 98.20±0.1 |
| Cd2+ | 94.6±0.1 | 99.50±0.3 |
| Fe2+ | 102.8±0.2 | 282.20±0.1 |
| Ba2+ | 92.2±0.2 | 95.00±0.2 |
| Zn2+ | 89.5±0.2 | 79.50±0.1 |
| Ca2+ | 94.5±0.6 | 103.70±0.1 |
| Reagent type | Relative activity (%) | |
| 1 mmol/L | 10 mmol/L | |
| EDTA | 112.5±0.4 | 92.5±0.2 |
| SDS | 108.0±0.4 | 98.4±0.2 |
| CTAB | 102.4±0.3 | 97.0±0.2 |
| Urea | 110.8±0.2 | 97.2±0.4 |
| Tween-20 | 103.6±0.3 | 67.8±0.2 |
| Tween-80 | 104.2±0.2 | 67.1±0.2 |
| Triton-X 100 | 107.8±0.3 | 62.6±0.1 |
| Reagent concentration (%) | Relative activity (%) | |
| Ethanol | Methanol | |
| 10 | 101.8±0.2 | 88.3±0.1 |
| 20 | 86.4±0.4 | 76.0±0.2 |
| 40 | 23.8±0.3 | 42.3±0.3 |
| 60 | 17.6±0.5 | 31.8±0.3 |
通过RobeTTaFold对构建蛋白模型,利用POCASA服务器计算口袋的体积,葡萄糖苷酶An-bgl3的结合口袋如图 4所示,其口袋体积大小为308 Å3、口袋底部较深,口袋开口处靠近蛋白表面并且向外延伸,适合结合长链底物,而短链的底物在口袋中会有较高的自由度,难以定位,造成酶活低或无酶活。在进行测定的众多底物中,东莨菪苷和七叶苷含有一个香豆素基团,为较长链底物,结合实验结果预测其能与该酶的口袋相适应。
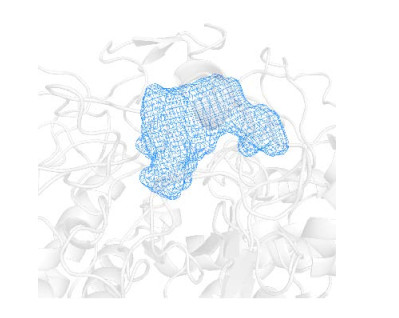
|
| 图 4 葡萄糖苷酶An-bgl3口袋构象图 Fig. 4 Pocket conformation diagram of glucosidase An-bgl3. |
| |
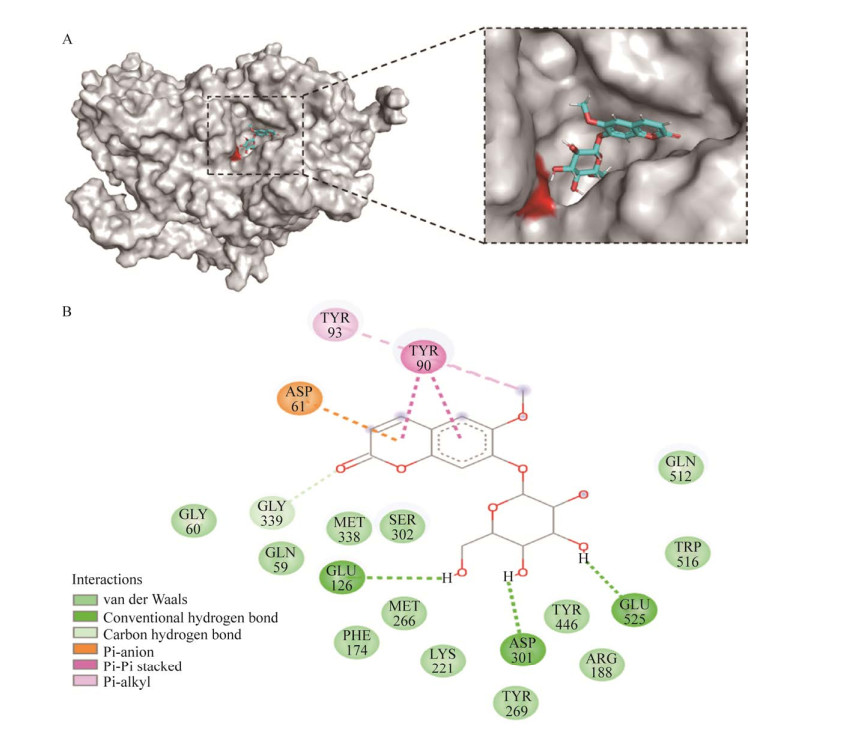
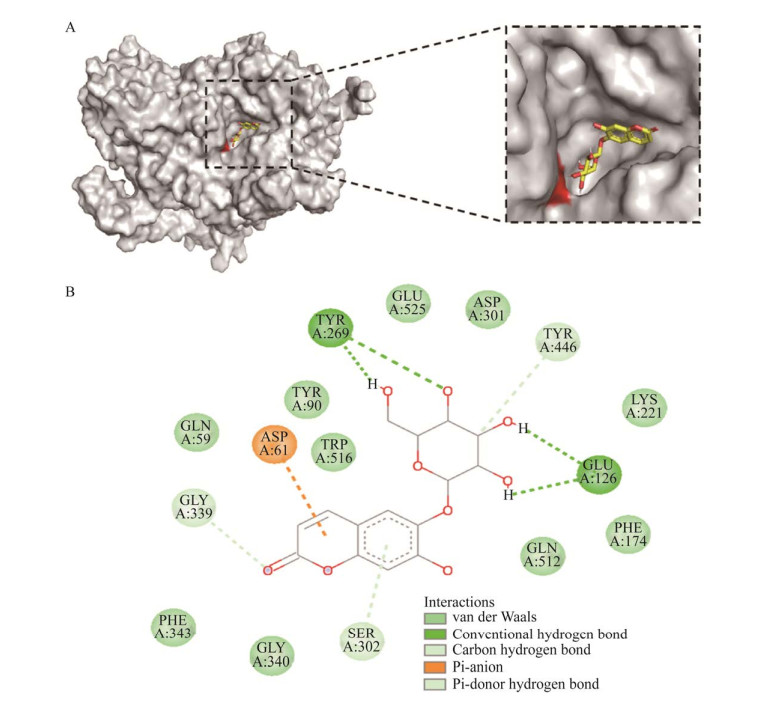
将葡萄糖苷酶An-bgl3与模板蛋白5yot进行序列比对,确定Glu525亲核试剂,Asp301为质子供体。使用AutoDock软件分别将东莨菪苷、七叶苷与葡萄糖苷酶An-bgl3进行对接,利用Discovery Studio2020与pymol分析An-bgl3与东莨菪苷、七叶苷之间的分子间相互作用力。图 5显示葡萄糖苷酶An-bgl3与东莨菪苷的结果,其对接结合能为–7.8 kcal/mol,Glu126、Glu525和Asp301与东莨菪苷的葡萄糖基形成3条氢键,Tyr93、Tyr90和Asp61与东莨菪苷形成4条疏水作用力,有效固定东莨菪苷结合在催化活性部位,达到水解葡萄糖基的目的。图 6表示葡萄糖苷酶An-bgl3与七叶苷的对接结果,其对接结合自由能为–7.9 kcal/mol,Tyr269、Glu12、Gly339与七叶苷的葡萄糖基形成5条氢键,Asp61、Gly339与Ser302则与香豆素基形成相互作用力,帮助七叶苷结合在催化口袋活性部位,催化水解葡萄糖基。对比七叶苷与东莨菪苷的相互作用力,发现催化关键氨基酸Glu525和Asp301可以与七叶苷之间进行范德华力,作用力大小不如形成氢键的东莨菪苷。以上结果表明,葡萄糖苷酶An-bgl3与东莨菪苷的亲和力较好,这可能是造成葡萄糖苷酶An-bgl3与东莨菪苷的酶活较高的原因。
|
| 图 5 东莨菪苷与葡萄糖苷酶An-bgl3的对接效果图(A)和结合模式(B) Fig. 5 Docking effect diagram (A) and binding mode (B) of scopolin with glucosidase An-bgl3. |
| |
|
| 图 6 七叶苷与葡萄糖苷酶An-bgl3的对接效果图(A)和结合模式(B) Fig. 6 Docking effect diagram (A) and binding mode (B) of esculin with glucosidase An-bgl3. |
| |
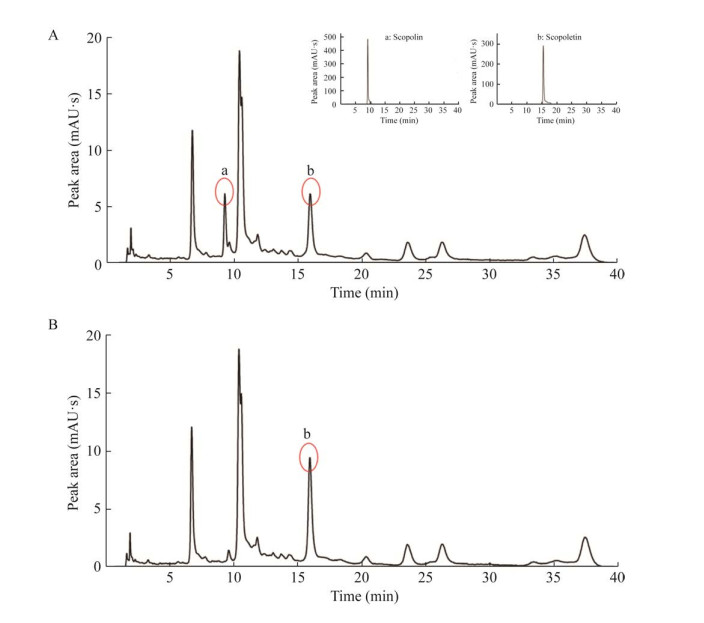
用β-葡萄糖苷酶An-bgl3对丁公藤粗提物(其中含有东莨菪苷和东莨菪素)进行水解试验,如图 7所示结果显示。水解前丁公藤粗提物中含有较多的东莨菪苷(a)和东莨菪素(b) (图 7A);加入An-bgl3酶后液处理,东莨菪苷能够被该酶水解成为东莨菪素,且东莨菪素含量增加了47.8% (图 7B)。
|
| 图 7 酶解液相结果分析图 Fig. 7 HPLC analysis of enzymatic hydrolysis results. |
| |
本研究克隆、表达了黑曲霉来源的β-葡萄糖苷酶An-bgl3,经离子交换柱、分子筛等进行分离纯化后的比活力为15.22 IU/mg,纯化倍数为54.73倍,SDS-PAGE测得该酶分子量大小约为120 kDa。该蛋白的实际分子量大于理论分子量91 kDa。经毕赤酵母系统表达后,具有糖基化位点的酶可能会发生糖基化。将该蛋白序列进行糖基化位点预测,发现该蛋白共有11个糖基化位点,因此推测糖基化修饰时导致该蛋白的实际分子量偏大的原因。
β-葡萄糖苷酶的作用底物非常多样,可水解对硝基苯基-α-d-吡喃葡萄糖苷、对硝基苯基-N-乙酰基-β-d-吡喃葡萄糖苷、对硝基苯基-β-d-吡喃半乳糖苷、麦芽糖、蔗糖[23]、纤维二糖、纤维三糖、纤维四糖[24]等。而本研究的重组β-葡萄糖苷酶An-bgl3仅对香豆素类糖苷底物东莨菪苷和七叶苷具有水解能力,且对东莨菪苷的水解能力最强,对于其他底物对硝基苯基-β-d-吡喃葡萄糖苷、对硝基苯基-α-d-吡喃葡萄糖苷、对硝基苯基-N-乙酰基-β-d-吡喃葡萄糖苷、对硝基苯基-β-d-吡喃半乳糖苷、栀子苷、水杨苷、虎杖苷、苦杏仁苷、甘草苷、纤维二糖、蔗糖、麦芽糖等均未检测出活性,其底物特异性与相关研究报道的β-葡萄糖苷酶具有显著不同[25]。以东莨菪苷为底物测得Km值和Vmax值分别为7.05 mmol/L和250 μmol/(min·mL)。从该结果来看,黑曲霉β-葡萄糖苷酶An-bgl3与东莨菪苷的亲和力稍弱于相关文献[26]报道的对硝基苯基-β-d-吡喃葡萄糖苷的亲和力。该重组β-葡萄糖苷酶An-bgl3的最适温度为55 ℃,这与来源于杂色曲霉(Aspergillus versicolor)[27]、黑曲霉(Aspergillus niger)[28]、黄曲霉(Aspergillus flavus)[29]和A. niger CBS513.88的β-葡萄糖苷酶(bgls)[30]的最适温度研究结果相近。在最适温度55 ℃的条件下孵育30 min后,重组β-葡萄糖苷酶An-bgl3的残余酶活力仅为38%。相关文献报道来源于疣孢青霉(Penicillium verruculosum)的重组β-葡萄糖苷酶在60 ℃孵育3 h后,残余酶活力为25%[31],来源于土曲霉(Aspergillus terreus)的β-葡萄糖苷酶在60 ℃的温度下孵育1 h后,残余酶活力仅有65.1%[32]。与相关文献报道的热稳定性相比,本研究β-葡萄糖苷酶An-bgl3的热稳定性稍低于来源于P. verruculosum和A. terreus的β-葡萄糖苷酶。本研究β-葡萄糖苷酶An-bgl3最适pH为4.0,这与来源于A. niger NRRL 3122的β-葡萄糖苷酶的最适pH基本相同[33]。在pH 4.0−8.0的范围内,酶活力能够保持90%以上,这与Karami等[28]研究的同样来自A. niger的β-葡萄糖苷酶在pH 3.0−8.0的范围内,酶活力仍保持原有活力的80%以上结果相近。
10 mmol/L的Fe2+和Mn2+离子对重组An-bgl3酶活力有明显的激活作用,其酶活分别提高了1.74倍和1.20倍,原因可能是Fe2+和Mn2+的存在更有利于底物与酶的活性中心相结合,这与徐星等[34]和戴爽等[35]的研究相似。10 mmol/L的Fe3+、Al3+对该酶有抑制作用,残余酶活力为70%左右;可能是Fe3+、Al3+与酶的非活性中心结合,改变了酶的结构,也改变了活性中心的结构与性质,使酶活力降低[36]。10 mmol/L的Tween-20、Tween-80和Triton X-100对重组An-bgl3的酶活力有较为明显的抑制作用,抑制效果为30%左右,可能是其芳香族部分与靠近或位于活性位点的疏水作用区域相互作用,从而影响酶活性造成酶活降低;该结果与Kumar等[37]研究的来源于灰色链霉菌(Streptomyces griseus)的β-葡萄糖苷酶的研究结果相似。重组An-bgl3对低浓度的甲醇、乙醇等有机试剂有一定的耐受性,这与赵林果等[38]的研究结果相似。
An-bgl3酶对东莨菪苷底物具有较高的酶活性,可特异性水解丁公藤粗提取物中的东莨菪苷,从而使粗提物中东莨菪素的含量提高47%左右。东莨菪苷属于香豆素类化合物,此类化合物只有在弱酸或强碱的条件下会发生内酯环水解开环现象[39]。本实验是在pH 7.0的条件下进行,不会发生内酯环水解现象。为了进一步验证东莨菪苷在酸性条件下是否发生水解现象,我们在pH 3.0条件下进行实验,通过加酶和对照实验结果表明,两者均只检测出单一物质,未出现其他物质,说明在该条件下不会造成东莨菪苷的内酯环水解。丁公藤粗提物中除东莨菪苷被水解成东莨菪素外,其他物质成分没有受到影响,说明副产物含量没有增加,有利于后续分离纯化。本研究表明黑曲霉β-葡萄糖苷酶An-bgl3对东莨菪苷具有专一性,且酶学性质良好,可显著提高丁公藤东莨菪素提取得率,是一种酶法提取东莨菪素的优良酶资源。
| [1] |
ANTIKA LD, TASFIYATI AN, HIKMAT H, SEPTAMA AW. Scopoletin: a review of its source, biosynthesis, methods of extraction, and pharmacological activities. Zeitschrift Fur Naturforschung Section C-a Journal of Biosciences, 2022, 77(7/8): 303-316.
|
| [2] |
PAN R, DAI Y, GAO XH, LU D, XIA YF. Inhibition of vascular endothelial growth factor-induced angiogenesis by scopoletin through interrupting the autophosphorylation of VEGF receptor 2 and its downstream signaling pathways. Vascular Pharmacology, 2011, 54(1-2): 18-28. DOI:10.1016/j.vph.2010.11.001
|
| [3] |
IQBAL M, VERPOORTE R, KORTHOUT HAAJ, MUSTAFA NR. Phytochemicals as a potential source for TNF-alpha inhibitors. Phytochemistry Reviews, 2013, 12(1): 65-93. DOI:10.1007/s11101-012-9251-7
|
| [4] |
UMUKORO S, ALADEOKIN AC. Evaluation of the anti-stress and anticonvulsant activities of leaf extract of Alchornea cordifolia in mice. Journal of Ethnopharmacology, 2010, 127(3): 768-770. DOI:10.1016/j.jep.2009.11.023
|
| [5] |
MLADENKA P, MACAKOVA K, ZATLOUKALOVA L, REHAKOVA Z, SINGH BK, PRASAD AK, PARMAR VS, JAHODAR L, HRDINA R, SASO L. In vitro interactions of coumarins with iron. Biochimie, 2010, 92(9): 1108-1114. DOI:10.1016/j.biochi.2010.03.025
|
| [6] |
YIN HL, LI JH, LI J, LI B, CHEN L, TIAN Y, LIU SJ, ZHANG T, DONG JX. Four new coumarinolignoids from seeds of Solanum indicum. Fitoterapia, 2013, 84: 360-365. DOI:10.1016/j.fitote.2012.09.002
|
| [7] |
ANAND P, SINGH B, SINGH N. A review on coumarins as acetylcholinesterase inhibitors for Alzheimer's disease. Bioorganic & Medicinal Chemistry, 2012, 20(3): 1175-1180.
|
| [8] |
马晓峰. 靶向电压门控钙通道的东莨菪内酯杀螨机制研究[D]. 重庆: 西南大学硕士学位论文, 2020. MA XF. Research on acaricidal mechanism of scopoletin targeting voltage-gated calcium channels[D]. Chongqing: Master's Thesis of Southwest University, 2020 (in Chinese). |
| [9] |
GRANA E, COSTAS-GIL A, LONGUEIRA S, CELEIRO M, TEIJEIRA M, REIGOSA MJ, SANCHEZ-MOREIRAS AM. Auxin-like effects of the natural coumarin scopoletin on Arabidopsis cell structure and morphology. Journal of Plant Physiology, 2017, 218: 45-55. DOI:10.1016/j.jplph.2017.07.007
|
| [10] |
HAW CY, CHEN CH, HSU CC, CHEN CC, TSAI YC, TSAI YC. Antioxidant properties of scopoletin isolated from Sinomonium acutum. Phytotherapy Research, 2003, 17(7): 823-825. DOI:10.1002/ptr.1170
|
| [11] |
TRIPATHI AK, BHAKUNI RS, UPADHYAY S, GAUR R. Insect feeding deterrent and growth inhibitory activities of scopoletin isolated from artemisia annua against Spilarctia obliqua (Lepidoptera: Noctuidae). Insect Science, 2011, 18(2): 189-194. DOI:10.1111/j.1744-7917.2010.01350.x
|
| [12] |
TZENG TC, LIN YL, JONG TT, CHANG CMJ. Ethanol modified supercritical fluids extraction of scopoletin and artemisinin from Artemisia annua L. Separation and Purification Technology, 2007, 56(1): 18-24. DOI:10.1016/j.seppur.2007.01.010
|
| [13] |
SRAMSKA P, MACIEJKA A, TOPOLEWSKA A, STEPNOWSKI P, HALINSKI LP. Isolation of atropine and scopolamine from plant material using liquid-liquid extraction and extrelut (R) columns. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2017, 1043: 202-208. DOI:10.1016/j.jchromb.2016.09.003
|
| [14] |
JOKIĆ S, RAJIC M, BILIC B, MOLNAR M. Supercritical extraction of scopoletin from Helichrysum italicum (Roth) G. don flowers. Phytochemical Analysis, 2016, 27(5): 290-295. DOI:10.1002/pca.2630
|
| [15] |
徐飞, 王晓中, 张雷, 龚波林. HPLC测定宁夏枸杞中东莨菪素和东莨菪苷含量. 中国实验方剂学杂志, 2012, 18(13): 67-70. XU F, WANG XZ, ZHANG L, GONG BL. Determination of scopoletin and scopolin in Lycium barbarum by HPLC. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(13): 67-70 (in Chinese). |
| [16] |
孙雅丽, 刘碗露, 刘亚楠, 潘勋, 彭诚. 山莓东莨菪内酯的提取工艺. 贵州农业科学, 2018, 46(5): 120-122. SUN YL; LIU WL; LIU YN, PAN X, PENG C. Extraction technology of scopoletin from Rubus corchorifolius. Guizhou Agricultural Sciences, 2018, 46(5): 120-122 (in Chinese). |
| [17] |
TASFIYATI AN, ANTIKA LD, DEWI RT, SEPTAMA AW, SABARUDIN A, ERNAWATI T. An experimental design approach for the optimization of scopoletin extraction from Morinda citrifolia L. using accelerated solvent extraction. Talanta, 2022, 238: 123010. DOI:10.1016/j.talanta.2021.123010
|
| [18] |
徐小昆, 陈志永, 廖立平, 张紫佳, 王峥涛. 丁公藤属植物中东莨菪苷, 绿原酸, 东莨菪素, 异绿原酸A, 异绿原酸B和异绿原酸C的含量测定. 中国中药杂志, 2015, 40(6): 1119-1122. XU XK, CHEN ZY, LIAO LP, ZHANG ZJ, WANG ZT. Determination of scopolin, chlorogenic acid, scopoletin, isochlorogenic acid A, isochlorogenic acid B and isochlorogenic acid C in plants of Erycibe. China Journal of Chinese Materia Medica, 2015, 40(6): 1119-1122 (in Chinese). |
| [19] |
BHATIA Y, MISHRA S, BISARIA VS. Microbial beta-glucosidases: cloning, properties, and applications. Critical Reviews in Biotechnology, 2002, 22(4): 375-407. DOI:10.1080/07388550290789568
|
| [20] |
ABDELJALIL S, BORGI I, CARVALHO S, JMAL-HAMMAMI L, GARGOURI A. Molecular and bioinformatics analyses reveal two differentially expressed intracellular GH1 beta-glucosidases from the rare alkalophilic fungus Stachybotrys microspora. Gene, 2019, 703: 134-144. DOI:10.1016/j.gene.2019.04.007
|
| [21] |
WILKOWSKA A, POGORZELSKI E. Aroma enhancement of cherry juice and wine using exogenous glycosidases from mould, yeast and lactic acid bacteria. Food Chemistry, 2017, 237: 282-289. DOI:10.1016/j.foodchem.2017.05.120
|
| [22] |
WANG H, LIN X, LI S, LIN J, XIE C, LIU D, YAO D. Rational molecular design for improving digestive enzyme resistance of beta-glucosidase from Trichoderma viride based on inhibition of bound state formation. Enzyme and Microbial Technology, 2020, 133: 109465. DOI:10.1016/j.enzmictec.2019.109465
|
| [23] |
ZHOU L, LI S, ZHANG T, MU W, JIANG B. Properties of a novel polydatin-beta-d-glucosidase from Aspergillus niger SK34.002 and its application in enzymatic preparation of resveratrol. Journal of the Science of Food and Agriculture, 2016, 96(7): 2588-2595. DOI:10.1002/jsfa.7465
|
| [24] |
ASHA BM, PATHMA J, SAKTHIVEL N. Isolation and characterization of a novel thermostable beta-glucosidase from Bacillus subtilis SU40. Applied Biochemistry and Microbiology, 2015, 51(1): 24-29.
|
| [25] |
刘震, 朱秋享, 石贤爱, 彭永辉, 陈荫楠. β-葡萄糖苷酶体外分子改造研究进展. 福州大学学报(自然科学版), 2015, 43(4): 565-571. LIU Z, ZHU QX, SHI XA, PENG YH, CHEN YN. Development in molecular modification of β-glucosidase in vitro. Journal of Fuzhou University (Natural Science Edition), 2015, 43(4): 565-571 (in Chinese). |
| [26] |
LIU DY, ZHANG RF, YANG XM, ZHANG ZH, SONG S, MIAO YZ, SHEN QR. Characterization of a thermostable beta-glucosidase from Aspergillus fumigatus Z5, and its functional expression in Pichia pastoris X33. Microbial Cell Factories, 2012, 11(1): 25. DOI:10.1186/1475-2859-11-25
|
| [27] |
HUANG C, FENG Y, PATEL G, XU XQ, QIAN J, LIU Q, KAI GY. Production, immobilization and characterization of beta-glucosidase for application in cellulose degradation from a novel Aspergillus versicolor. International Journal of Biological Macromolecules, 2021, 177: 437-446. DOI:10.1016/j.ijbiomac.2021.02.154
|
| [28] |
KARAMI F, GHORBANI M, MAHOONAK AS, KHODARAHMI R. Fast, inexpensive purification of beta-glucosidase from Aspergillus niger and improved catalytic/physicochemical properties upon the enzyme immobilization: possible broad prospects for industrial applications. LWT-Food Science and Technology, 2020, 118: 108770. DOI:10.1016/j.lwt.2019.108770
|
| [29] |
CHEN Z, LIU Y, LIU L, CHEN Y, LI S, JIA Y. Purification and characterization of a novel beta-glucosidase from Aspergillus flavus and its application in saccharification of soybean meal. Preparative Biochemistry & Biotechnology, 2019, 49(7): 671-678.
|
| [30] |
ZHAO J, SHI DC, YANG S, LIN H, CHEN HG. Identification of an intracellular beta-glucosidase in Aspergillus niger with transglycosylation activity. Applied Microbiology and Biotechnology, 2020, 104(19): 8367-8380. DOI:10.1007/s00253-020-10840-4
|
| [31] |
VOLKOV PV, ROZHKOVA AM, ZOROV IN, SINITSYN AP. Cloning, purification and study of recombinant GH3 family beta-glucosidase from Penicillium verruculosum. Biochimie, 2020, 168: 231-240. DOI:10.1016/j.biochi.2019.11.009
|
| [32] |
YAN FY, XIA W, ZHANG XX, CHEN S, NIE XZ, QIAN LC. Characterization of beta-glucosidase from Aspergillus terreus and its application in the hydrolysis of soybean isoflavones. Journal of Zhejiang University-Science B, 2016, 17(6): 455-464. DOI:10.1631/jzus.B1500317
|
| [33] |
ABDELLA A, EL-BAZ AF, IBRAHIM IA, MAHROUS EE, YANG ST. Biotransformation of soy flour isoflavones by Aspergillus niger NRRL 3122 beta-glucosidase enzyme. Natural Product Research, 2018, 32(20): 2382-2391. DOI:10.1080/14786419.2017.1413569
|
| [34] |
徐星, 肖华, 黄琳琳, 别松涛. 黑曲霉胞外β-葡萄糖苷酶的纯化及酶学性质的研究. 天津科技大学学报, 2015, 30(5): 15-19. XU X, XIAO H, HUANG LL, BIE ST. Purification of β-glucosidase from Aspergillus niger and its enzymological character. Journal of Tianjin University of Science & Technology, 2015, 30(5): 15-19 (in Chinese). |
| [35] |
戴爽, 李荷. β-葡萄糖苷酶Bgl747的定向筛选、重组表达与酶学性质. 微生物学通报, 2021, 48(8): 2524-2533. DAI S, LI H. Targeted screening, recombinant expression and enzymatic properties of β-glucosidase Bgl747. Microbiology China, 2021, 48(8): 2524-2533 (in Chinese). |
| [36] |
张洪鑫, 陈小泉, 蒋玲玲. 金属离子对纤维素酶内切酶和外切酶活性的影响. 纤维素科学与技术, 2011, 19(4): 6-13. ZHANG HX, CHEN XQ, JIANG LL. Influence of the metal ions on the activity of endo-l, 4-β-d-glucanase and exo-1, 4-β-d-glucanase. Journal of Cellulose Science and Technology, 2011, 19(4): 6-13 (in Chinese). |
| [37] |
KUMAR P, RYAN B, HENEHAN GTM. Beta-glucosidase from Streptomyces griseus: nanoparticle immobilisation and application to alkyl glucoside. synthesis. Protein Expression and Purification, 2017, 132: 164-170.
|
| [38] |
赵林果, 游丽金, 孟鹏, 余世袁. 黑曲霉胞外耐高糖β-葡萄糖苷酶的分离纯化及部分特性研究. 林产化学与工业, 2007(6): 41-46. ZHAO LG, YOU LJ, MENG P, YU SY. Study on purification and some properties of a highly glucose-tolerant extracellular β-glucosidase from Aspergillus niger. Chemistry and Industry of Forest Products, 2007(6): 41-46 (in Chinese). |
| [39] |
张须学, 陈晓北, 吕华瑛. 天然药物化学. 西安: 西安交通大学出版社, 2012: 165. ZHANG XX, CHEN XB, LV HY. Chemistry of Natural Medicinal. Xi'an: Xi'an Jiaotong University Press, 2012: 165 (in Chinese). |
 2023, Vol. 39
2023, Vol. 39




