中国科学院微生物研究所、中国微生物学会主办
文章信息
- 崔柳伟, 王凯峰, 纪晓俊
- CUI Liuwei, WANG Kaifeng, JI Xiaojun
- 四乙酰基植物鞘氨醇生物合成的研究进展
- Fermentative production of tetraacetyl phytosphingosine: a review
- 生物工程学报, 2023, 39(6): 2204-2214
- Chinese Journal of Biotechnology, 2023, 39(6): 2204-2214
- 10.13345/j.cjb.221021
-
文章历史
- Received: December 21, 2022
- Accepted: February 28, 2023
- Published: March 3, 2023
近年来,随着科学技术的快速发展和人们对生活品质追求的提高,天然安全的护肤品原料受到了市场的广泛关注[1]。四乙酰基植物鞘氨醇是一种天然的护肤品原料,具有保湿、抗氧化、美白祛斑等功效,并在促进皮肤屏障的自我修复方面效果显著,是治疗皮肤性疾病的潜在药物[2]。目前,四乙酰基植物鞘氨醇已通过国家食品药品监督管理总局(China Food and Drug Administration, CFDA)的批准,广泛添加于高档护肤品中。同时,四乙酰基植物鞘氨醇可以通过去乙酰化生成保湿护肤品原料神经酰胺的关键前体——植物鞘氨醇[3]。植物鞘氨醇主要分布于小麦等植物种子中,其含量极少,提取极为困难,有“植物软黄金”之称。现有的植物鞘氨醇生产方法不仅提纯困难而且产量较低,难以满足当前市场需求[4]。而采用基于四乙酰基植物鞘氨醇脱乙酰法来合成植物鞘氨醇成本更低、周期更短,最重要的是其原料更易获得。已有研究表明,四乙酰基植物鞘氨可通过微生物发酵获得[5],这一工艺路线因具备上述诸多优点,将成为未来植物鞘氨醇规模化生产的首选方法。
本文介绍了四乙酰基植物鞘氨醇的来源及功能,重点阐述了四乙酰基植物鞘氨醇的生物合成途径和近年来实现其高产的策略,并展望了四乙酰基植物鞘氨醇工业生产的未来前景。
1 四乙酰基植物鞘氨醇概述 1.1 四乙酰基植物鞘氨醇的发现1932年,一群研究人员在研究加勒比海沿岸的零陵香豆果(据当地人说能给人带来好运)时,意外地在其果皮中发现了一种神奇的酵母——后陆续被分类命名为汉逊西弗酵母(Hansenula ciferrii)[5]和毕赤西弗酵母(Pichia ciferrii)[6],最终分类命名为威克汉姆西弗酵母(Wickerhamomyces ciferrii),这种神奇的酵母能够源源不断地产生合成鞘脂的关键底物。1956年,在培养威克汉姆西弗酵母NRRL Y-1031单倍体11号菌株时,发现了大量未报道过的晶体[7]。而后,Wickerham等[8]发现其分泌的晶体主要成分是完全乙酰化的植物鞘氨醇,即四乙酰基植物鞘氨醇。
威克汉姆西弗酵母是一种属于Wickerhamomyces属的出芽酵母,通常通过出芽无性繁殖,也可以形成假菌丝[9],该酵母一般存在于地表水和植物表皮中。威克汉姆西弗酵母与其他已知酵母的不同之处在于其具有高活性的鞘氨醇合成代谢途径,是已知唯一大量生产和分泌四乙酰植物鞘氨醇的微生物。四乙酰基植物鞘氨醇上游合成途径中的二氢鞘氨醇和植物鞘氨醇具有较高细胞毒性,尽管在乙酰化后毒性会降低,但二氢鞘氨醇和植物鞘氨醇仍有少部分积累在细胞中,而威克汉姆西弗酵母细胞可以耐受这种毒性[10-11]。自1932年以来,研究者们从探究威克汉姆西弗酵母的染色体倍性开始,已使用代谢工程,随机突变等手段将四乙酰基植物鞘氨醇的产量从0.23 g/L提升至22.1 g/L,实现了威克汉姆西弗酵母生产力的大幅提升。利用威克汉姆西弗酵母生产四乙酰基植物鞘氨醇具有成本较低、原料易获取、过程温和等优点,符合绿色发展的趋势(研究历程见图 1),因此,威克汉姆西弗酵母成为合成四乙酰基植物鞘氨醇极具吸引力的宿主微生物;利用威克汉姆西弗酵母合成四乙酰基植物鞘氨醇及其衍生物,日渐成为各国科学家争相研究的热点。

|
| 图 1 利用威克汉姆西弗酵母生产四乙酰基植物鞘氨醇研究的重要时间节点 Fig. 1 Timeline of important achievements in the research of tetraacetyl phytosphingosine fermentation by Wickerhamomyces ciferrii. |
| |
四乙酰基植物鞘氨醇是植物鞘氨醇完全乙酰化的产物,由一条18个碳的碳链作为骨架,在1、3、4号碳上分别携带一个乙酰化的羟基,同时在2号位的碳上携带一个乙酰化的胺(图 2)。除了可以通过去乙酰化生成植物鞘氨醇,作为前体用于制备神经酰胺外,其本身作为一种酯型非离子表面活性剂。它具有良好的乳化、分散、和润滑能力,与皮肤的兼容性极佳,在化妆品、护肤品领域有着广泛应用,具有保湿、美白祛斑、抗氧化等功效[21],成为化妆品配方中的重要成分。由此可见,四乙酰基植物鞘氨醇有着巨大的市场空间和发展潜力,市场上目前已存在多款添加四乙酰基植物鞘氨醇的高端化妆品。20世纪90年代起,德国赢创工业集团(Evonik Industries AG)和韩国斗山集团(DOOSAN)等公司[22]陆续开始进行四乙酰基植物鞘氨醇的研究开发和工业生产,并将其作为护肤品添加剂使用。我国华熙生物科技股份有限公司也正在向该领域进军[19]。此外,四乙酰基植物鞘氨醇在医学领域也大有作为,其具有抑制炎症的作用,是治疗慢性炎症性皮肤病的潜在外用药物[23]。
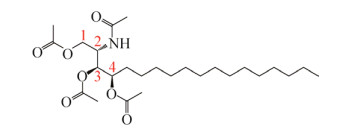
|
| 图 2 四乙酰基植物鞘氨醇的结构式 Fig. 2 Structural formula of tetraacetyl phytosphingosine. |
| |
自从2012年,Schneider等[24]公布了威克汉姆西弗酵母F-60-10基因草图后,研究者们逐渐解析了四乙酰基植物鞘氨醇的生物合成路径,为后续的菌株代谢工程改造奠定了基础。威克汉姆西弗酵母中鞘氨醇的合成发生在内质网膜上,其中四乙酰基植物鞘氨醇的合成代谢受到严格调控,如图 3所示。L-丝氨酸和棕榈酰辅酶A缩合成3-酮基-二氢鞘氨醇是四乙酰基植物鞘氨醇从头合成的第一步,该反应由lcb1和lcb2编码的丝氨酸棕榈酰转移酶(serine palmitoyl transferase, Spt)催化,该酶催化的反应已被证明是鞘氨醇合成中的关键步骤[25-26]。随后3-酮基-二氢鞘氨醇还原酶催化3-酮基-二氢鞘氨醇还原为二氢鞘氨醇[27]。二氢鞘氨醇通过syr2编码的C4羟基化酶生成植物鞘氨醇。植物鞘氨醇的乙酰化是威克汉姆西弗酵母特有的代谢途径,Veld等[28]通过对威克汉姆西弗酵母菌株进行蛋白质组学分析,成功鉴定出催化植物鞘氨醇完全乙酰化的长链鞘氨醇乙酰转移酶(Sli1, Atf2),植物鞘氨醇经过Sli1和Atf2的联合乙酰化,生成了四乙酰基植物鞘氨醇,具体而言,sli1编码的乙酰转移酶催化初始的O-和N-乙酰化,产生三乙酰基植物鞘氨醇,三乙酰植物鞘氨醇后被atf2编码的乙酰转移酶O-乙酰化以产生四乙酰基植物鞘氨醇[29]。此外,L-丝氨酸还可以通过cha1编码的L-丝氨酸脱氨酶和shm1、shm2编码的L-丝氨酸羟甲基转移酶生成丙酮酸、l-甘氨酸和5, 10-二甲基四氢叶酸。二氢鞘氨醇和植物鞘氨醇可以通过被lcb4编码的鞘氨醇激酶磷酸化进入补救途径以生成磷酸乙醇胺和脂肪醛,或通过N-酰化生成神经酰胺。
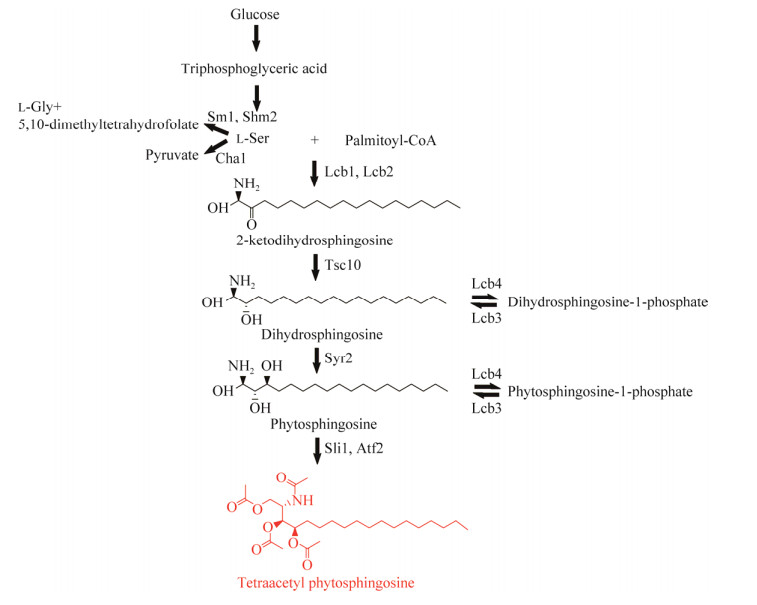
|
| 图 3 威克汉姆西弗酵母中四乙酰基植物鞘氨醇从头合成途径 Fig. 3 De novo synthesis pathway of TAPS in Wickerhamomyces ciferrii. Shm1, Shm2: L-serine hydroxymethyltransferase; Cha1: L-serine deaminase; Lcb1, Lcb2: Serine palmitoyltransferase; Tsc10: 3-keto-dihydrosphinganine reductase; Syr2: C-4-hydroxylase; Sli1: O- and N- acetyltransferase; Atf2: O-acetyltransferase; Lcb3: Sphingosine phosphatase; Lcb4: Sphingosine kinase. Shm1,Shm2:L-丝氨酸羟甲基转移酶;Cha1:L-丝氨酸脱氨酶;Lcb1, Lcb2:丝氨酸棕榈酰转移酶;Tsc10:3-酮基-二氢鞘氨醇还原酶;Syr2:C4羟化酶;Sli1:O-和N-乙酰转移酶;Atf2:O-乙酰转移酶;Lcb3:鞘氨醇磷酸酶;Lcb4:鞘氨醇激酶 |
| |
此外,研究人员已尝试在其他酵母系统中探究鞘氨醇代谢途径,结果表明它们都不能自主合成四乙酰基植物鞘氨醇。例如,在酿酒酵母中,orm1和orm2编码的抑制蛋白与Spt形成复合物,并在低鞘氨醇水平下通过磷酸化逆失活,该复合物被认为是鞘脂稳态的重要调节剂[30]。Kondo等[31]在酿酒酵母(Saccharomyces cerevisiae)中研究了植物鞘氨醇的后期代谢产物,发现植物鞘氨醇与其他鞘氨醇在酵母细胞中皆代谢为甘油磷脂,其中植物鞘氨醇被转化为十五烷酸(C15:0)及其衍生物。上述研究表明,尽管酿酒酵母中存在着鞘氨醇代谢途径,但仅能积累植物鞘氨醇而无法生产四乙酰基植物鞘氨醇。
3 提高四乙酰基植物鞘氨醇生物合成产量的策略自发现威克汉姆西弗酵母可天然积累四乙酰基植物鞘氨醇以来,研究者们尝试了多种策略来进一步提高其生物合成水平,以将其推向工业应用(图 4)。迄今为止,提高四乙酰基植物鞘氨醇产量的策略及其效果已总结在下文中,如表 1所示。
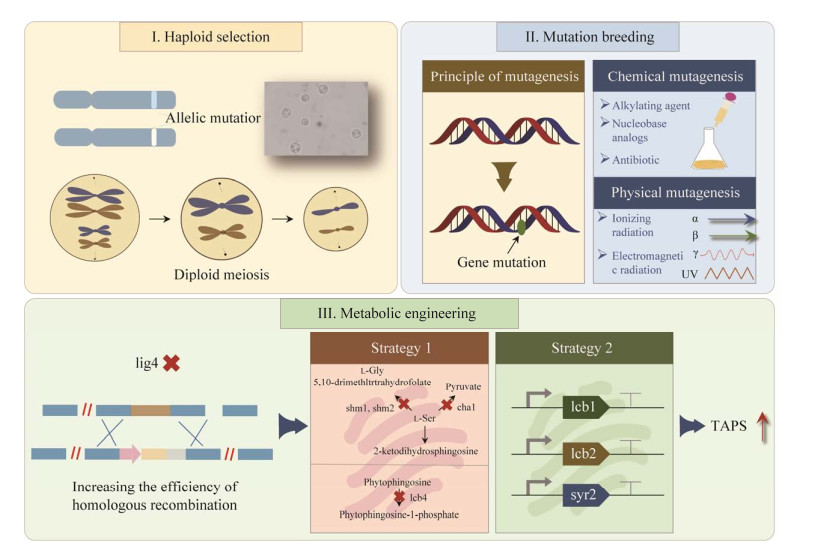
|
| 图 4 提高威克汉姆西弗酵母中四乙酰基植物鞘氨醇产量的策略 Fig. 4 Strategies for improving the production of TAPS in Wickerhamomyces ciferrii. |
| |
| Original strains | Strategies | Substrates | Fermentation scales | Titers (g/L) or strategy effects |
References |
| W. ciferrii NRRL Y-1031 | Haploid screening | Glucose | Bioreactor | 0.32 | [8] |
| W. ciferrii CGMCC 19562 | Haploid screening, fed-batch fermentation |
Glucose | Bioreactor | 22.10 | [22] |
| W. ciferrii F-60-10 | Physical and chemical mutation breeding |
Glucose | Shake flask | 0.23 | [32] |
| W. ciferrii F-60-10 | Mutation breeding and selection techniques |
Glucose | Shake flask | 0.37 | [14] |
| W. ciferrii NRRL Y-1031 | Chemical (EMS) mutation, fed-batch culture |
Glucose+ Molasses |
Bioreactor | 2.90 | [20] |
| W. ciferrii F-60-10 | Physical (γ ray) mutation, batch fermentation |
Glycerol | Bioreactor | 17.70 | [18] |
| W. ciferrii DSCC 7-25 | Δlcb4, Δpox3 | Glycerol | Bioreactor | 3.50 | [33] |
| W. ciferrii F-60-10 | ΔShm1, ΔLcb4, ΔShm2, ΔOrm1, ΔOrm2, ΔCha1, Lcb1↑, Lcb2↑, Syr2↑ | Glucose | Shake flask | 2.00 | [17] |
| W. ciferrii KFCC 10937 | lcb2↑ | Glycerol | Bioreactor | 7.40 | [34] |
| W. ciferrii F-60-10 | Ura3, Lys2 as screening markers | – | – | Developed an efficient transformation system | [35] |
| W. ciferrii F-60-10 | Δlig4 | – | – | Homologous recombination efficiency increased to 87% |
[16] |
| W. ciferrii F-60-10 | Fed-batch fermentation, add L-serine | Glycerol | Bioreactor | 2.10 | [36] |
| W. ciferrii DSCC 7-25 | Fermentation optimization | Glycerol | Bioreactor | 14.00 | [37] |
| –: Not mentioned in the references. | |||||
最初发现的威克汉姆西弗酵母NRRL Y1031是一种二倍体菌株,在1932年由Lodder所描述[12]。Wickerham等[8]从该菌株的子囊孢子中获得分离株,并确定了子囊孢子分离物性别的方法,成功分离出单倍体菌株威克汉姆西弗酵母F-60-10。1962年,研究者们开始使用威克汉姆西弗酵母进行四乙酰基植物鞘氨醇的发酵试验,使用其单倍体菌株F-60-10,在10 L生物反应器中进行,最终四乙酰基植物鞘氨醇的产量为2.0 g/ L[13]。John等[36]以威克汉姆西弗酵母F-60-10为优选菌株,L-丝氨酸为前体,甘油为碳源,添加表面活性剂进行分批补料发酵,最终四乙酰基植物鞘氨醇的最高产量可达到2.1 g/L。研究者们进一步推测二倍体威克汉姆西弗酵母在减数分裂过程中等位基因的重组可形成不同的突变体孢子,从而产生全新的单倍体,其产量可能会高于现有的单倍体威克汉姆西弗酵母F-60-10菌株。于是,基于这一设想,韩国的科学家们采用基于薄层色谱高通量筛选的方法[38]筛选出一株产量较高的单倍体菌株威克汉姆西弗酵母DSCC 7-25,进一步经过一系列发酵优化后,四乙酰基植物鞘氨醇的最高产量可达14.0 g/L[37, 39]。遗憾的是,上述筛选单倍体菌株过程中,存在孢子形成率低的问题,这势必导致不易获得大量的突变菌株,筛选到理想突变株的难度较大。针对该问题,我国华熙生物科技股份有限公司的研究人员张天萌等[19]采用了一种全新的产孢子培养基,将二倍体威克汉姆西弗酵母菌株的孢子产率提高至50%–75%,并进一步通过结晶筛选的方法对突变株进行验证,最终获得的最佳突变株在分批补料发酵的条件下四乙酰基植物鞘氨醇产量可达22.1 g/L。
3.2 菌株诱变育种近些年,除了上述单倍体菌株筛选之外,研究者们进一步通过诱变选育的方法,获得了系列高产四乙酰基植物鞘氨醇的威克汉姆西弗酵母突变株,这种通过诱变筛选的方法已被证明是提高四乙酰基植物鞘氨醇产量的有效方法之一。早在20世纪90年代,Boer等[32]成功运用一系列诱变技术(紫外诱变、甲磺酸乙酯诱变和亚硝基胍诱变),以威克汉姆西弗酵母F-60-10为出发菌株诱变后进行培养,最终获得的最佳突变株的四乙酰基植物鞘氨醇产量提高了40%–60%。2021年,Park等[18]通过将威克汉姆西弗酵母F-60-10暴露于γ射线下照射,获得了一株高产四乙酰基植物鞘氨醇的突变菌株,该突变株在分批发酵过程中四乙酰基植物鞘氨醇的最高产量达17.7 g/L,相较于野生型菌株提高了将近9倍。进一步通过转录组分析[40]发现突变株中3-酮基嘌呤还原酶(Tcs10)的表达量比野生菌株提高了30%,结合代谢途径分析,获知突变株产量提高的原因是代谢过程中3-酮基-二氢鞘氨醇向植物鞘氨醇前体——二氢鞘氨醇的转化得到了加强。2022年,Ahn等[20]采用化学诱变剂甲基磺酸乙酯结合氟化硼二吡咯(dipyrromethene boron difluoride, BODIPY)荧光染料标记筛选的方法,对威克汉姆西弗酵母进行了诱变并高效筛选。BODIPY是一类近红外的短波长荧光染料,它可以特异性地作用于中性脂组成的油滴,使得油滴可以被检测。由于四乙酰基植物鞘氨醇是一类含有长链鞘氨醇的鞘脂,BODIPY可用作酵母细胞中四乙酰基植物鞘氨醇的染色剂。在评估了不同碳源对优化四乙酰基植物鞘氨醇产量的影响后,添加糖蜜作为碳源,使四乙酰基植物鞘氨醇和三乙酰植物鞘氨醇的最大混合产量达到了5.1 g/L,相较于对照菌株的产量提高了60%。该研究中使用的染色筛选方法,为后续进一步通过多轮诱变选育威克汉姆西弗酵母提高四乙酰基植物鞘氨醇产量提供了可借鉴的研究思路。目前,通过经典诱变选育优化四乙酰基植物鞘氨醇生产的尝试已经有多项成功的案例,并产生了商业上可行的四乙酰基植物鞘氨醇生产菌株[20]。
3.3 代谢工程改造除上述策略外,通过代谢工程改造威克汉姆西弗酵母菌株提高四乙酰基植物鞘氨醇的生产能力也是最直接的方法。为提高四乙酰基植物鞘氨醇的产量,Lee等[34]使用了含有编码丝氨酸棕榈酰转移酶基因lcb2的质粒prACL2转化进入宿主菌,使目标产物产量提高了1.3倍。在此基础上,Lee等[41]通过以核糖体基因L41作为显性标记,将核糖体DNA作为多拷贝基因整合靶点,过表达四乙酰基植物鞘氨醇合成途径中编码Spt的两个基本亚基之一的lcb2基因,实现了四乙酰基植物鞘氨醇产量的翻倍。此后,Boergel等[35]公开了一种可用于威克汉姆西弗酵母的基因工程转化系统,描述了这种酵母的营养缺陷型的分离和能够补充这些营养缺陷型菌株的营养需求的核苷酸序列(ura3或lys2筛选标记)。由于威克汉姆西弗酵母F-60-10菌株存在同源重组效率低的问题,Schorsch等[16]通过删除DNA连接酶Ⅳ同源基因(lig4),构建了一个缺乏非同源末端连接(non-homologous end connections, NHEJ)途径的lig4缺失菌株以提高同源重组效率,与对照菌株威克汉姆西弗酵母F-60-10相比,其基因靶向效率显著提高。在此基础上,Christoph等[17]为了提高该酵母四乙酰植物鞘氨醇的产量,结合了两种策略:一是增加了作为Spt底物的L-丝氨酸的可用性;二是工程改造威克汉姆西弗酵母的鞘氨醇代谢途径。例如,经过系列代谢工程改造后的威克汉姆西弗酵母突变菌株CSS.L4.O.L2.L1.S2可产生高达2.0 g/L的四乙酰基植物鞘氨醇(出发菌株的最大浓度仅为0.28 g/L),为实现工业发酵四乙酰基植物鞘氨醇铺平了道路。该突变菌株是通过结合基因缺失(shm1、shm2、cha1、lcb4和orm12)和过表达(lcb1、lcb2和syr2)而获得的。此突变菌株通过阻断L-ser、二氢鞘氨醇及植物鞘氨醇的降解和拉动3-酮基-二氢鞘氨醇、植物鞘氨醇的表达以实现四乙酰基植物鞘氨醇的积累。其中,cha1已被证明是L-丝氨酸和鞘氨醇代谢之间调节联系的重要参与者,它的表达由游离鞘氨醇诱导,是调节鞘脂稳态不可或缺的一部分。除了使用威克汉姆西弗酵母F-60-10作为出发菌株之外,Choi等[33]尝试使用威克汉姆西弗酵母单倍体DSCC 7-25作为底盘细胞重建代谢途径生产四乙酰基植物鞘氨醇,在敲除编码乙酰辅酶A氧化酶的编码基因pox3和编码长链鞘氨醇激酶的编码基因lcb4后,产量相比于对照菌株提高2.3倍。威克汉姆西弗酵母中sli1和stf2编码的独特的乙酰转移酶活性已被确定为其有效产生乙酰化植物鞘氨醇的主要原因之一[29],因此,有研究尝试通过引入威克汉姆西弗酵母中的sli1或atf2基因到其他酵母中表达以合成三乙酰或四乙酰化植物鞘氨醇,虽然有目标产物积累,但产量并未达到威克汉姆西弗酵母的水平。例如,Han等[42]尝试使用解脂耶氏酵母(Yarrowia lipolytic)作为宿主共表达了威克汉姆西弗酵母来源的编码乙酰转移酶的sli1和atf2基因,并敲除lcb4基因,成功构建了产四乙酰基植物鞘氨醇的解脂耶氏酵母菌株。经过一系列发酵优化后在发酵56 h内产生了0.65 g/L的四乙酰基植物鞘氨醇。
4 结论与展望近年来,由于四乙酰基植物鞘氨醇可作为重要的天然护肤化妆品添加剂,且其去乙酰化后可以作为前体合成性能卓越的护肤品原料神经酰胺,因此受到了广泛关注。随着人们生活质量的日益提高,对四乙酰基植物鞘氨醇的需求将不断增加,因此该产品具有较好的开发前景。威克汉姆西弗酵母作为目前唯一能合成四乙酰基植物鞘氨醇的微生物,充分发挥其代谢潜能使其高效积累目标产物,不仅是获得四乙酰基植物鞘氨醇的一种经济便捷的方法,同时这种方法由于产品天然且条件温和,符合当前绿色发展的理念。
目前提高威克汉姆西弗酵母合成四乙酰基植物鞘氨醇能力的主要技术包括:单倍体筛选、诱变选育和代谢工程改造,采用这3种策略已经产生了一定的效果,四乙酰基植物鞘氨醇的产量得到了显著提升。但上述方法仍存在一些问题:如单倍体筛选依靠自然突变效率不高,菌株诱变选育方法正向突变率较低且依赖筛选方法,而代谢工程改造方案中缺乏高效的遗传操作方法。针对这些问题,未来研究的重点可从以下方面展开:持续开发高产菌株的高通量筛选方法,以方便从大量突变菌株中快速高效地筛选出高产菌株;另外,进一步通过合成生物学技术改造威克汉姆西弗酵母以提高目标产物产量是未来研究的重点。与传统模式微生物相比,威克汉姆西弗酵母的合成生物学改造仍然存在工具少、效率低、操作繁琐等问题,在底盘系统化改造、复杂途径组装优化等方面存在较大的挑战。需要进一步挖掘新的合成生物学元件,如新的启动子和终止子元件,在此基础上构建适用于威克汉姆西弗酵母的稳定性高效表达载体,用于快速和高效的基因工程操作。在复杂途径组装与优化方面,可进一步提高外源基因的转化效率,建立高效的DNA组装方法,全面实施和利用CRISPR/Cas基因编辑技术,在此基础上开发基因表达的精细调控策略。如此,可充分利用并挖掘威克汉姆西弗酵母的代谢潜能,使其高效合成目标产物四乙酰基植物鞘氨醇。此外,利用上述开发的合成生物学工具结合系统生物学手段不断探究威克汉姆西弗酵母合成四乙酰基植物鞘氨醇的代谢机制也是未来研究的重点方向之一。
| [1] |
CHEN XW. Review of Polygonatum sibiricum: a new natural cosmetic ingredient. Die Pharmazie, 2019, 74(9): 513-519.
|
| [2] |
KIM HJ, KANG SY, KIM SJ, KIM SH, KIM TY. Potentiation of UVB-induced apoptosis by novel phytosphingosine derivative, tetraacetyl phytosphingosine in HaCaT cell and mouse skin. Apoptosis, 2004, 9(4): 449-456. DOI:10.1023/B:APPT.0000031451.62428.f0
|
| [3] |
刘韵祎, 张嘉文, 刘子菁, 王小燕, 刘乙萱, 姜沛彧, 许阳. 神经酰胺与相关皮肤病的研究进展. 中国麻风皮肤病杂志, 2020, 36(10): 626-630. LIU YY, ZHANG JW, LIU ZJ, WANG XY, LIU YX, JIANG PY, XU Y. Update of the ceramide and related dermatosis. China Journal of Leprosy and Skin Diseases, 2020, 36(10): 626-630 (in Chinese). DOI:10.12144/zgmfskin202010626 |
| [4] |
LIN CC, FAN GT, FANG JM. A concise route to phytosphingosine from lyxose. Tetrahedron Letters, 2003, 44(28): 5281-5283. DOI:10.1016/S0040-4039(03)01281-4
|
| [5] |
WICKERHAM LJ, BURTON KA. A simple technique for obtaining mating types in heterothallic diploid yeasts, with special reference to their uses in the genus hansenula. Journal of Bacteriology, 1954, 67(3): 303-308. DOI:10.1128/jb.67.3.303-308.1954
|
| [6] |
CASEY J, MAUME KA, PETERS ALJ, VELOO RM. Preparation of phytosphingosine derivative: US5618706[P]. 1997-04-08.
|
| [7] |
BRAUN PE, SNELL EE. The biosynthesis of dihydrosphingosine in cell-free preparations of Hansenula ciferri. Proceedings of the National Academy of Sciences of the United States of America, 1967, 58(1): 298-303. DOI:10.1073/pnas.58.1.298
|
| [8] |
WICKERHAM LJ, STODOLA FH. Formation of extracellular sphingolipides by microorganisms. Journal of Bacteriology, 1960, 80(4): 484-491. DOI:10.1128/jb.80.4.484-491.1960
|
| [9] |
KURTZMAN CP. Phylogeny of the ascomycetous yeasts and the renaming of Pichia anomala to Wickerhamomyces anomalus. Antonie Van Leeuwenhoek, 2011, 99(1): 13-23. DOI:10.1007/s10482-010-9505-6
|
| [10] |
TANI M, KIHARA A, IGARASHI Y. Rescue of cell growth by sphingosine with disruption of lipid microdomain formation in Saccharomyces cerevisiae deficient in sphingolipid biosynthesis. Biochemical Journal, 2006, 394(1): 237-242. DOI:10.1042/BJ20051354
|
| [11] |
CHIHIRO T, AYANO K, RISA S, NOBUAKI A, MOTOHIRO T. Involvement of the mitochondrial retrograde pathway in dihydrosphingosine-induced cytotoxicity in budding yeast. Biochemical and Biophysical Research Communications, 2022, 605: 63-69. DOI:10.1016/j.bbrc.2022.03.061
|
| [12] |
LODDER J. Über einige durch das "Centraalbureau voor Schimmelcultures" neuerworbene sporogene Hefearten. Zentr. Bakteriol. Parasitenk. Abt. Ⅱ, 1932, 86: 227-253.
|
| [13] |
MAISTER HG, ROGOVIN SP, STODOLA FH, WICKERHAM LJ. Formation of extracellular sphingolipids by microorganisms. Applied Microbiology, 1962, 10(5): 401-406. DOI:10.1128/am.10.5.401-406.1962
|
| [14] |
PARK CS, JEONG JH, HONG SY, CHOI WS. Microbiological method for preparing sphingolipds using a novel yeast Pichia ciferrii Dscc 7-25: US09/119958[P]. 1999-09-28.
|
| [15] |
BAE JH, SOHN JH, PARK CS, RHEE JS, CHOI ES. Integrative transformation system for the metabolic engineering of the sphingoid base-producing yeast Pichia ciferrii. Applied and Environmental Microbiology, 2003, 69(2): 812-819. DOI:10.1128/AEM.69.2.812-819.2003
|
| [16] |
SCHORSCH C, KÖHLER T, BOLES E. Knockout of the DNA ligase Ⅳ homolog gene in the sphingoid base producing yeast Pichia ciferrii significantly increases gene targeting efficiency. Current Genetics, 2009, 55(4): 381-389. DOI:10.1007/s00294-009-0252-z
|
| [17] |
CHRISTOPH S, TIM K, HEIKO A, ECKHARD B. High-level production of tetraacetyl phytosphingosine (TAPS) by combined genetic engineering of sphingoid base biosynthesis and L-serine availability in the non-conventional yeast Pichia ciferrii. Metabolic Engineering, 2012, 14(2): 172-184. DOI:10.1016/j.ymben.2011.12.002
|
| [18] |
PARK SB, TRAN QG, RYU AJ, YUN JH, KWON KK, LEE YJ, KIM HS. Fluorescence-activated cell sorting- mediated directed evolution of Wickerhamomyces ciferrii for enhanced production of tetraacetyl phytosphingosine. Korean Journal of Chemical Engineering, 2022, 39(4): 1004-1010. DOI:10.1007/s11814-021-1017-8
|
| [19] |
张天萌, 刘金钊, 朱倩倩, 罗德学, 刘英杰, 郭学平. 一种高产鞘脂类微生物菌株、它的筛选方法和它的用途: CN114736815A[P]. 2022-07-12. ZHANG TM, LIU JZ, ZHU QQ, LUO DX, LIU YJ, GUO XP. A kind of high-yield sphingolipid microbial strain, its screening method and its use: CN114736815A[P]. 2022-07-12 (in Chinese). |
| [20] |
AHN, HAN JO, JANG CP, KWON MJ, LEE HU, LEE TH, KIM JH, JIN H. Pichia ciferrii mutant strain having improved sphingolipid and sphingoid base productivity, and preparation method therefor: KRKR2021/007298[P]. 2021-12-30.
|
| [21] |
YECHEZKEL B, SHIMON G. Acetylation of sphingosine bases and long-chain amines by cell-free preparations of Hansenula ciferri. Biochemical and Biophysical Research Communications, 1969, 35(5): 676-680. DOI:10.1016/0006-291X(69)90458-6
|
| [22] |
SEO PC, HEAN JJ, YONG HS, SEOK CW. Production of tetraacetylphytosphingosine for use in cosmetics using a Pichia ciferrii strain: FR9809516A[P]. 2000-01-28.
|
| [23] |
KIM BH, LEE JM, JUNG YG, KIM S, KIM TY. Phytosphingosine derivatives ameliorate skin inflammation by inhibiting NF-κB and JAK/STAT signaling in keratincoytes and mice. Journal of Investigative Dermatology, 2014, 134(4): 1023-1032. DOI:10.1038/jid.2013.453
|
| [24] |
SCHNEIDER J, ANDREA H, BLOM J, JAENICKE S, RÜCKERT C, SCHORSCH C, SZCZEPANOWSKI R, FARWICK M, GOESMANN A, PÜHLER A, SCHAFFER S, TAUCH A, KÖHLER T, BRINKROLF K. Draft genome sequence of Wickerhamomyces ciferrii NRRL Y-1031 F-60-10. Eukaryotic Cell, 2012, 11(12): 1582-1583. DOI:10.1128/EC.00258-12
|
| [25] |
ESMOND ES, SAMUEL JD, ROBERT NB. Biosynthesis of sphingosine and dihydrosphingosine by cell-free systems from Hansenula ciferri. Chemistry and Physics of Lipids, 1970, 5(1): 116-138. DOI:10.1016/0009-3084(70)90013-7
|
| [26] |
BARENHOLZ Y, EDELMAN I, GATT S. The metabolic basis for the accumulation of acetylated sphingosine bases in the yeast Hansenula ciferri. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism, 1971, 248(3): 458-465. DOI:10.1016/0005-2760(71)90235-9
|
| [27] |
STOFFEL W, STICHT G, LEKIM D. Metabolism of sphingosine bases, Ⅵ. synthesis and degradation of sphingosine bases in Hansenula ciferrii. Hoppe-Seyler՚s Zeitschrift Für Physiologische Chemie, 1968, 349(2): 1149-1156. DOI:10.1515/bchm2.1968.349.2.1149
|
| [28] |
VELD F, WOLFF D, SCHORSCH C, KÖHLER T, BOLES E, POETSCH A. Production of tetraacetyl phytosphingosine (TAPS) in Wickerhamomyces ciferrii is catalyzed by acetyltransferases Sli1p and Atf2p. Applied Microbiology and Biotechnology, 2013, 97(19): 8537-8546. DOI:10.1007/s00253-012-4670-3
|
| [29] |
沙费尔S, 法尔维克M, 安德烈埃H, 克勒T, 沃尔夫D, 特尔费尔德F, 珀奇A, 博尔斯E, 朔尔施C. Wickerhamomyces ciferrii的乙酰转移酶: CN201380018786A[P]. 2017-06-27. SCHAFER S, FALVIK M, ANDREA H, KOEHLER T, WOLF D, TELFELD F, PERCH A, BOLS E SCHORSCH C. Acetyltransferase of Wickerhamomyces ciferrii: CN201380018786A[P]. 2017-06-27 (in Chinese). |
| [30] |
LIU M, HUANG CJ, POLU SR, SCHNEITER R, CHANG A. Regulation of sphingolipid synthesis through Orm1 and Orm2 in yeast. Journal of Cell Science, 2012, 125: 2428-2435.
|
| [31] |
KONDO N, OHNO Y, YAMAGATA M, OBARA T, SEKI N, KITAMURA T, NAGANUMA T, KIHARA A. Identification of the phytosphingosine metabolic pathway leading to odd-numbered fatty acids. Nature Communications, 2014, 5: 5338. DOI:10.1038/ncomms6338
|
| [32] |
BOER L, van D, WILDT I. Microbial strains producing sphingolipid bases: US5910425[P]. 1999-06-08.
|
| [33] |
CHOI JY, HWANG HJ, CHO WY, CHOI JI, LEE PC. Differences in the fatty acid profile, morphology, and tetraacetylphytosphingosine-forming capability between wild-type and mutant Wickerhamomyces ciferrii. Frontiers in Bioengineering and Biotechnology, 2021, 9: 662979. DOI:10.3389/fbioe.2021.662979
|
| [34] |
LEE SG, BAE JH, CHOI ES, KANG HA, PARK JS. Genes coding for serine palmitoyltransferase from Pichia ciferrii and methods for producing TAPS using the same: KR19980016309A[P]. 1999-12-06.
|
| [35] |
BOERGEL D, HUELLER T, SCHAFFER S. Methods and materials for the transformation of the yeast Pichia ciferrii: US20070264716[P]. 2007-11-15.
|
| [36] |
JOHN C, PETER C, DELLA H. Method of synthesising phytosphingosine containing ceramides and cosmetic compositions compersing them: GB1993002230[P]. 1994-05-11.
|
| [37] |
PARK CS, JEONG JH, HONG SY, CHOI WS. Yeast Pichia ciferrii: US6194196[P]. 2001-02-27.
|
| [38] |
PEK UH, SEO PC, HONG SY, CHOI WS. Isolation of a novel yeast strain, Pichia ciferrii DSCC 7-25, with high fermentation productivity of sphingolipids: KR19960067997A[P]. 1998-09-15.
|
| [39] |
PARK CS, JEONG JH, HONG SY, CHOI WS. Procede microbiologique de preparation de sphingolipides utilisant une nouvelle levure Pichia ciferrii DSCC 7-25: FR9809516A[P]. 1998-07-24.
|
| [40] |
LEE P, HEE JC, JUN Y. Mutant strain overproducing Taps and Taps production method using same: KRKR2020/007618[P]. 2020-12-17.
|
| [41] |
LEE S, JEONG HC, EUI SS, JEONG HK, HYEON AP, JANG S. Glyceraldehyde-3-phosphate dehydrogenase promoter gene derived from Pichia ciferrii and a process for manufacturing TAPS using thereof: KR1019980033969[P]. 2000-03-15.
|
| [42] |
HAN C, JANG M, KIM MJ, HAN MH, LEE KR, HAHN JS, AHN J. Engineering Yarrowia lipolytica for de novo production of tetraacetyl phytosphingosine. Journal of Applied Microbiology, 2021, 130(6): 1981-1992. DOI:10.1111/jam.14931
|
 2023, Vol. 39
2023, Vol. 39