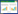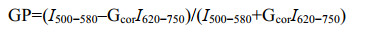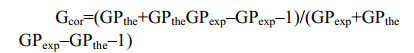Functional analysis of functional membrane microdomains in the biosynthesis of menaquinone-7
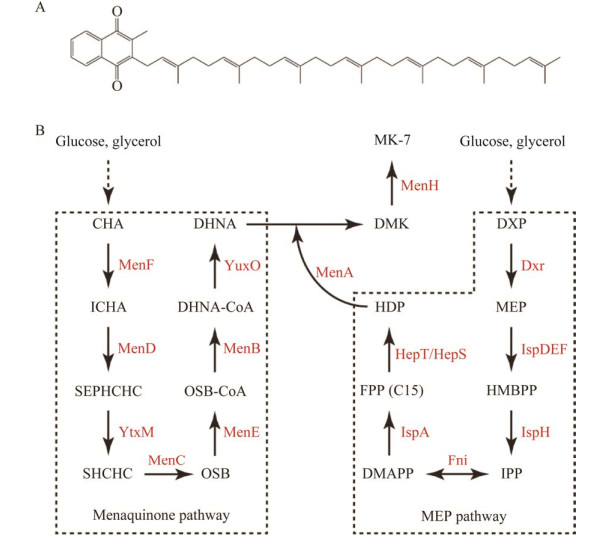
七烯甲萘醌(menaquione-7, MK-7)是维生素K2的一种亚型,由2-甲基-(1, 4)-萘醌核和C3位侧链上7个异戊二烯基团构成[1](图 1A),主要贮存在细胞膜中,在维持骨骼[2]、心脑血管健康[3]等方面具有良好的作用。目前MK-7主要通过发酵食品提取、化学合成和微生物发酵3种方法进行制备,其中,通过微生物发酵法对于实现MK-7的高效合成具有重要意义[4]。在枯草芽孢杆菌(Bacillus subtilis)中存在完整的MK-7合成途径,可以分为糖酵解-磷酸戊糖、分支酸和甲基-4-磷酸赤藓糖醇(methylerythritol-4-phosphate, MEP),以及典型的甲萘醌合成4个模块[5]。其中,骨架结构(1, 4)-2-羟基-2-萘甲酸(1, 4-dihydroxy-2- naphtooic acid, DHNA)由甲萘醌模块负责合成,以分支酸(chorismic acid, CHA)为底物,经由(1, 4)-二羟基-2-萘酰辅酶A水解酶[(1, 4)-dihydroxy-2-naphthoyl-CoA hydrolase, YuxO]、(1, 4)-二羟基-2-萘酰辅酶A合酶[(1, 4)-dihydroxy-2-naphthoyl-CoA synthase, MenB]等7种不同的酶参与催化[6];侧链结构七异戊二烯基焦磷酸(heptaprenyl diphosphate, HDP)由MEP途径负责合成,以1-脱氧-d-木糖-5磷酸(1-deoxyxylulose- 5-phosphate, DXP)为底物,经由七异戊二烯基焦磷酸合酶(heptaprenyl diphosphate synthase component Ι/II, HepS/HepT)、法呢基焦磷酸合酶(farnesyl diphosphate synthase, IspA)和异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase, Fni)等11种不同的酶参与催化[7];随后HDP在1, 4-二羟基-2-萘甲酸辛二烯酯转移酶[(1, 4)-dihydroxy-2-naphthoate heptaprenyltransferase, MenA]的催化下转移到骨架结构的C3位[8],最终通过去甲基甲萘醌甲基转移酶(demethylmenaquinone methyltransferase, MenH)形成MK-7[9](图 1B)。Ma等[11]在枯草芽孢杆菌168中增加部分限速酶的表达量并进行不同组合,最终使MK-7产量达到50 mg/L。Cui等[12]通过增强前体供应和构建Phr60-Rap60-Spo0A群体响应调控系统,使碳流量更多进入MK-7合成途径,最终成功获取一株高产MK-7的菌株,摇瓶水平MK-7产量达到360 mg/L。
区室化可以将代谢途径中亚细胞定位不同的酶聚集于一个区域,以增加底物或酶的局部浓度,实现更快的反应速率和更高的生产率[13]。在真核生物中,可以通过脂筏[14]、线粒体[15]和内质网[16]等实现区室化。例如,Deloache等[17]将紫色杆菌素前体(prodeoxyviolacein, PDV)合成的途径酶VioB和VioE与标准过氧化物酶体基质蛋白1型信号肽(peroxisome target signal type 1, PTS1)标签融合,使酶在过氧化物酶体中表达,显著提高了PDV产量;Avalos等[18]在酵母线粒体中表达Ehrlich途径的相关酶,提高了局部酶的浓度,显著提高了异丁醇的产量。在细菌中,功能膜微域(functional membrane microdomains, FMMs)等结构域的存在亦可使质膜区室化。由脚手架蛋白和聚异戊二烯类物质构成的FMMs参与多种不同类型的细胞生命活动[19]。其中,脚手架蛋白是FMMs的标记蛋白,可以募集蛋白、脂质等物质至FMMs中,并促进这些物质间的相互作用和寡聚化[20-21];聚异戊二烯化合物的存在使FMMs具有高度致密性和疏水性,有助于相关蛋白在FMMs中集聚[22]。Lv等[23]将N-乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc)合成所需的途径酶氨基葡萄糖-6-磷酸乙酰转移酶(GlcNAc-6-phosphate N-acetyltransferase, GNA1)、GlcN-6-磷酸合酶(GlcN-6-phosphate synthase, Glms)、磷酸葡萄糖异构酶(phosphoglucose isomerase, Pgi)和卤酸脱卤酶样磷酸酶(haloacid dehalogenase-like phosphatases, YqaB)与脚手架蛋白融合表达,使4种酶聚集在FMMs中,通过集聚效应和底物通道效应提高酶的催化效率,最终促进了GlcNAc的高效合成。
MK-7的合成同细胞膜有关,FMMs在MK-7的合成过程中可能存在不可或缺的作用。本研究以枯草芽孢杆菌为研究对象,探讨膜上聚异戊二烯化合物MK-7和FMMs之间的相关性,并通过FMMs实现MK-7合成途径中关键酶的区室化。首先,通过可视化观察MK-7和FMMs的分布特征,明确了二者的相关性;其次,通过分析FMMs的完整性破坏前后,细胞膜上MK-7含量和膜有序度的变化,明确MK-7是构成FMMs关键聚异戊二烯类化合物的一种;最后,通过FloA蛋白将MK-7合成途径中的关键酶锚定至FMMs中,获得了一株高产MK-7的菌株BS3AT,摇瓶水平MK-7产量达到300.3 mg/L,3 L发酵罐中MK-7产量达到464.2 mg/L。结果表明,在枯草芽孢杆菌中通过FMMs实现MK-7合成途径中关键酶的区室化,可以有效提高MK-7的产量,这为MK-7的高效合成提供了一种新的思路。
1 材料与方法
1.1 菌株和质粒 本研究所使用的菌株、质粒如表 1所示。
表 1 本研究中所用菌株和质粒
Table 1 Strains and plasmids used in this work
| Name |
Description |
Reference |
| Strains |
|
|
| E. coli JM109 |
For plasmid construction |
Lab stock |
| BS168 |
Bacillus subtilis 168 |
Lab stock |
| BS168C |
BS168 derivate, ΔfloA ΔfloT ΔyisP ΔsqhC |
|
| BS3 |
BS168 derivate, Pveg-kinA-ΔPAS-A ΔkinB ΔspoIIA Δspo0IIE, P43-menF P43-menB Phbs-menE P43-entC ΔdhbB Phbs-tkt P43-ppsA ΔptsG Phbs-aroGfbr: : lox72 P43-aroK Phbs-ispA P43-hepS/T Phbs-kdpG P43-dxr P43-dxs P43-fni Pmena-menA: : lacA Pmena-menA: : thrC Pmena-menA: : dacA |
Lab stock |
| BS3C |
BS3 derivate, ΔfloA ΔfloT ΔyisP ΔsqhC |
This work |
| BS3FA |
BS3 derivate, : : P43-floA (integrated site is between yvoA and nagBA) |
This work |
| BS3FT |
BS3 derivate, : : P43-floT (integrated site is between yvoA and nagBA) |
This work |
| BS3AF |
BS3 derivate, : : P43-floA-fni (integrated site is between yvoA and nagBA) |
This work |
| BS3F |
BS3 derivate, : : P43-fni (integrated site is between yvoA and nagBA) |
This work |
| BS3AI |
BS3 derivate, : : P43-floA-ispA (integrated site is between yvoA and nagBA) |
This work |
| BS3I |
BS3 derivate, : : P43-ispA (integrated site is between yvoA and nagBA) |
This work |
| BS3AT |
BS3 derivate, : : P43-floA-hepT (integrated site is between yvoA and nagBA) |
This work |
| BS3T |
BS3 derivate, : : P43-hepT (integrated site is between yvoA and nagBA) |
This work |
| BS3AO |
BS3 derivate, : : P43-floA-yuxO (integrated site is between yvoA and nagBA) |
This work |
| BS3O |
BS3 derivate, : : P43-yuxO (integrated site is between yvoA and nagBA) |
This work |
| Plasmids |
|
|
| P7C6 |
Pmd18-T containing lox71-Cmr-lox66 cassette |
Lab stock |
| P7S6 |
Pmd18-T containing lox71-Spec-lox66 cassette |
Lab stock |
| P7Z6 |
Pmd18-T containing lox71-Zeo-lox66 cassette |
Lab stock |
| pP43NMK |
Amp, Kan, E. coli-B. subtilis shuttle vector |
Lab stock |
| pHT01 |
Amp, Cm, E. coli-B. subtilis shuttle vector |
Lab stock |
| pHT01-floA-eGFP |
floA-eGFP |
This work |
| pHT01-floT-eGFP |
floT-eGFP |
This work |
| pHT01-menH-eGFP |
menH-eGFP |
This work |
| pHT01-menA-eGFP |
menA-eGFP |
This work |
| pHT01-menB-eGFP |
menB-eGFP |
This work |
| pHT01-ispA-eGFP |
ispA-eGFP |
This work |
| pHT01-fni-eGFP |
fni-eGFP |
This work |
| pHT01-yuxO-eGFP |
yuxO-eGFP |
This work |
| pHT01-hepS-eGFP |
hepS-eGFP |
This work |
| pHT01-hepT-eGFP |
hepT-eGFP |
This work |
1.2 主要试剂及培养基 LB (Luria Broth)培养基:10 g/L蛋白胨,10 g/L NaCl,5 g/L酵母粉,121 ℃灭菌20 min。LB固体培养基中添加2%的琼脂粉。
发酵培养基:50 g/L葡萄糖、50 g/L甘油、50 g/L大豆蛋白胨、0.06 g/L磷酸二氢钾,115 ℃灭菌20 min。
实验所用抗生素:卡那霉素50 µg/L、博来霉素20 µg/L、壮观霉素100 g/L、氯霉素30 µg/L。
1.3 仪器和设备 本研究中所使用的主要仪器:PCR扩增仪(伯乐有限公司)、核酸电泳仪(六一电泳仪厂)、超声波细胞破碎仪(伯乐有限公司)、分光光度计(赛默飞有限公司)、超速离心机(赛默飞有限公司)、激光共聚焦显微镜(徕卡显微系统公司)、荧光显微镜(尼康公司)、HPLC-1260 (安捷伦公司)、3 L迪必尔发酵罐(NBS有限公司)。
1.4 质粒和菌株构建 通过一步克隆法构建本研究所用质粒,所用引物如表 2所示。以pHT01-floA-eGFP质粒构建为例:以BS168的基因组作为模板,以FloA-1F和FloA-1R为引物扩增得到floA基因片段,以eGFP-1F和eGFP-1F为引物扩增得到eGFP基因片段;以pHT01质粒为模板,以Z-1F和Z-1R为引物扩增得到载体基因片段。参照一步克隆说明书中的质粒构建方法,获得质粒pHT01-floA-eGFP。
表 2 本研究中所用引物
Table 2 Primers used in this work
| Primer name |
Primer sequence (5′→3′) |
Size (bp) |
| Z-1F |
GGATGAACTATACAAATAATCTAGAGTCGACGTCCCCGG |
39 |
| Z-1R |
GTGTACATTTCACCTCCTTTAAATTACTTTCATTATGAGTT |
41 |
| eGFP-1F |
GGAAGCGGCGGTGGCGGCAGCATGGGTAAGGGAGAAGAACTTTTCACT |
48 |
| eGFP-1R |
GTCGACTCTAGATTATTTGTATAGTTCATCCATGCCATGTGTAATCC |
47 |
| FloA-1F |
TGAAATGTACACATGGATCCGTCAACACTTATGATTCTGG |
40 |
| FloA-1R |
TACCCATGCTGCCGCCACCGCCGCTTCCTGATTTGCGGTCTTCATCCGAAGG |
52 |
| FloA-1F |
AGGAGGTGAAATGTACACATGACAATGCCGATTATAATGATCATCGGA |
48 |
| FloA-1R |
GCCACCGCCGCTTCCTTACTCTGATTTTTGGATCGTTTTGGCTTCT |
46 |
| MenH-1F |
AGGAGGTGAAATGTACACATGCAGGACTCAAAAGAACAGCG |
41 |
| MenH-1R |
GCTGCCGCCACCGCCGCTTCCTTTCCATCCGATATGCGTGGCAG |
44 |
| MenA-1F |
GCCAGTGAATTCGAGCTCATCAAAAATTCCCTTCCCGTTTTTTCGA |
59 |
| MenA-1R |
TTACCCATGCTGCCGCCACCGCCGCTTCCTCGGAAATAGCTGATCAATAATCCGATCGA |
59 |
| MenB-1F |
AGGAGGTGAAATGTACACATGGCTGAATGGAAAACAAAACGGA |
43 |
| MenB-1R |
GCCGCTTCCCGGAAAACGAGGGAACTGTCC |
43 |
| IspA-1F |
AGGAGGTGAAATGTACACGTGACAAATAAATTAACGAGCTTTCTGGCG |
48 |
| IspA-1R |
ACCGCCGCTTCCGTGATCTCTTGCCGCAATTAAATCAC |
48 |
| Fni-1F |
AGGAGGTGAAATGTACACGTGACTCGAGCAGAACGAAAAAGAC |
43 |
| Fni-1R |
GCCGCTTCCTCGCACACTATAGCTTGATGTATTGACC |
37 |
| YuxO-1F |
GGAGGTGAAATGTACACATGGATATGAAGCACACATTGCTTGAAG |
45 |
| YuxO-1R |
GCTGCCGCCACCGCCGCTTCCTTTCTTGATGACAGCCAGCGTGC |
45 |
| HepS-1F |
GGAGGTGAAATGTACACTTGCAAGACATCTACGGAACTTTAGCC |
52 |
| HepS-1R |
CCATGCTGCCGCCACCGCCGCTTCCCCCTTCTTCCACTTTCTGATGATAGGT |
52 |
| HepT-1F |
AGGAGGTGAAATGTACACATGTTAAATATCATTCGTTTACTGGCGGAG |
48 |
| HepT-1R |
CCGCCGCTTCCAAATTTTCTTTTACCGATATATTTTGCGATGGCT |
48 |
| QC-yisP-U-1F |
TGATGCCTGATGCGAAAGTCTTTT |
53 |
| QC-yisP-U-1R |
ATCCGCTCAAAACACCCGGCCTTGATTGAG |
53 |
| QC-yisP-S-1F |
AGGCCGGGTGTTTTGAGCGGATAACAATTTCACACAGGAA |
53 |
| QC-yisP-S-1R |
AGACTTGAAGAAGCATAACGCCAGGGTTTTCCCAGTC |
53 |
| QC-yisP-D-1F |
GGAAAACCCTGGCGTTATGCTTCTTCAAGTCTAGTATGTTTTTTCCTAATTGT |
53 |
| QC-yisP-D-1R |
ACTGGACAGAAAACAATTAGATCAGCTTTTAGA |
53 |
| QC-FloA-U-1F |
CAGATCACATTTATATGGCGCCTGG |
58 |
| QC-FloA-U-1R |
GTGTGAAATTGTTATCCGCTCATAACTTCTCCTCGTTTCTATTTAAATTTCTCTCACG |
58 |
| QC-FloA-S-1F |
AGAAACGAGGAGAAGTTATGAGCGGATAACAATTTCACACAGGAA |
58 |
| QC-FloA-S-1R |
CTCCCTTCTTAGAGAGATAACGCCAGGGTTTTCCCAGT |
58 |
| QC-FloA-D-1F |
AAACCCTGGCGTTATCTCTCTAAGAAGGGAGAACGCTGATG |
58 |
| QC-FloA-D-1R |
ACATTTAAATTTACTTCTTACCCGCCGAA |
58 |
| QC-FloT-U-1F |
TTGGCTGCCTGAAATAAAATCATGCG |
58 |
| QC-FloT-U-1R |
CCTGTGTGAAATTGTTATCCGCTCATCAAATTCCTCCTTTTATGTTAAATGGGTTCAT |
58 |
| QC-FloT-C-1F |
AAAAGGAGGAATTTGATGAGCGGATAACAATTTCACACAGGAAAC |
58 |
| QC-FloT-C-1R |
GTTCTGCCCTTTCCTAACGCCAGGGTTTTCCCAGTC |
58 |
| QC-FloT-D-1F |
GAAAACCCTGGCGTTAGGAAAGGGCAGAACCGTATGG |
58 |
| QC-FloT-D-1R |
GGTGTCAAAGCAGGTCTTACTACAGG |
58 |
| QC-sqhC-U-1F |
GGATTTGTTTGACGAGCTGAAAAGC |
51 |
| QC-sqhC-U-1R |
GTGTGAAATTGTTATCCGCTCATGAAACGTGAATCTTATCAAGCGGAG |
51 |
| QC-sqhC-C-1F |
GCTTGATAAGATTCACGTTTCATGAGCGGATAACAATTTCACACAGGAAAC |
51 |
| QC-sqhC-C-1R |
GAGTTGAGCGTGTAACGCCAGGGTTTTCCCAGTCA |
51 |
| QC-sqhC-D-1F |
AAAACCCTGGCGTTACACGCTCAACTCCTTCAGAAGC |
51 |
| QC-sqhC-D-1R |
CCGCTTTCAGCTCTTTATTTGGCAG |
51 |
| U-1F |
AAACCGATTATTTTGAATGTAACGTATATACCAATGAA |
54 |
| U-1R |
GTGTGAAATTGTTATCCGCTCATGAATATCAATAAACAATCGCCTATTCCGATT |
54 |
| C-1F |
ATAGGCGATTGTTTATTGATATTCATGAGCGGATAACAATTTCACACAGGAAAC |
54 |
| C-1R |
GGTAAGAGAGGAATGTACACTAACGCCAGGGTTTTCCCAGTC |
54 |
| P43-1F |
GGAAAACCCTGGCGTTAGTGTACATTCCTCTCTTACCTATAATGGTACCG |
54 |
| P43-FloA-1R |
ATAAGTGTTGACGGATCCATTGATAGGTGGTATGTTTTCGCT |
54 |
| FloA-1F |
ACATACCACCTATCAATGGATCCGTCAACACTTATGATTCTG |
54 |
| FloA-1R |
TTGAAAGGAACATGCTGACTTTGATTTGCGGTCTTCATCCGAAGG |
54 |
| FloA-D-1F |
ACCGCAAATCAAAGTCAGCATGTTCCTTTCAAGGTCTTAAT |
54 |
| D-1R |
GTTCGATCCTCAAAATGAACGAAGGC |
54 |
| P43-SPFH-1R |
CGGCATTGTCATTGATAGGTGGTATGTTTTCGCTTGAACT |
45 |
| SPFH-1F |
ACATACCACCTATCAATGACAATGCCGATTATAATGATCATCGGA |
45 |
| SPFH-1R |
CATGCTGACTTTTTATCAGCCTCTGCTGTTGCGA |
45 |
| SPFH-D-1F |
CAGCAGAGGCTGATAAAAAGTCAGCATGTTCCTTTCAAGGTC |
45 |
| FLoA-2R |
GCTGCCGCCACCGCCGCTTCCTGATTTGCGGTCTTCATCCGAAGG |
58 |
| Fni-1F |
GACCGCAAATCAGGAAGCGGCGGTGGCGGCAGCGTGACTCGAGCAGAACGAAAAAGAC |
58 |
| Fni-1R |
CTTGAAAGGAACATGCTGACTTTTATCGCACACTATAGCTTGATGTATTGACC |
53 |
| Fni-D-1F |
GCTATAGTGTGCGATAAAAGTCAGCATGTTCCTTTCAAGGTCT |
58 |
| IspA-1F |
GCAAATCAGGAAGCGGCGGTGGCGGCAGCGTGACAAATAAATTAACGAGCTTTCTGGCG |
59 |
| IspA-1R |
AACATGCTGACTTTTAGTGATCTCTTGCCGCAATTAAATCACA |
59 |
| IspA-D-1F |
GCGGCAAGAGATCACTAAAAGTCAGCATGTTCCTTTCAAGGTC |
59 |
| HepT-1F |
CGCAAATCAGGAAGCGGCGGTGGCGGCAGCATGTTAAATATCATTCGTTTACTGGCGGAG |
63 |
| HepT-1R |
AGACCTTGAAAGGAACATGCTGACTTTTAAAATTTTCTTTTACCGATATATTTTGCGATGGCT |
63 |
| HepT-D-1F |
CGGTAAAAGAAAATTTTAAAAGTCAGCATGTTCCTTTCAAGGTCTTAATGACGCGGCT |
63 |
| YuxO-1F |
CCGCAAATCAGGAAGCGGCGGTGGCGGCAGCATGGATATGAAGCACACATTGCTTGAAG |
59 |
| YuxO-1R |
AAGGAACATGCTGACTTTTATTTCTTGATGACAGCCAGCGTG |
59 |
| YuxO-D-1F |
CATCAAGAAATAAAAGTCAGCATGTTCCTTTCAAGGTC |
59 |
| P43-Fni-1R |
CTGCTCGAGTCACTGATAGGTGGTATGTTTTCGCTTGAACTTT |
43 |
| Fni-2F |
ACATACCACCTATCAGTGACTCGAGCAGAACGAAAAAGAC |
43 |
| P43-IspA-1F |
GCCAGAAAGCTCGTTAATTTATTTGTCACTGATAGGTGGTATGTTTTCGCTTGAACTTTTAAAT |
64 |
| IspA-2F |
ACATACCACCTATCAGTGACAAATAAATTAACGAGCTTTCTGGC |
64 |
| P43-HepT-1R |
CGCCAGTAAACGAATGATATTTAACATTGATAGGTGGTATGTTTTCGCTTGAACT |
60 |
| HepT-2F |
ACATACCACCTATCAATGTTAAATATCATTCGTTTACTGGCGGA |
60 |
| P43-YuxO-1R |
TGTGTGCTTCATATCCATTGATAGGTGGTATGTTTTCGCTTGAACT |
59 |
| YuxO-2F |
ACATACCACCTATCAATGGATATGAAGCACACATTGCTTGA |
59 |
| The underlined sequences are the linker used in the experiment, and the linker used is the flexible linker. |
通过Cre/loxP系统构建本研究所用重组枯草芽孢杆菌,所用引物如表 2所示。以重组工程菌BS3FA的构建为例:以BS168的基因组作为模板,以U-1F和U-1R为引物扩增得到上游同源臂基因片段,以FloA-1F和FloA-1R为引物扩增得到floA基因片段,以D-1F和D-1R为引物扩增得到下游同源臂基因片段;以pP43NMK质粒为模板,以P43-1F和P43-1R为引物扩增得到P43启动子基因片段;以P7C6质粒为模板,以C-1F和C-1R引物对扩增得到lox71-zeo-lox66基因片段。通过重叠延伸PCR融合表达5个片段。通过化学转化的方法将构建好的表达框转入BS3中,通过菌落PCR验证获得重组工程菌BS3FA。
1.5 摇瓶发酵 取保藏在甘油管中的重组枯草芽孢杆菌接种至LB固体培养基上进行活化,挑取单菌落接种至2 mL LB液体培养基中,在37 ℃、220 r/min培养条件下振荡培养8 h;取1 mL种子液接种至20 mL发酵培养基中于40 ℃、220 r/min振荡培养6 d。每24 h取样500 µL监测细胞生长情况,以及MK-7含量的检测。每组样品3个平行。
1.6 细胞组分的分离和提取 发酵样品:按照上述摇瓶发酵方法,取发酵2 d后的发酵液15 mL用于细胞组分分离。
细胞外:将发酵样品在5 000 r/min离心10 min,分为“上清1”和“沉淀1”。“上清1”用作检测胞外MK-7含量。
全细胞:“沉淀1”用无菌水洗涤3次并用无菌水重悬后,用作检测全细胞MK-7产量。
细胞内:重悬后的“沉淀1”通过超声波细胞破碎仪进行破碎,在10 000 r/min离心40 min,分为“上清2”和“沉淀2”;“上清2”通过超速离心机在140 000 r/min下离心1 h,分为“上清3”和“沉淀3”,“上清3”用作检测细胞内MK-7含量。
细胞膜:“沉淀3”用无菌水重悬后,用作检测细胞膜上MK-7含量。
1.7 荧光显微镜观察 eGFP样品制备:取保藏在甘油管中的重组枯草芽孢杆菌接种到LB固体培养基上进行活化,挑取单菌落接种到2 mL LB液体培养基中在37 ℃、220 r/min培养条件下振荡培养10 h;5 000 r/min、10 min离心收集菌体,用LB液体培养基清洗3遍,得到荧光观察样品。
罗丹明123样品制备:在发酵36 h后的摇瓶发酵液中加入20 µL的2 mmol/L罗丹明123母液,继续孵育1 h;5 000 r/min、10 min离心收集菌体,用LB液体培养基清洗3遍,得到荧光观察样品。
Di-4-ANEPPDHQ样品制备[23]:取保藏在甘油管中的重组枯草芽孢杆菌接种到LB固体培养基上进行活化,挑取单菌落接种到2 mL LB液体培养基中在37 ℃、220 r/min培养条件下振荡培养10 h;5 000 r/min、10 min离心收集菌体,弃上清,添加1 mL LB培养基(含有5 µmol/L di-4-ANNEPPDHQ),于冰上孵育10 min,离心弃上清,用预冷的LB培养基洗涤3次。
eGFP和罗丹明123荧光观察:通过使用尼康显微镜C-HGF (100×油镜)观察eGFP和罗丹明123,使用FITC滤光片,通过ImageJ软件进行图像处理和分析。
Di-4-ANEPPDHQ荧光观察:使用激光共聚焦显微镜Leica TCS SP8显微镜(60×油镜),样品采用488 nm的激发光波长,500−580 nm (有序相)和620−750 nm (无序相)的发射光波长,显微镜设置(偏移值,PMT电压和激光功率)均相同。通过均一化极性数值(generalized polarization value, GP value)来表示定量分析,GP图像根据Owen等[24]提供的ImageJ自定义宏生成。计算公式如下:
其中,I500−580和I620−750分别代表500−580 nm和620−750 nm通道中每个像素的荧光强度。Gcor为校准因子,计算公式如下:
GPexp是二甲基亚砜(dimethyl sulfoxide, DMSO)溶液在相同显微镜设置下中di-4-ANEPPDHQ的GP值,GPthe则是染料在DMSO中的参考值,一般认为GPthe=–0.85。处理后的荧光图像中每个像素强度乘GP值,则可以生成色相饱和度亮度的伪彩色GP图像。
1.8 MK-7的萃取和检测 MK-7萃取:按照异丙醇和正己烷1:2 (体积比)的比例配制萃取液。将待测样品和萃取液按照1:4 (体积比)的比例混匀离心后,上层有机相检测MK-7含量。
MK-7检测:检测仪器为配备有紫外检测器的高性能液相色谱(high performance liquid chromatography, HPLC),色谱柱为C18-ODS色谱柱(5 µm, 250 mm×4.6 mm),流动相为90%的甲醇和10%的二氯甲烷(色谱级)。进样量为10 µL,流速为1 mL/min,柱温40 ℃,检测波长254 nm。MK-7校准曲线在1 mg/L至100 mg/L之间呈线性(R2=0.998)。
1.9 3 L发酵罐发酵 3 L发酵罐所用培养基:50 g/L葡萄糖、50 g/L甘油、50 g/L大豆蛋白胨、0.06 g/L磷酸二氢钾,115 ℃灭菌20 min。
取保藏在甘油管中的重组枯草芽孢杆菌接种到LB固体培养基上进行活化,挑取一个单菌落接种到50 mL LB液体培养基中在37 ℃、220 r/min培养条件下振荡培养10 h;将种子液按照4% (体积分数)的接种量接种到含有1.5 L发酵培养基的3 L发酵罐中,培养6 d。
发酵罐条件设置:通气量为1.5 vvm,发酵温度为40 ℃,pH通过50% (体积分数)的氨水维持在7左右,搅拌转速根据溶氧进行调节,溶氧维持在50%,转速在400−600 r/min。
2 结果与分析
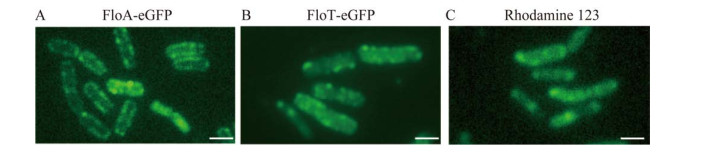
2.1 FMMs和MK-7的相关性分析 为了明确FMMs与MK-7之间是否具有相关性,该研究对两者的亚细胞定位进行了分析。有研究指出,脚手架蛋白FloA和FloT构成FMMs的骨架结构,可以作为FMMs的标志蛋白[25]。首先,分别将脚手架蛋白FloA和FloT与eGFP进行融合表达,进行荧光显微镜观察。结果显示,FloA-eGFP和FloT-eGFP主要以不连续的点状结构分布于细胞膜上(图 2A、2B)。进一步使用MK-7的特异性染料罗丹明123染料对课题组前期构建的一株高产MK-7菌株BS3进行染色[26]。结果显示,MK-7也以不均匀的点状结构分布在细胞膜上(图 2C),推测FMMs和MK-7存在相关性。
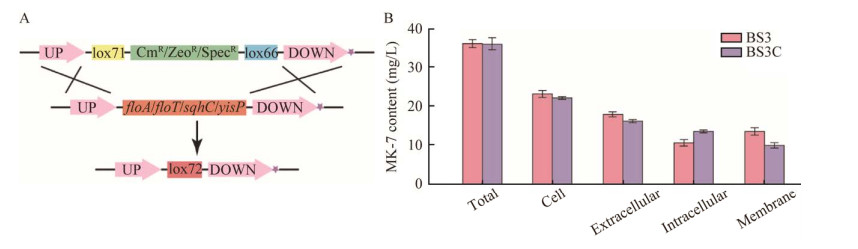
除脚手架蛋白外,聚异戊二烯化合物也参与维持FMMs的完整性。聚异戊二烯化合物的合成需要YisP[27](合成C30萜类化合物)和SqhC[28](聚异戊二烯环化酶)的参与。因此,为了探讨FMMs的完整性对MK-7合成的影响,该研究在BS3菌株中通过Cre/loxP基因编辑方法敲除了基因floA、floT、sqhC和yisP,获得菌株BS3C,检测BS3和BS3C菌株中不同组分的MK-7含量。结果发现,FMMs的完整性被破坏后,MK-7的总产量基本不变。其中,BS3C细胞内MK-7的含量增加了26.8%,细胞膜上MK-7的含量降低了24.8% (图 3B)。这表明在破坏FMMs的完整性后,细胞膜和细胞内MK-7的含量发生明显变化。推测可能原因是FMMs的完整性被破坏后,会影响MK-7进入细胞膜的过程,进而使MK-7在细胞内积累。
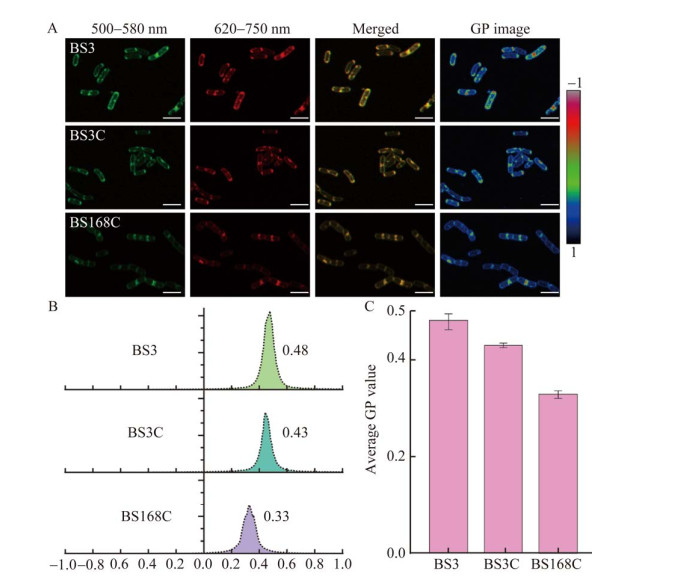
FMMs是一类高度有序的膜结构域,可以通过膜有序度来表征细胞膜上FMMs的变化情况[23]。为了明确FMMs的完整性和MK-7对细胞膜有序度的影响,同样在BS168菌株中通过敲除基因floA、floT、sqhC和yisP,获得菌株BS168C,使用di-4-ANEPPDHQ[29]染料对BS3、BS3C和BS168C进行染色,通过激光共聚焦显微镜采集双通道图像(500−580 nm和620−750 nm),并通过ImageJ进行GP值分析和图像转化。GP值可指示膜有序度,GP值越高,膜有序度越高。对获得的直方图进行拟合,获得膜有序度定量分析结果。结果发现,BS3的GP峰值为0.48,平均GP值为0.47±0.01;BS3C的GP峰值为0.43,平均GP值为0.43±0.01;BS168C的GP峰值为0.33,平均GP值为0.32±0.01 (图 4A–4C)。其中,BS3的膜有序度高于BS3C,表明FMMs完整性被破坏后影响了MK-7进入细胞膜的过程,导致了BS3C细胞膜上MK-7含量降低。BS3C的膜有序度明显高于BS168C,表明MK-7可以有效提高细胞膜有序度。上述结果表明MK-7是FMMs中的一类重要的聚异戊二烯类化合物。
2.2 MK-7合成途径关键酶的区室化
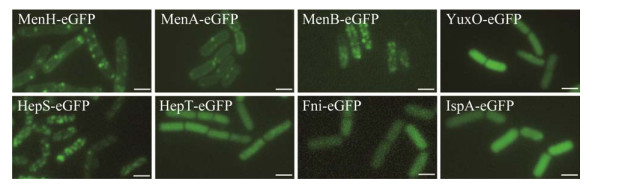
2.2.1 MK-7合成途径关键酶的亚细胞定位 为了探究MK-7如何定位至细胞膜甚至FMMs中,该研究选择8个MK-7合成的关键酶:MenH、MenA、MenB、YuxO、HepS、HepT、Fni、IspA,拟对它们的亚细胞定位情况进行分析。其中,Fni、IspA、HepS和HepT参与MK-7侧链合成;MenB和YuxO参与MK-7骨架结构合成;MenA将侧链HDP整合到骨架DHNA中形成DMK,最后通过MenH甲基化形成MK-7。
分别将上述8个关键酶与eGFP融合表达,进行荧光显微镜观察。结果显示,MenH-eGFP、HepS-eGFP和MenB-eGFP均以不连续的点状结构分布在细胞膜上,和FMMs标记蛋白的亚细胞定位极为类似,推测MenH、HepS和MenB主要定位于FMMs中;MenA-eGFP蛋白则是典型的细胞膜定位蛋白;YuxO-eGFP、Fni-eGFP、HepT-eGFP和IspA-eGFP均匀地分布在细胞质中(图 5)。由上述结果可知,负责骨架结构和侧链合成的关键酶在细胞中存在一定的空间距离,可能会降低代谢反应速率,进而影响MK-7的合成。
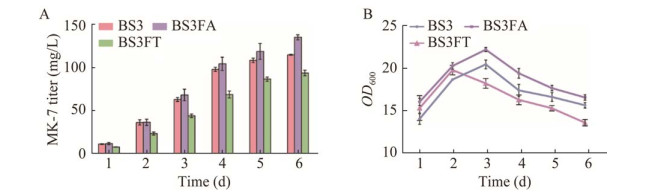
2.2.2 通过FMMs实现MK-7合成途径关键酶的区室化 鉴于FMMs和MK-7的相关性,本研究尝试使用FMMs来进行MK-7合成途径关键酶的区室化。首先以BS3为出发菌株,分别构建过表达FloA、FloT的重组菌株BS3FA和BS3FT,验证过表达不同脚手架蛋白对MK-7产量的影响。结果发现,BS3FA的MK-7产量达到135.3 mg/L,与BS3相比提高了17.8% (图 6A),同时过表达FloA对细胞生长也有一定的促进作用。BS3FT的产量为94.3 mg/L,与BS3相比降低了18.0%,且2 d后,与其他菌株相比,OD600明显减小(图 6B),这可能是BS3FT菌株MK-7产量降低的主要原因。因此,选择FloA蛋白进行后续研究。
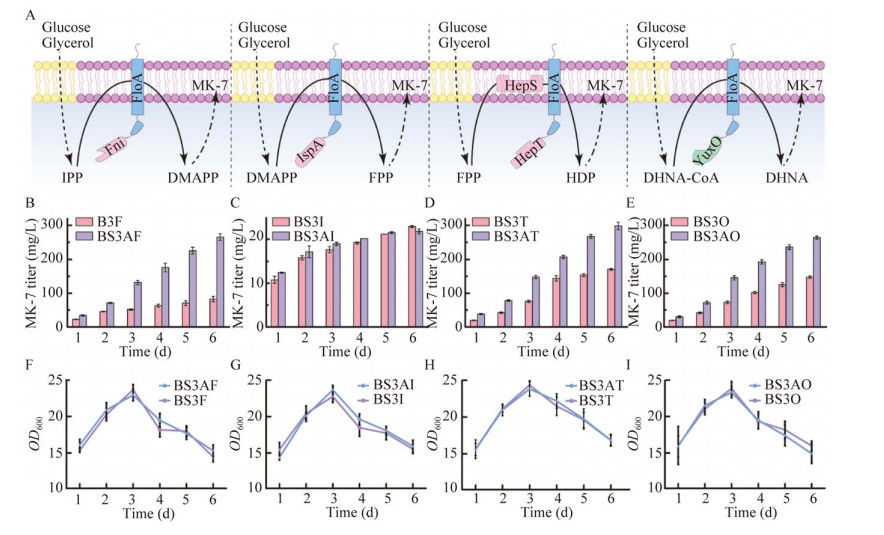
接下来尝试通过使用FloA蛋白将MK-7合成途径关键酶锚定在FMMs中,以实现MK-7合成途径关键酶的区室化(图 7A)。以B3S为出发菌株,构建得到融合表达FloA-Fni、FloA-IspA、FloA-HepT和FloA-YuxO的重组菌株BS3AF、BS3AI、BS3AT和BS3AO。分别以过表达Fni、IspA、HepT和YuxO的重组菌株BS3F、BS3I、BS3T和BS3O作为对照,验证MK-7合成途径关键酶区室化对MK-7产量的影响。结果发现,除过表达IspA外,重组工程菌的产量与对照相比都得到了明显提高(图 7B–7I)。其中,BS3AT的MK-7产量最高,达到了300.3 mg/L,较对照菌株提高了73.4%。
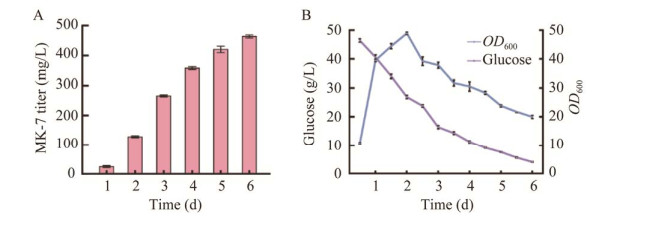
2.3 3 L发酵罐产量验证 重组菌株BS3AT通过分批培养的方式在3 L中发酵罐中进行进一步的发酵验证。初始葡萄糖浓度为50 g/L,通过50%氨水维持pH在7左右。OD600在2 d后达到峰值,随着发酵时间的延长,MK-7的增长速率随着细胞裂解而减缓,MK-7产量在发酵6 d后达到了464.2 mg/L (图 8)。在3 L发酵罐和摇瓶中MK-7产量的变化整体趋势一致。该结论进一步证明了通过FMMs实现MK-7合成途径关键酶区室化的有效性。
3 讨论 MK-7作为脂溶性维生素K2的重要亚型,在功能食品等领域有着广泛应用。因此,通过微生物发酵法实现MK-7的高效合成有着重要意义。在模式微生物枯草芽孢杆菌中,许多研究者通过增强前体供应、阻断副产物合成等方法对MK-7的代谢途径进行优化,期望实现MK-7的高效合成[30-31]。相比于其他改造策略,区室化可以使目标代谢通路的酶集中于一个区域,缩短途径酶之间的空间距离,加快代谢反应速率,进而实现目标产物的高效合成[32-34]。因此,通过细胞膜上特殊的结构域FMMs实现枯草芽孢杆菌中MK-7合成途径的区室化可以为MK-7的代谢改造提供一种新的思路。
本研究首先探讨了MK-7和FMMs的相关性。通过可视化分析发现,MK-7和FMMs均以不连续的点状结构分布于细胞膜上,初步推测二者存在相关性。其次FMMs的完整性被破坏导致了细胞膜上MK-7含量和膜有序度的下降。但是在FMMs的完整性被破坏后,MK-7仍可以有效提高膜有序度,证明MK-7是FMMs聚异戊二烯类的关键组分。在此基础上,尝试通过FMMs来实现MK-7的高效合成。
在MK-7合成过程中,关键酶MenH、HepS和MenB定位于FMMs中,Fni、IspA、HepT和YuxO游离在细胞质中,MenA则是典型的细胞膜定位。MK-7合成相关的关键酶在细胞中的空间位置相对较远,这可能会导致MK-7的合成效率较低。因此,接下来通过FloA蛋白分别融合表达关键酶Fni、IspA、HepT和YuxO,使得关键酶定位在FMMs中,缩短关键酶之间的空间距离,实现MK-7合成途径相关关键酶的区室化。通过FloA蛋白将MK-7合成途径关键酶HepT锚定到FMMs后,成功获得一株高产MK-7菌株BS3AT,在摇瓶水平MK-7产量达到300.3 mg/L,相比于对照菌株提高了73.4%,在3 L生物反应器中的产量为464.2 mg/L。
综上所述,基于FMMs的MK-7合成途径关键酶区室化,有效提高了MK-7的产量,为构建高效合成MK-7的微生物细胞工厂提供了新思路。
 2023, Vol. 39
2023, Vol. 39