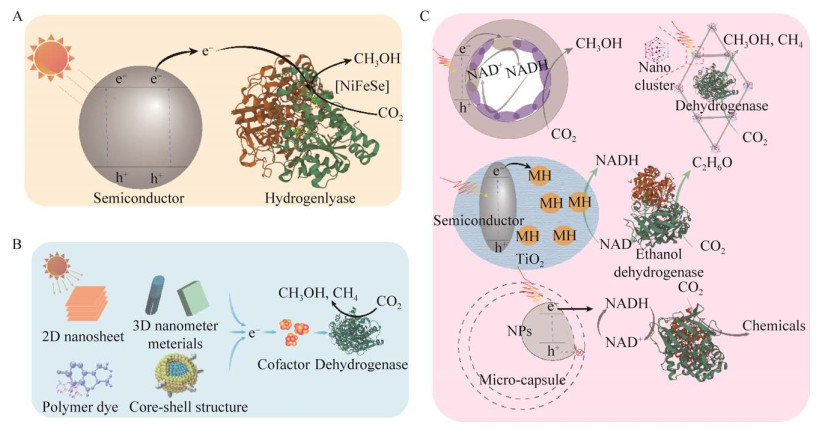
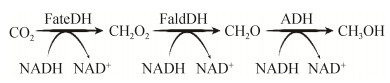
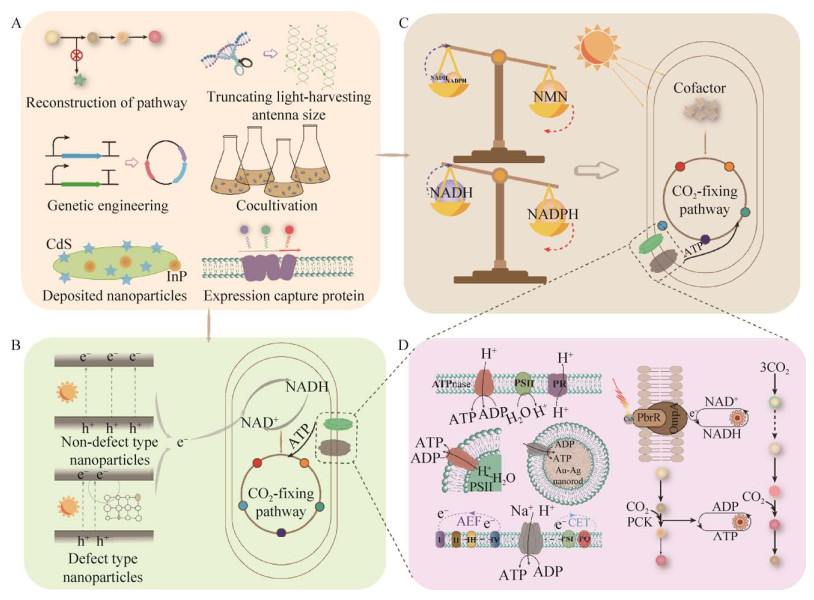
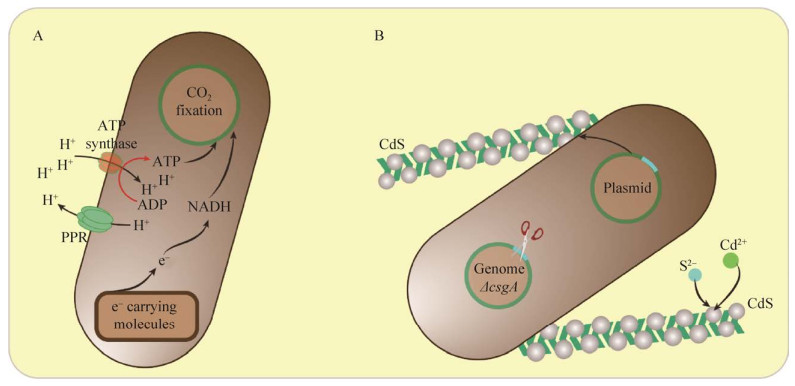
| [1] |
胡小夫, 王凯亮, 沈建永, 白永锋. 基于生物固碳技术的CO 2资源化利用研究进展. 华电技术, 2021, 43(6): 79-85. HU XF, WANG KL, SHEN JY, BAI YF. Research progress of CO 2 resource utilization based on biological carbon sequestration technology. Huadian Technology, 2021, 43(6): 79-85 (in Chinese). DOI:10.3969/j.issn.1674-1951.2021.06.010
|
|
| [2] |
李春雷. CO 2捕集及其转化技术现状与煤化工产业碳减排路径探索. 中国煤炭, 2022, 48(8): 24-32. LI CL. Research on the current status of CO 2 capture and conversion technology and the path exploration of carbon emission reduction in the coal chemical industry. China Coal, 2022, 48(8): 24-32 (in Chinese).
|
|
| [3] |
PODROJKOVÁ N, SANS V, ORIŇAK A, ORIŇAKOVÁ R. Recent developments in the modelling of heterogeneous catalysts for CO 2 conversion to chemicals. ChemCatChem, 2020, 12(7): 1802-1825. DOI:10.1002/cctc.201901879
|
|
| [4] |
LAN BY, SHI HF. Review of systems for photocatalytic conversion of CO 2 to hydrocarbon fuels. Acta Physico-Chimica Sinica, 2014, 30(12): 2177-2196. DOI:10.3866/PKU.WHXB201409303
|
|
| [5] |
LIU XF, MIAO R, LINDBERG P, LINDBLAD P. Modular engineering for efficient photosynthetic biosynthesis of 1-butanol from CO2 in cyanobacteria. Energy & Environmental Science, 2019, 12(9): 2765-2777.
|
|
| [6] |
SAKIMOTO KK, WONG AB, YANG PD. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production. Science, 2016, 351(6268): 74-77. DOI:10.1126/science.aad3317
|
|
| [7] |
HU GP, LI ZH, MA DL, YE C, ZHANG LP, GAO C, LIU LM, CHEN XL. Light-driven CO 2 sequestration in Escherichia coli to achieve theoretical yield of chemicals. Nature Catalysis, 2021, 4(5): 395-406. DOI:10.1038/s41929-021-00606-0
|
|
| [8] |
王雪云, 杨文君, 钟超, 高翔. 材料-生物杂化体的光驱生物催化. 合成生物学, 2022, 3(1): 98-115. WANG XY, YANG WJ, ZHONG C, GAO X. Biohybrid materials for light-driven biocatalysis. Synthetic Biology Journal, 2022, 3(1): 98-115 (in Chinese).
|
|
| [9] |
张劢, 田瑶, 郭之旗, 王叶, 窦广进, 宋浩. 光催化-生物杂合系统设计优化用于燃料和化学品绿色合成. 化工学报, 2022, 73(7): 2774-2789. ZHANG M, TIAN Y, GUO ZQ, WANG Y, DOU GJ, SONG H. Design and optimization of photocatalysisbiological hybrid system for green synthesis of fuels and chemicals. CIESC Journal, 2022, 73(7): 2774-2789 (in Chinese).
|
|
| [10] |
YANG N, TIAN Y, ZHANG M, PENG XT, LI F, LI JX, LI Y, FAN B, WANG FZ, SONG H. Photocatalyst- enzyme hybrid systems for light-driven biotransformation. Biotechnology Advances, 2022, 54: 107808. DOI:10.1016/j.biotechadv.2021.107808
|
|
| [11] |
ZHANG LY, CAN M, RAGSDALE SW, ARMSTRONG FA. Fast and selective photoreduction of CO 2 to CO catalyzed by a complex of carbon monoxide dehydrogenase, TiO 2, and Ag nanoclusters. ACS Catalysis, 2018, 8(4): 2789-2795. DOI:10.1021/acscatal.7b04308
|
|
| [12] |
CHAUDHARY YS, WOOLERTON TW, ALLEN CS, WARNER JH, PIERCE E, RAGSDALE SW, ARMSTRONG FA. Visible light-driven CO 2 reduction by enzyme coupled CdS nanocrystals. Chem Commun, 2012, 48(1): 58-60. DOI:10.1039/C1CC16107E
|
|
| [13] |
KUK SK, HAM Y, GOPINATH K, BOONMONGKOLRAS P, LEE Y, LEE YW, KONDAVEETI S, AHN C, SHIN B, LEE JK, JEON S, PARK CB. Continuous 3D titanium nitride nanoshell structure for solar-driven unbiased biocatalytic CO 2 reduction. Advanced Energy Materials, 2019, 9(25): 1900029. DOI:10.1002/aenm.201900029
|
|
| [14] |
SOKOL KP, ROBINSON WE, OLIVEIRA AR, WARNAN J, NOWACZYK MM, RUFF A, PEREIRA IAC, REISNER E. Photoreduction of CO 2 with a formate dehydrogenase driven by photosystem Ⅱ using a semi-artificial Z-scheme architecture. Journal of the American Chemical Society, 2018, 140(48): 16418-16422. DOI:10.1021/jacs.8b10247
|
|
| [15] |
YUAN MW, SAHIN S, CAI R, ABDELLAOUI S, HICKEY DP, MINTEER SD, MILTON RD. Creating a low-potential redox polymer for efficient electroenzymatic CO 2 reduction. Angewandte Chemie International Edition, 2018, 57(22): 6582-6586. DOI:10.1002/anie.201803397
|
|
| [16] |
BADIANI VM, CASADEVALL C, MILLER M, COBB SJ, MANUEL RR, PEREIRA IAC, REISNER E. Engineering electro- and photocatalytic carbon materials for CO 2 reduction by formate dehydrogenase. Journal of the American Chemical Society, 2022, 144(31): 14207-14216. DOI:10.1021/jacs.2c04529
|
|
| [17] |
JI XY, LIU CC, WANG J, SU ZG, MA GH, ZHANG SP. Integration of functionalized two-dimensional TaS 2 nanosheets and an electron mediator for more efficient biocatalyzed artificial photosynthesis. Journal of Materials Chemistry A, 2017, 5(11): 5511-5522. DOI:10.1039/C7TA00002B
|
|
| [18] |
GUO MY, GU FJ, MENG LD, LIAO QY, MENG ZH, LIU WF. Synthesis of formaldehyde from CO 2 catalyzed by the coupled photo-enzyme system. Separation and Purification Technology, 2022, 286: 120480. DOI:10.1016/j.seppur.2022.120480
|
|
| [19] |
WU YZ, SHI JF, LI DL, ZHANG SH, GU B, QIU Q, SUN YY, ZHANG YS, CAI ZY, JIANG ZY. Synergy of electron transfer and electron utilization via metal-organic frameworks as an electron buffer tank for nicotinamide regeneration. ACS Catalysis, 2020, 10(5): 2894-2905. DOI:10.1021/acscatal.9b05240
|
|
| [20] |
JI XY, WANG J, MEI L, TAO W, BARRETT A, SU ZG, WANG SM, MA GH, SHI JJ, ZHANG SP. Artificial photosynthesis: porphyrin/SiO 2/Cp*Rh(bpy)Cl hybrid nanoparticles mimicking chloroplast with enhanced electronic energy transfer for biocatalyzed artificial photosynthesis (adv. funct. mater. 9/2018). Advanced Functional Materials, 2018, 28(9): 1870061. DOI:10.1002/adfm.201870061
|
|
| [21] |
CHEN YJ, LI P, ZHOU JW, BURU CT, ĐORĐEVIĆ L, LI PH, ZHANG X, CETIN MM, STODDART JF, STUPP SI, WASIELEWSKI MR, FARHA OK. Integration of enzymes and photosensitizers in a hierarchical mesoporous metal-organic framework for light-driven CO 2 reduction. Journal of the American Chemical Society, 2020, 142(4): 1768-1773. DOI:10.1021/jacs.9b12828
|
|
| [22] |
ZHOU JH, YU SS, KANG HL, HE R, NING YX, YU YY, WANG M, CHEN BQ. Construction of multi-enzyme cascade biomimetic carbon sequestration system based on photocatalytic coenzyme NADH regeneration. Renewable Energy, 2020, 156: 107-116. DOI:10.1016/j.renene.2020.04.022
|
|
| [23] |
ZHANG SH, ZHANG YS, CHEN Y, YANG D, LI SH, WU YZ, SUN YY, CHENG YQ, SHI JF, JIANG ZY. Metal hydride-embedded titania coating to coordinate electron transfer and enzyme protection in photo-enzymatic catalysis. ACS Catalysis, 2021, 11(1): 476-483. DOI:10.1021/acscatal.0c04462
|
|
| [24] |
JI XY, SU ZG, WANG P, MA GH, ZHANG SP. Tethering of nicotinamide adenine dinucleotide inside hollow nanofibers for high-yield synthesis of methanol from carbon dioxide catalyzed by coencapsulated multienzymes. ACS Nano, 2015, 9(4): 4600-4610. DOI:10.1021/acsnano.5b01278
|
|
| [25] |
ZHANG WY, BUREK BO, FERNÁNDEZ-FUEYO E, ALCALDE M, BLOH JZ, HOLLMANN F. Selective activation of C–H bonds in a cascade process combining photochemistry and biocatalysis. Angewandte Chemie International Edition, 2017, 56(48): 15451-15455. DOI:10.1002/anie.201708668
|
|
| [26] |
ZHANG LY, MORELLO G, CARR SB, ARMSTRONG FA. Aerobic photocatalytic H 2 production by a [NiFe] hydrogenase engineered to place a silver nanocluster in the electron relay. Journal of the American Chemical Society, 2020, 142(29): 12699-12707. DOI:10.1021/jacs.0c04302
|
|
| [27] |
TIAN Y, ZHOU YN, ZONG YC, LI JS, YANG N, ZHANG M, GUO ZQ, SONG H. Construction of functionally compartmental inorganic photocatalyst- enzyme system via imitating chloroplast for efficient photoreduction of CO2 to formic acid. ACS Applied Materials & Interfaces, 2020, 12(31): 34795-34805.
|
|
| [28] |
MILLER TE, BENEYTON T, SCHWANDER T, DIEHL C, GIRAULT M, McLEAN R, CHOTEL T, CLAUS P, CORTINA NS, BARET JC, ERB TJ. Light-powered CO 2 fixation in a chloroplast mimic with natural and synthetic parts. Science, 2020, 368(6491): 649-654. DOI:10.1126/science.aaz6802
|
|
| [29] |
MENG X, LIU LM, CHEN XL. Bacterial photosynthesis: state-of-the-art in light-driven carbon fixation in engineered bacteria. Current Opinion in Microbiology, 2022, 69: 102174. DOI:10.1016/j.mib.2022.102174
|
|
| [30] |
崔金玉, 张爱娣, 栾国栋, 吕雪峰. 微藻光驱固碳合成技术的发展现状与未来展望. 合成生物学, 2022, 3(5): 884-900. CUI JY, ZHANG AD, LUAN GD, LYU XF. Engineering microalgae for photosynthetic biosynthesis: progress and prospect. Synthetic Biology Journal, 2022, 3(5): 884-900 (in Chinese).
|
|
| [31] |
EY JW, DICKMAN MJ, HUNTER CN, CANNIFFE DP. Biosynthesis of chlorophyll a in a purple bacterial phototroph and assembly into a plant chlorophyll- protein complex. ACS Synthetic Biology, 2016, 5(9): 948-954. DOI:10.1021/acssynbio.6b00069
|
|
| [32] |
KIRST H, FORMIGHIERI C, MELIS A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2014, 1837(10): 1653-1664.
|
|
| [33] |
CARRIERI D, JURISTA T, YAZVENKO N, SCHAFER MEDINA A, STRICKLAND D, ROBERTS JM. Overexpression of NblA decreases phycobilisome content and enhances photosynthetic growth of the cyanobacterium Synechococcus elongatus PCC 7942. Algal Research, 2021, 60: 102510. DOI:10.1016/j.algal.2021.102510
|
|
| [34] |
CLAASSENS NJ, VOLPERS M, dos SANTOS VAPM, van der OOST J, de VOS WM. Potential of proton-pumping rhodopsins: engineering photosystems into microorganisms. Trends in Biotechnology, 2013, 31(11): 633-642. DOI:10.1016/j.tibtech.2013.08.006
|
|
| [35] |
TOYA Y, HIRONO-HARA Y, HIRAYAMA H, KAMATA K, TANAKA R, SANO M, KITAMURA S, OTSUKA K, ABE-YOSHIZUMI R, TSUNODA SP, KIKUKAWA H, KANDORI H, SHIMIZU H, MATSUDA F, ISHII J, HARA KY. Optogenetic reprogramming of carbon metabolism using light-powering microbial proton pump systems. Metabolic Engineering, 2022, 72: 227-236. DOI:10.1016/j.ymben.2022.03.012
|
|
| [36] |
CHEN GE, CANNIFFE DP, BARNETT SFH, HOLLINGSHEAD S, BRINDLEY AA, VASILEV C, BRYANT DA, HUNTER CN. Complete enzyme set for chlorophyll biosynthesis in Escherichia coli. Science Advances, 2018, 4(1): eaaq1407. DOI:10.1126/sciadv.aaq1407
|
|
| [37] |
WANG B, JIANG ZF, YU JC, WANG JF, WONG PK. Enhanced CO 2 reduction and valuable C 2+ chemical production by a CdS-photosynthetic hybrid system. Nanoscale, 2019, 11(19): 9296-9301. DOI:10.1039/C9NR02896J
|
|
| [38] |
BROWN KA, HARRIS DF, WILKER MB, RASMUSSEN A, KHADKA N, HAMBY H, KEABLE S, DUKOVIC G, PETERS JW, SEEFELDT LC, KING PW. Light-driven dinitrogen reduction catalyzed by a CdS: nitrogenase MoFe protein biohybrid. Science, 2016, 352(6284): 448-450. DOI:10.1126/science.aaf2091
|
|
| [39] |
GUAN X, ERŞAN S, HU XC, ATALLAH TL, XIE YC, LU ST, CAO BC, SUN JW, WU K, HUANG Y, DUAN XF, CARAM JR, YU Y, PARK JO, LIU C. Maximizing light-driven CO 2 and N 2 fixation efficiency in quantum dot-bacteria hybrids. Nature Catalysis, 2022, 5(11): 1019-1029. DOI:10.1038/s41929-022-00867-3
|
|
| [40] |
ZHANG H, LIU H, TIAN ZQ, LU D, YU Y, CESTELLOS-BLANCO S, SAKIMOTO KK, YANG PD. Bacteria photosensitized by intracellular gold nanoclusters for solar fuel production. Nature Nanotechnology, 2018, 13(10): 900-905. DOI:10.1038/s41565-018-0267-z
|
|
| [41] |
WEI W, SUN PQ, LI Z, SONG KS, SU WY, WANG B, LIU YZ, ZHAO J. A surface-display biohybrid approach to light-driven hydrogen production in air. Science Advances, 2018, 4(2): eaap9253. DOI:10.1126/sciadv.aap9253
|
|
| [42] |
WANG XY, ZHANG JC, LI K, AN BL, WANG YY, ZHONG C. Photocatalyst-mineralized biofilms as living bio-abiotic interfaces for single enzyme to whole-cell photocatalytic applications. Science Advances, 2022, 8(18): eabm7665. DOI:10.1126/sciadv.abm7665
|
|
| [43] |
HUANG LY, LIU X, ZHANG ZS, YE J, RENSING C, ZHOU SG, NEALSON KH. Light-driven carbon dioxide reduction to methane by Methanosarcina barkeri in an electric syntrophic coculture. The ISME Journal, 2022, 16(2): 370-377. DOI:10.1038/s41396-021-01078-7
|
|
| [44] | |
|
| [45] |
LI C, TAO F, NI J, WANG Y, YAO F, XU P. Enhancing the light-driven production of d-lactate by engineering cyanobacterium using a combinational strategy. Scientific Reports, 2015, 5: 9777. DOI:10.1038/srep09777
|
|
| [46] |
BLACK WB, ZHANG LY, MAK WS, MAXEL S, CUI YT, KING E, FONG B, SANCHEZ MARTINEZ A, SIEGEL JB, LI H. Engineering a nicotinamide mononucleotide redox cofactor system for biocatalysis. Nature Chemical Biology, 2020, 16(1): 87-94. DOI:10.1038/s41589-019-0402-7
|
|
| [47] |
GUO JL, SUÁSTEGUI M, SAKIMOTO KK, MOODY VM, XIAO G, NOCERA DG, JOSHI NS. Light-driven fine chemical production in yeast biohybrids. Science, 2018, 362(6416): 813-816. DOI:10.1126/science.aat9777
|
|
| [48] |
WANG J, CHEN N, BIAN GK, MU X, DU N, WANG WJ, MA CG, FU S, HUANG BL, LIU TG, YANG YB, YUAN Q. Solar-driven overproduction of biofuels in microorganisms. Angewandte Chemie, 2022, 61(32): e202207132.
|
|
| [49] |
刘文清, 张涛. 细菌视紫红质在生物传感器中的应用进展. 材料导报, 2021, 35(23): 23171-23182. LIU WQ, ZHANG T. Progress in the application of bacteriorhodopsin in biosensors. Materials Reports, 2021, 35(23): 23171-23182 (in Chinese). DOI:10.11896/cldb.20070090
|
|
| [50] |
CHEN Q, van der STEEN JB, DEKKER HL, GANAPATHY S, de GRIP WJ, HELLINGWERF KJ. Expression of holo-proteorhodopsin in Synechocystis sp. PCC 6803. Metabolic Engineering, 2016, 35: 83-94. DOI:10.1016/j.ymben.2016.02.001
|
|
| [51] |
CLAASSENS NJ, SOUSA DZ, dos SANTOS VAPM, de VOS WM, van der OOST J. Harnessing the power of microbial autotrophy. Nature Reviews Microbiology, 2016, 14(11): 692-706. DOI:10.1038/nrmicro.2016.130
|
|
| [52] |
FENG XY, JIA Y, CAI P, FEIJB, LI JB. Coassembly of photosystem Ⅱ and ATPase as artificial chloroplast for light-driven ATP synthesis. ACS Nano, 2016, 10(1): 556-561. DOI:10.1021/acsnano.5b05579
|
|
| [53] |
LEE KY, PARK SJ, LEE KA, KIM SH, KIM H, MEROZ Y, MAHADEVAN L, JUNG KH, AHN TK, PARKER KK, SHIN K. Photosynthetic artificial organelles sustain and control ATP-dependent reactions in a protocellular system. Nature Biotechnology, 2018, 36(6): 530-535. DOI:10.1038/nbt.4140
|
|
| [54] |
LUAN GD, ZHANG SS, LU XF. Engineering cyanobacteria chassis cells toward more efficient photosynthesis. Current Opinion in Biotechnology, 2020, 62: 1-6. DOI:10.1016/j.copbio.2019.07.004
|
|
| [55] |
LI Y, FEI JB, LI GL, XIE HM, YANG Y, LI JL, XU YQ, SUN BB, XIA JR, FU XQ, LI JB. Supramolecular assembly of photosystem Ⅱ and adenosine triphosphate synthase in artificially designed honeycomb multilayers for photophosphorylation. ACS Nano, 2018, 12(2): 1455-1461. DOI:10.1021/acsnano.7b07841
|
|
| [56] |
ALSIYABI A, IMMETHUN CM, SAHA R. Modeling the interplay between photosynthesis, CO 2 fixation, and the quinone pool in a purple non-sulfur bacterium. Scientific Reports, 2019, 9: 12638. DOI:10.1038/s41598-019-49079-z
|
|
| [57] |
WOOD WHJ, MACGREGOR-CHATWIN C, BARNETT SFH, MAYNEORD GE, HUANG X, HOBBS JK, HUNTER CN, JOHNSON MP. Dynamic thylakoid stacking regulates the balance between linear and cyclic photosynthetic electron transfer. Nature Plants, 2018, 4(2): 116-127. DOI:10.1038/s41477-017-0092-7
|
|
| [58] |
MENG HK, ZHANG W, ZHU HW, YANG F, ZHANG YP, ZHOU J, LI Y. Over-expression of an electron transport protein OmcS provides sufficient NADH for d-lactate production in cyanobacterium. Biotechnology for Biofuels, 2021, 14(1): 1-16. DOI:10.1186/s13068-020-01854-1
|
|
| [59] |
CHEN ZW, de QUEIROS SILVEIRA G, MA XD, XIE YS, WU YA, BARRY E, RAJH T, FRY HC, LAIBLE PD, ROZHKOVA EA. Light-gated synthetic protocells for plasmon-enhanced chemiosmotic gradient generation and ATP synthesis. Angewandte Chemie International Edition, 2019, 58(15): 4896-4900. DOI:10.1002/anie.201813963
|
|
| [60] |
MONTAÑO LÓPEZ J, DURAN L, AVALOS JL. Physiological limitations and opportunities in microbial metabolic engineering. Nature Reviews Microbiology, 2022, 20(1): 35-48. DOI:10.1038/s41579-021-00600-0
|
|
| [61] |
ZHANG RT, HE Y, YI J, ZHANG LJ, SHEN CP, LIU SJ, LIU LF, LIU BH, QIAO L. Proteomic and metabolic elucidation of solar-powered biomanufacturing by bio-abiotic hybrid system. Chem, 2020, 6(1): 234-249. DOI:10.1016/j.chempr.2019.11.002
|
|
| [62] |
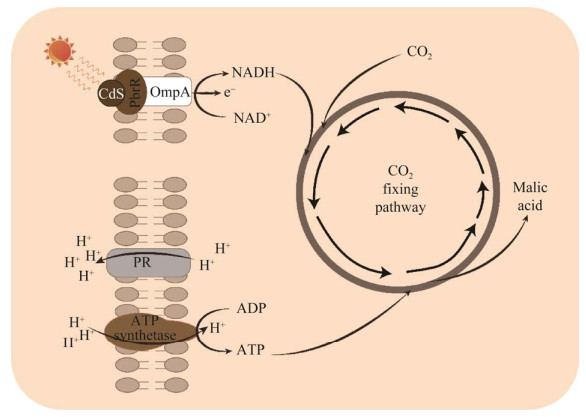
HU GP, ZHOU J, CHEN XL, QIAN YY, GAO C, GUO L, XU P, CHEN W, CHEN J, LI Y, LIU LM. Engineering synergetic CO 2-fixing pathways for malate production. Metabolic Engineering, 2018, 47: 496-504. DOI:10.1016/j.ymben.2018.05.007
|
|
| [63] |
FIXEN KR, ZHENG YN, HARRIS DF, SHAW S, YANG ZY, DEAN DR, SEEFELDT LC, HARWOOD CS. Light-driven carbon dioxide reduction to methane by nitrogenase in a photosynthetic bacterium. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(36): 10163-10167. DOI:10.1073/pnas.1611043113
|
|
| [64] |
郭禹曼, 洪学明, 樊彬, 吕永琴. 光催化-微生物耦合固碳研究进展. 生物加工过程, 2022, 20(2): 148-159. GUO YM, HONG XM, FAN B, LV YQ. Recent development of photocatalytic-biological hybrid systems for CO 2 assimilation. Chinese Journal of Bioprocess Engineering, 2022, 20(2): 148-159 (in Chinese). DOI:10.3969/j.issn.1672-3678.2022.02.004
|
|
| [65] |
李振华, 施润, 赵家琦, 张铁锐. 光驱动C1转换到高附加值化学品的研究进展. 高等学校化学学报, 2020, 41(4): 604-615. LI ZH, SHI R, ZHAO JQ, ZHANG TR. Research progress of photo-driven C1 conversion to value-added chemicals. Chemical Journal of Chinese Universities, 2020, 41(4): 604-615 (in Chinese).
|
|
| [66] |
CHEN ZW, ZHANG H, GUO PJ, ZHANG JJ, TIRA G, KIM YJ, WU YA, LIU YZ, WEN JG, RAJH T, NIKLAS J, POLUEKTOV OG, LAIBLE PD, ROZHKOVA EA. Semi-artificial photosynthetic CO 2 reduction through purple membrane re-engineering with semiconductor. Journal of the American Chemical Society, 2019, 141(30): 11811-11815. DOI:10.1021/jacs.9b05564
|
|
| [67] |
YE J, WANG C, GAO C, FU T, YANG CH, REN GP, LÜ J, ZHOU SG, XIONG YJ. Solar-driven methanogenesis with ultrahigh selectivity by turning down H 2 production at biotic-abiotic interface. Nature Communications, 2022, 13: 6612. DOI:10.1038/s41467-022-34423-1
|
|
| [68] |
YE J, CHEN YP, GAO C, WANG C, HU AD, DONG GW, CHEN Z, ZHOU SG, XIONG YJ. Sustainable conversion of microplastics to methane with ultrahigh selectivity by a biotic-abiotic hybrid photocatalytic system. Angewandte Chemie International Edition, 2022, 61(52): e202213244.
|
|
| [69] |
XIN JY, CUI JR, NIU JZ, HUA SF, XIA CG, LI SB, ZHU LM. Biosynthesis of methanol from CO2 and CH4 by methanotrophic bacteria. Biotechnology (Faisalabad), 2003, 3(1): 67-71.
|
|
| [70] |
TSOUNIS C, KURIKIR, SHIBATA K, VEQUIZO JJM, LU DL, YAMAKATA A, ISHITANI O, AMAL R, MAEDA K. Copolymerization approach to improving Ru(Ⅱ)-complex/C3N4 hybrid photocatalysts for visible-light CO2 reduction. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 15333-15340.
|
|
| [71] |
LIN G, ZHANG YY, HUA YT, ZHANG CH, JIA CC, JU DX, YU CM, LI P, LIU J. Bioinspired metalation of the metal-organic framework MIL-125-NH2 for photocatalytic NADH regeneration and gas-liquid- solid three-phase enzymatic CO2 reduction. Angewandte Chemie International Edition, 2022, 61(31): e202206283.
|
|
| [72] |
章真, 刘晓军, 陈夏, 姚丽萍, 张荣庆. 微藻生物技术在碳中和的应用与展望. 中国生物工程杂志, 2022, 42(S1): 160-173. ZHANG Z, LIU XJ, CHEN X, YAO LP, ZHANG RQ. Application and prospect of microalgae biotechnology in carbon neutralization. China Biotechnology, 2022, 42(S1): 160-173 (in Chinese).
|
|
| [73] |
NAGHSHBANDI MP, TABATABAEI M, AGHBASHLO M, AFTAB MN, IQBAL I. Metabolic engineering of microalgae for biofuel production[M]// Methods in Molecular Biology. New York, NY: Springer New York, 2019: 153-172.
|
|
| [74] |
BLASCO-GÓMEZ R, RAMIÓ-PUJOL S, BAÑERAS L, COLPRIM J, BALAGUER MD, PUIG S. Unravelling the factors that influence the bio- electrorecycling of carbon dioxide towards biofuels. Green Chemistry, 2019, 21(3): 684-691.
|
|
| [75] |
HANN EC, OVERA S, HARLAND-DUNAWAY M, NARVAEZ AF, LE DN, OROZCO-CÁRDENAS ML, JIAO F, JINKERSON RE. A hybrid inorganic- biological artificial photosynthesis system for energy-efficient food production. Nature Food, 2022, 3(6): 461-471.
|
|
| [76] |
XIAO KM, LIANG J, WANG XY, HOU TF, REN XN, YIN PQ, MA ZP, ZENG CP, GAO X, YU T, SI T, WANG B, ZHONG C, JIANG ZF, LEE CS, YU JCM, WONG PK. Panoramic insights into semi-artificial photosynthesis: origin, development, and future perspective. Energy & Environmental Science, 2022, 15(2): 529-549.
|
|
| [77] |
SU YD, CESTELLOS-BLANCO S, KIM JM, SHEN YX, KONG Q, LU D, LIU C, ZHANG H, CAO YH, YANG PD. Close-packed nanowire-bacteria hybrids for efficient solar-driven CO2 fixation. Joule, 2020, 4(4): 800-811.
|
|
| [78] |
LIU C, GALLAGHER JJ, SAKIMOTO KK, NICHOLS EM, CHANG CJ, CHANG MCY, YANG PD. Nanowire-bacteria hybrids for unassisted solar carbon dioxide fixation to value-added chemicals. Nano Letters, 2015, 15(5): 3634-3639.
|
|
| [79] |
JIAO ZY, HUANG XH, GUO SQ, WANG XY, ZHONG C, FEI Q. Electron supply strategies for microbial carbon fixation: a review. Chinese Journal of Biotechnology, 2022, 38(7): 2396-2409.
|
|
| [80] |
ZHANG SH, SHI JF, SUN YY, WU YZ, ZHANG YS, CAI ZY, CHEN YX, YOU C, HAN PP, JIANG ZY. Artificial thylakoid for the coordinated photoenzymatic reduction of carbon dioxide. ACS Catalysis, 2019, 9(5): 3913-3925.
|
|
| [81] |
LIU C, COLÓN BC, ZIESACK M, SILVER PA, NOCERA DG. Water splitting-biosynthetic system with CO2 reduction efficiencies exceeding photosynthesis. Science, 2016, 352(6290): 1210-1213.
|
|
 2023, Vol. 39
2023, Vol. 39