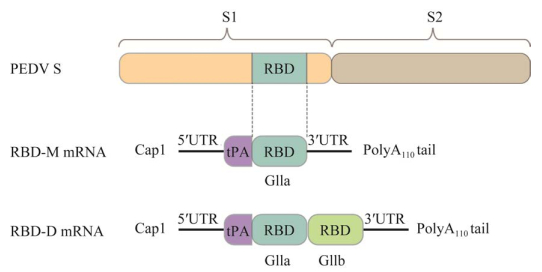
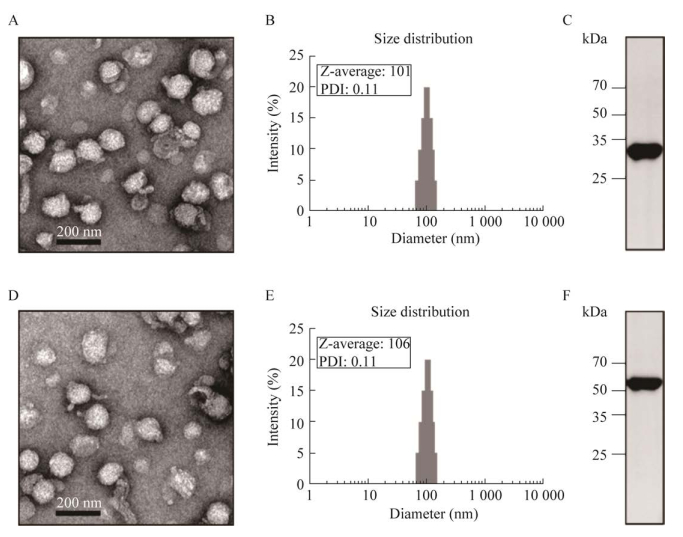
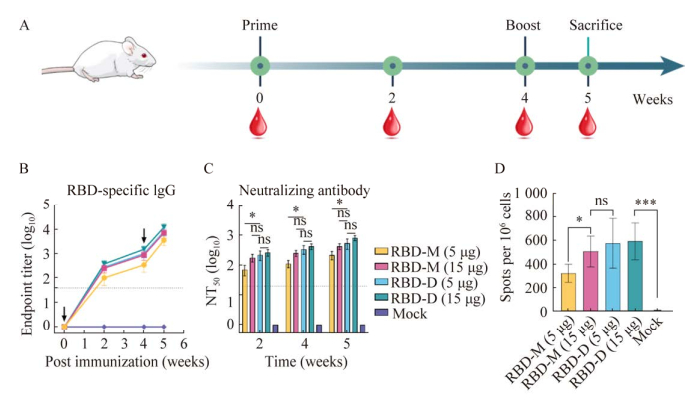
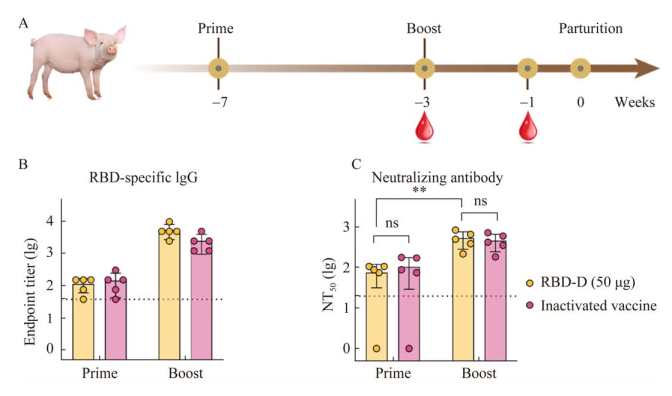
| [1] |
SUN RQ, CAI RJ, CHEN YQ, LIANG PS, CHEN DK, SONG CX. Outbreak of porcine epidemic diarrhea in suckling piglets, China. Emerging Infectious Diseases, 2012, 18(1): 161-163. DOI:10.3201/eid1801.111259
|
|
| [2] |
WANG XB, CHEN JF, SHI D, SHI HY, ZHANG X, YUAN J, JIANG SB, FENG L. Immunogenicity and antigenic relationships among spike proteins of porcine epidemic diarrhea virus subtypes G1 and G2. Archives of Virology, 2016, 161(3): 537-547. DOI:10.1007/s00705-015-2694-6
|
|
| [3] |
董世娟, 谢春芳, 司伏生, 陈冰清, 于瑞嵩, 李震. 猪流行性腹泻病毒免疫及疫苗研制. 生物工程学报, 2021, 37(8): 2603-2613. DONG SJ, XIE CF, SI FS, CHEN BQ, YU RS, LI Z. Immunization against porcine epidemic diarrhea virus and vaccine development. Chinese Journal of Biotechnology, 2021, 37(8): 2603-2613 (in Chinese). DOI:10.13345/j.cjb.200524
|
|
| [4] |
LIU XS, ZHANG QL, ZHANG LP, ZHOU P, YANG J, FANG YZ, DONG ZL, ZHAO DH, LI WY, FENG JX, CUI BF, ZHANG YG, WANG YL. A newly isolated Chinese virulent genotype GⅡb porcine epidemic diarrhea virus strain: biological characteristics, pathogenicity and immune protective effects as an inactivated vaccine candidate. Virus Research, 2019, 259: 18-27. DOI:10.1016/j.virusres.2018.10.012
|
|
| [5] |
LI CH, LI WT, LUCIO de ESESARTE E, GUO HB, van den ELZEN P, AARTS E, van den BORN E, ROTTIER PJM, BOSCH BJ. Cell attachment domains of the porcine epidemic diarrhea virus spike protein are key targets of neutralizing antibodies. Journal of Virology, 2017, 91(12): e00273-e00217.
|
|
| [6] |
MAKADIYA N, BROWNLIE R, van den HURK J, BERUBE N, ALLAN B, GERDTS V, ZAKHARTCHOUK A. S1 domain of the porcine epidemic diarrhea virus spike protein as a vaccine antigen. Virology Journal, 2016, 13: 57. DOI:10.1186/s12985-016-0512-8
|
|
| [7] |
YANG LM, TIAN DY, HAN JB, FAN WH, ZHANG Y, LI YL, SUN WQ, WEI YQ, TIAN XD, YU DD, FENG XL, CHENG G, BI YH, ZHENG YT, LIU WJ. A recombinant receptor-binding domain in trimeric form generates protective immunity against SARS-CoV-2 infection in nonhuman primates. The Innovation, 2021, 2(3): 100140. DOI:10.1016/j.xinn.2021.100140
|
|
| [8] |
GERDTS V, ZAKHARTCHOUK A. Vaccines for porcine epidemic diarrhea virus and other swine coronaviruses. Veterinary Microbiology, 2017, 206: 45-51. DOI:10.1016/j.vetmic.2016.11.029
|
|
| [9] |
KIM H, LEE YK, KANG SC, HAN BK, CHOI KM. Recent vaccine technology in industrial animals. Clinical and Experimental Vaccine Research, 2016, 5(1): 12-18. DOI:10.7774/cevr.2016.5.1.12
|
|
| [10] |
SHI DY, FAN BC, SUN B, ZHOU JZ, ZHAO YX, GUO RL, MA ZJ, SONG T, FAN HY, LI JZ, LI L, LI B. LDH nanoparticle adjuvant subunit vaccine induces an effective immune response for porcine epidemic diarrhea virus. Virology, 2022, 565: 58-64. DOI:10.1016/j.virol.2021.10.010
|
|
| [11] |
YU JS, SREENIVASAN C, UPRETY T, GAO RY, HUANG C, LEE EJ, LAWSON S, NELSON J, CHRISTOPHER-HENNINGS J, KAUSHIK RS, NELSON E, DIEL DG, HAUSE BM, LI F, WANG D. Piglet immunization with a spike subunit vaccine enhances disease by porcine epidemic diarrhea virus. Npj Vaccines, 2021, 6: 22. DOI:10.1038/s41541-021-00283-x
|
|
| [12] |
do VT, JANG J, PARK J, DAO HT, KIM K, HAHN TW. Recombinant adenovirus carrying a core neutralizing epitope of porcine epidemic diarrhea virus and heat-labile enterotoxin B of Escherichia coli as a mucosal vaccine. Archives of Virology, 2020, 165(3): 609-618. DOI:10.1007/s00705-019-04492-7
|
|
| [13] |
KE Y, YU D, ZHANG FQ, GAO J, WANG XY, FANG XK, WANG HG, SUN T. Recombinant vesicular stomatitis virus expressing the spike protein of genotype 2b porcine epidemic diarrhea virus: a platform for vaccine development against emerging epidemic isolates. Virology, 2019, 533: 77-85. DOI:10.1016/j.virol.2019.05.009
|
|
| [14] |
YUAN XM, LIN HX, LI B, HE KW, FAN HJ. Efficacy and immunogenicity of recombinant swinepox virus expressing the truncated S protein of a novel isolate of porcine epidemic diarrhea virus. Archives of Virology, 2017, 162(12): 3779-3789. DOI:10.1007/s00705-017-3548-1
|
|
| [15] |
MA ST, WANG L, HUANG XW, WANG XN, CHEN S, SHI W, QIAO XY, JIANG YP, TANG LJ, XU YG, LI YJ. Oral recombinant Lactobacillus vaccine targeting the intestinal microfold cells and dendritic cells for delivering the core neutralizing epitope of porcine epidemic diarrhea virus. Microbial Cell Factories, 2018, 17(1): 20. DOI:10.1186/s12934-018-0861-7
|
|
| [16] |
WANG XN, WANG L, HUANG XW, MA ST, YU ML, SHI W, QIAO XY, TANG LJ, XU YG, LI YJ. Oral delivery of probiotics expressing dendritic cell-targeting peptide fused with porcine epidemic diarrhea virus COE antigen: a promising vaccine strategy against PEDV. Viruses, 2017, 9(11): 312. DOI:10.3390/v9110312
|
|
| [17] |
WANG XL, WANG ZB, XU HY, XIANG B, DANG RY, YANG ZQ. Orally administrated whole yeast vaccine against porcine epidemic diarrhea virus induced high levels of IgA response in mice and piglets. Viral Immunology, 2016, 29(9): 526-531. DOI:10.1089/vim.2016.0067
|
|
| [18] |
YIN Y, ZHU L, LIU PJ, ZHAO J, FAN Y, SUN XG, XU ZW. Evaluation on the efficacy and immunogenicity of recombinant DNA plasmids expressing S gene from porcine epidemic diarrhea virus and VP7 gene from porcine rotavirus. Brazilian Journal of Microbiology, 2019, 50(1): 279-286. DOI:10.1007/s42770-018-0022-5
|
|
| [19] |
ZHANG YD, ZHANG XH, LIAO XD, HUANG XB, CAO SJ, WEN XT, WEN YP, WU R, LIU WM. Construction of a bivalent DNA vaccine co-expressing S genes of transmissible gastroenteritis virus and porcine epidemic diarrhea virus delivered by attenuated Salmonella typhimurium. Virus Genes, 2016, 52(3): 354-364. DOI:10.1007/s11262-016-1316-z
|
|
| [20] |
HUY NX, KIM SH, YANG MS, KIM TG. Immunogenicity of a neutralizing epitope from porcine epidemic diarrhea virus: M cell targeting ligand fusion protein expressed in transgenic rice calli. Plant Cell Reports, 2012, 31(10): 1933-1942. DOI:10.1007/s00299-012-1306-0
|
|
| [21] |
HUY NX, YANG MS, KIM TG. Expression of a cholera toxin B subunit-neutralizing epitope of the porcine epidemic diarrhea virus fusion gene in transgenic lettuce ( Lactuca sativa L.). Molecular Biotechnology, 2011, 48(3): 201-209. DOI:10.1007/s12033-010-9359-1
|
|
| [22] |
LIU XS, ZHANG LP, ZHANG QL, ZHOU P, FANG YZ, ZHAO DH, FENG JX, LI WY, ZHANG YG, WANG YL. Evaluation and comparison of immunogenicity and cross-protective efficacy of two inactivated cell culture-derived GⅡa- and GⅡb-genotype porcine epidemic diarrhea virus vaccines in suckling piglets. Veterinary Microbiology, 2019, 230: 278-282. DOI:10.1016/j.vetmic.2019.02.018
|
|
| [23] | |
|
| [24] |
王彧, 白岳丘, 田易晓, 王新月, 黄庆生. mRNA疫苗在疾病预防与治疗中的研究进展与展望. 中国生物工程杂志, 2022, 1-17. WANG Y, BAI YQ, TIAN YX, WANG XY, HUANG QS. Prospects and outlook of mRNA vaccines used in the prevention and therapies of diseases. China Biotechnology, 2022, 1-17 (in Chinese).
|
|
| [25] |
马宁, 年悬悬, 刘京, 邓涛, 张国梅, 吕传硕, 乐洋, 周蓉, 龚铮, 张家友, 杨晓明. 甲型H1N1流感病毒mRNA疫苗的制备及其免疫原性评价. 中国生物制品学杂志, 2022, 35(8): 907-911, 917. MA N, NIAN XX, LIU J, DENG T, ZHANG GM, LV CS, LE Y, ZHOU R, GONG Z, ZHANG JY, YANG XM. Preparation and immunogenicity evaluation of mRNA vaccine against influenza a (H1N1) virus. Chinese Journal of Biologicals, 2022, 35(8): 907-911, 917 (in Chinese).
|
|
 2023, Vol. 39
2023, Vol. 39