
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李仲霞, 刘妍, 罗泉, 吕雪峰
- LI Zhongxia, LIU Yan, LUO Quan, LÜ Xuefeng
- 从专利角度分析ω-转氨酶在我国手性胺生物合成应用中的研究进展
- The advance of ω-transaminase in chiral amine biosynthesis in China from the perspective of patents
- 生物工程学报, 2023, 39(8): 3169-3187
- Chinese Journal of Biotechnology, 2023, 39(8): 3169-3187
- 10.13345/j.cjb.220908
-
文章历史
- Received: November 14, 2022
- Accepted: February 20, 2023
2. 中国科学院青岛生物能源与过程研究所 中国科学院生物燃料重点实验室, 山东 青岛 266101;
3. 山东能源研究院, 山东 青岛 266101;
4. 青岛新能源山东省实验室, 山东 青岛 266101
2. Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong, China;
3. Shandong Energy Institute, Qingdao 266101, Shandong, China;
4. Qingdao New Energy Shandong Laboratory, Qingdao 266101, Shandong, China
手性胺是化合物手性中心上连有氨基的一类化合物,广泛存在于自然界各类生命体中(如氨基酸、氨基醇等),在生命遗传、代谢、生理过程中发挥重要作用。由于具有多样生物活性,手性胺常被作为结构单元,用于医药、农药和其他化工产品的合成。例如,糖尿病治疗药物西他列汀(sitagliptin)、喹诺酮类抗菌药加雷沙星(garenoxacin)、酰胺类除草剂异丙甲草胺(metolachlor)等都含有手性胺结构。开发高效、特异、环保且具有自主知识产权的手性胺合成技术,对我国医药、农药、材料产业发展具有重要意义。
目前,手性胺合成可通过3种方式进行:化学合成、动力学拆分、不对称生物催化合成。一般来说,化学法具有较好的通用性和可放大性,但往往存在反应步骤多、立体选择性受限、催化成本较高及重金属污染等问题;而利用化学或生物催化剂进行动力学拆分,虽能实现单一对映异构体的分离,但无法突破最高50%理论收率的限制。相比之下,利用ω-转氨酶(ω-transaminase, ωTA)底物范围广、立体选择性高的特点,一步不对称合成手性胺,兼具了反应条件温和、转化效率高、产品构型纯的优点,在手性胺合成工业中展现了巨大应用前景。ωTA成功应用于西他列汀的商业化生产,是该领域一个经典案例[1]。与化学合成相比,该方法将单位生产效率提高了53%,总废弃物降低了19%,生产工艺大幅简化。
随着医药市场对手性胺类药物需求的不断增加以及医药合成工业对高效、绿色生产工艺要求的提升,我国基于ωTA的手性胺生物合成技术研究不断加强。基于incoPat专利数据库信息,2012年及以前ω-转氨酶相关中国专利均由国外机构申请。2013年起,由我国机构申请的ωTA相关中国专利数量迅速增加(图 1)。截至2022年10月,相关公开专利累计超过120项。本文对2013年以来我国机构报道的ωTA相关中国专利进行了系统分析,分别从ωTA资源开发、酶性能的蛋白工程改造、在手性胺合成中应用现状以及催化转化技术工艺等方面进行了总结,以期为ωTA基础理论研究的深入和相关应用技术的推广提供参考。
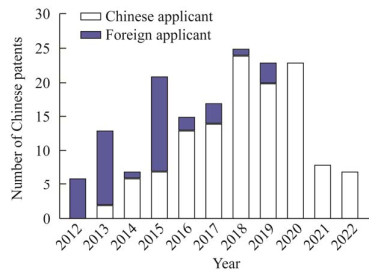
|
| 图 1 ωTA相关中国专利近年来申请数量变化趋势(基于incoPat数据库,截至2022.10.14) Fig. 1 Number of Chinese patents on ωTA applied in recent years (based on incoPat database, as of 2022.10.14). |
| |
本文以“ω-转氨酶”为关键词在incoPat专利数据库中对近10年来的中国专利进行检索(申请日时间范围设为“2012.01.01以后”,国别设置为“中国”,检索日为2022.10.14),共获得165项公开记录,其中以我国机构为申请主体的记录为124项。经过对授权信息去重,剩余记录82项,其中42项专利获得授权,占总申请数的51% (附表S1,国家微生物科学数据中心,登录号:NMDCX0000176)。
2 ωTA资源的应用、开发现状 2.1 ωTA基本性质ωTA属于5′-磷酸吡哆醛(pyridoxal-5'-phosphate, PLP)依赖型转移酶,可立体特异性催化氨基在氨基供体(如氨基酸、烷胺、芳香胺等)和羰基化合物(如醛、酮、酮酸等)之间的可逆转移。反应以PLP为辅酶,通过双底物乒乓机制进行[2]。简单而言(图 2),在ωTA作用下,来自氨基供体的氨基首先转移到PLP的羰基上,形成5′-磷酸吡哆胺(pyridoxamine-5'-phosphate, PMP)及相应的酮基副产物;随后,PMP将氨基转移至氨基受体上,生成目标手性胺,并释放PLP。这种转氨反应不受氨基在供体或受体位置上的限制,适合不同结构手性胺的催化合成。然而对一个具体对象而言,不同来源ωTA在底物识别偏好、催化效率上往往具有较大差异。因此,根据化合物结构和性质特点,选择合适的ωTA催化剂,是实现手性胺高效合成的关键。
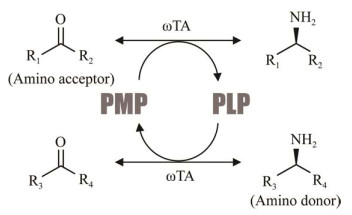
|
| 图 2 ωTA催化机制简图 Fig. 2 A simplified diagram of catalytic mechanism of ωTA. |
| |
本文概述专利涉及至少50种不同ωTA (不含重组体、突变体),其中具有明确序列信息的为47种(附表S2,国家微生物科学数据中心,登录号:NMDCX0000176)。这些转氨酶来自至少47个物种,绝大部分为微生物源(46种),仅有的一例例外为拟南芥的γ-氨基丁酸转氨酶(CN114574417A[3])。立体选择性方面,具有R、S型ω-转氨酶约各占一半。在本文概述的82项专利中,至少33项涉及4个被广泛研究的ωTA,即节杆菌(Arthrobacter sp.)来源的AbTA (源蛋白登录号3WWH_A)、土曲霉(Aspergillus terreus)来源的AtTA (源蛋白登录号4CE5_A)、紫色杆菌(Chromobacterium violaceum)来源的CvTA (源蛋白登录号WP_011135573.1)和河流弧菌(Vibrio fluvialis)来源的VfTA (源蛋白登录号AEA39183.1)。
AbTA是目前被研究较多的一个R型ωTA,最早由日本学者从Arthrobacter sp. KNK168中鉴定[4]。该酶对氨基供体具有R型立体选择性,可催化多种甲基酮类化合物(尤其是环型或芳香型化合物,如3, 4-二甲氧基苯丙酮、3-羟基苯乙酮)的胺化,在R型手性胺合成中具有重要应用价值[5-7]。在本文6项相关专利中(附表S2),AbTA及其突变体被成功应用于多种脂环型和芳香型手性胺的合成。例如,专利CN107686852A[8]、CN106399418A/B[9]报道了AbTA突变体在吡咯烷胺类化合物(如莫西沙星中间体)催化合成中的应用,产品纯度(e.e.)达到99%以上;在优化条件下,后者实现了99.8%的高转化效率。此外,专利CN103865964A利用AbTA突变体,也成功实现了从哌啶酮到(R)-哌啶胺的转化,产品纯度(e.e.)可达99%,收率达80%以上[10]。以上结果表明,AbTA及其衍生体酶在吡咯烷胺、哌啶胺类药物中间体的生物合成中,具有良好应用前景。
AtTA为另一个被广泛关注的R型转氨酶。该酶由Höhne等[11]通过生物信息学分析方法发现并鉴定。AtTA为同源二聚体,单体由325个氨基酸组成[12]。该酶对较大结构脂肪族底物(链长至少达到6个碳)具有催化偏好,而相同条件下对芳香型底物的催化效率则明显降低[13],表明该酶更适合脂肪型手性胺的生物合成。在本文分析中,AtTA相关专利共18项(附表S2),全部聚焦于AtTA的蛋白质工程改造,以提升其酶学性能。其中12项(即CN114134128A[14]、CN112481230A/B[15]、CN114107241A[16]、CN114181918A[17]、CN112359030A[18]、CN111826362A/B[19]、CN110144335A/B[20]、CN109486778A/B[21]、CN108913671A/B[22]、CN107058256A/B[23]、CN105950581A/B[24]、CN105441404A/B[25])关注该酶的热稳定性,多个热稳定性明显提升的AtTA突变体被成功构建(半衰期提高了至少207倍,半失活温度最高提高了13.7 ℃),为该酶的工业化应用奠定了良好基础。此外,通过定点突变和DNA重组技术,多个催化性能明显提升的AtTA衍生体也被构建。它们在多种芳香型手性胺药物中间体{如(R)-2, 3-二氯苯乙胺、(R)-2, 5-二氯苯乙胺、(R)-1-[3-氨基-4-(2, 4, 5-三氟苯基)丁酰基}吡咯-3-酮合成中展现了应用潜力。
CvTA是来自C. violaceum的一个S型ωTA,于2007年由Kaulmann等[26]鉴定。对蛋白的性质及结构分析表明,该蛋白为一个同源二聚体,单体由459个氨基酸组成。该酶对芳香型氨基供体(如苯甲胺、甲基苄胺、1-氨基茚满)和多种醛酮氨基受体(如乙醛酸、丙酮酸、苯甲醛)都具有良好的催化能力,在37 ℃、pH 8.3条件下表现最佳催化性能[26-28]。本文分析中,7项专利(附表S2)报道了CvTA的应用研究。通过对该酶36个位点的饱和突变,专利CN108048419A/B[29]、CN112094830A[30]成功筛选获得溶剂[如二甲基亚砜(dimethyl sulfoxide, DMSO)]耐受能力明显提升的突变体,部分突变体(如V379T-R416A-C418S-F89Y)对哌啶酮类底物展现了更高的催化效率,展现出其在该类手性胺工业合成应用中的潜力。此外,CvTA及其突变体在多酶偶联催化合成羟基酪醇、尼龙12单体、1, 2-氨基醇(CN114574417A[3]、CN110643555A[31]、CN109321509A/B[32])及酶固定化技术开发中(CN111117996A[33])也得到了应用。
VfTA为一个同源二聚体蛋白,也是近年来被广泛研究的S型ωTA,于2003年由韩国学者从V. fluvialis中鉴定[34-38]。尽管该酶具有高立体选择性以及对芳香型胺(如(S)-甲基苄胺、(S)-1-甲基-3-苯基丙胺、(S)-1-氨基茚满、(S)-苯乙酰甲醇)的高催化活性,其较窄的底物范围在一定程度上限制了该酶的应用。通过对关键活性区的改造,VfTA突变体对脂肪型氨基供体催化能力大幅提升,极大扩展了该酶在手性胺生物合成中的应用范围[39-40]。在专利CN109321509A/B中[32],作者将VfTA与环氧化物水解酶、醇脱氢酶、谷氨酸脱氢酶在大肠杆菌(Escherichia coli)中共表达,通过多酶偶联催化实现了多种1, 2-氨基醇类化合物的合成;在专利CN106399418A/B中[9],VfTA被用于莫西沙星侧链的生物合成。
除上述4个被广泛关注的ωTA,多个已被功能鉴定的ωTA也在专利中被应用,包括了来自如柠檬色节杆菌(Arthrobacter citreus)的AcTA[41]、人苍白杆菌(Ochrobactrum anthropi)的OaTA[42]、Neosartorya fischeri的NfTA[11, 43]、海王生丝单胞菌(Hyphomonas neptunium)的HnTA[11]、Gibberella zeae的GzTA[11]、异物外瓶霉(Exophiala xenobiotica)的ExTA[44]、Mesorhizobium japonicum的MjTA[11]、Mycobacterium vanbaalenii的MvTA[11]中的一些种类(附表S2)。它们在酶固定化技术开发、酶学性质改造及L-2-氨基丁酸、西他列汀前体等手性胺的生物合成中得到了应用。
2.3 ωTA资源的开发ωTA资源的不断开发是推动其应用的基础,通过活性分析、序列比对、关键功能域及结构分析等手段,人们已鉴定了多种ωTA[45]。除了上述性质已知、功能明确的ωTA,本文专利也对新型ωTA资源进行了开发。针对自然界中R型ωTA资源丰度远低于S型的客观情况,专利CN104630170A[46]、CN104630171A[47]分别从里氏木霉(Trichoderma reesei)、尖孢镰刀菌(Fusarium oxysporum)克隆鉴定了2种新型ωTA (附表S2, TrTA, FoTA)。新酶不仅表现出严格的R型选择性,还在底物谱上表现了宽广的适用范围(可催化多种芳香胺、脂肪胺),因此具有优良的应用潜力。针对西他列汀生物法合成过程中酶催化剂资源及相关生产技术被国外专利垄断的现状,CN110951706A/B[48]、CN110904066A/B[49]、CN111534494A/B[50]、CN111411094A/B[51]、CN111518783A/B[52]、CN111411095A/B[53]等系列专利利用生物信息学技术,从公开数据库中挖掘了来自Mycolicibacterium goodii (MgTA)、Capronia epimyces (CeTA)、Microbacterium sp.、Sciscionella marina (SmTA)、Sinirhodobacter hungdaonensis (ShTA)、Actinobacteria sp.等的多个立体特异性R型ωTA,并通过突变改造和片段重组,成功将上述新型ωTA用于西他列汀的催化合成。此外,专利CN109402188[54]也从短小芽孢杆菌(Bacillus pumilus)中鉴定一个新的R型ωTA (BpTA),该酶表现出了良好的pH稳定性及热稳定性。在S型ωTA方面,王华磊等(CN106520719A/B)从土壤宏基因组中,成功挖掘并表征一种ωTA (ATA-W12)[55-56]。该酶对哌啶酮类底物有较好催化活性,优化条件下可在8 h内将500 mmol/L N-boc-3-哌啶酮转化为(S)-N-boc-3-氨基哌啶,转化率高达100%,展现出该酶在哌啶胺类药物前体合成中巨大的应用潜力。此外,罗玮等[57] (CN112680487A)通过序列分析与比对,从泛营养副球菌(Paracoccus pantotrophus)中获得一种对芳香族胺具有高效催化能力的新型ωTA (PpTA),进一步扩充了S型ωTA工具资源。
3 ωTA的蛋白工程改造尽管ωTA具有种类多、催化多样性高、特异性强的特点,但由于其在稳定性、底物选择性、催化效率等方面的原因,野生型ωTA常常难以满足手性胺工业化生产需求。利用多种非理性、(半)理性策略对ωTA进行蛋白工程改造,是提升ωTA性能及应用潜力的有效途径[58]。本文分析中,半数以上的专利(附表S1)报道了对ωTA的蛋白工程改造。除了随机突变、迭代饱和突变、DNA重组等手段,多种生物信息学技术(如序列一致性分析、共进化网络分析、祖先序列重建分析)和计算生物学技术(如分子对接、分子动力学模拟、B-因子结合能量优化分析、二硫键引入分析、蛋白表面电荷互作能分析)也被应用其中。
3.1 基于非理性设计的改造在蛋白背景信息欠缺的情况下,基于随机突变的改造策略是提高目标酶性能一种有效方法。在L-2-氨基丁酸的合成中(CN105441403A/B[59]),研究者对3种不同来源的ωTA进行随机突变,成功筛选获得了一系列酶活提高的突变体。其中,一个来源于O. anthropi的双突变体酶(V154G-G229C),其催化生产L-2-氨基丁酸的能力较野生型酶提高了3.7倍。在对药物中间体(R)-2-(氨乙基)-4-氯苯酚的生物合成中(CN111996222A[60]),研究者对稳定伯克霍尔德氏菌(Burkholderia stabilis)来源的ωTA进行随机突变及组合突变改造,通过对约20 000个克隆的高通量筛选,也成功获得数个酶稳定性和活性提升的突变体,提高了目标ωTA的应用潜力。
3.2 基于理性、半理性设计的改造由于随机突变策略对筛选方法及工作强度有着较高要求,多数研究采用了理性、半理性设计策略对ωTA进行改造。例如,在近期L-2-氨基丁酸生物合成技术开发中(CN114540441A[61]),研究者采用分子对接技术对上述O. anthropi来源ωTA (OaTA)与底物之间的结合关系进行了分析,聚焦到6个改造位点,并利用组合突变快速获得了一个活性提高3.2倍的突变体(L57C-M419I),有效提升了改造效率。利用类似方法(同源建模结合分子对接),专利CN113215123A对新近发现的S型ωTA (ATA-W12)的4个目标位点进行单点突变,突变体酶对1-boc-3-哌啶酮和1-boc-3-吡咯烷酮底物的催化活性大幅提升,较野生型酶分别提高了10.4倍和5.5倍,在吡咯烷胺、哌啶胺类药物中间体的生物合成中展现很高的应用价值[62]。此外,在西他列汀合成技术开发中(表 1),针对西他列汀前体酮底物结构大、难识别的特点,研究者综合利用同源建模、分子对接、DNA重组、迭代饱和突变等技术,对ωTA底物识别、催化性能进行改造,成功赋予目标酶对西他列汀前体酮(或前体酮类似物)的催化能力,并将该能力提高到785.2 U/g的水平。突变体酶在1 000 mmol/L前体酮底物条件下催化30 h,达到了96.4%的高转化率。该成果在催化浓度和效率上均超过Merck和Codexis公司报道水平(492 mmol/L底物、92%转化率),对国产化西他列汀生物合成技术具有重要意义。
| Publication No. of patent | Enzyme involved | Engineering method | Improvement of target activity | References |
| CN110951706A/B | GzTA | ISM | 200 mmol/L precursor ketone and 30 h: 82.6% conversion | [48] |
| CN110904066A/B | MjTA, MgTA, GzTA | DR, ISM | 500 mmol/L precursor ketone and 24 h: 82.6% conversion | [49] |
| CN111518783A/B | SmTA, CeTA, GzTA | DR, ISM | 1 000 mmol/L precursor ketone and 30 h: 96.4% conversion | [52] |
| CN111534494A/B | CeTA | ISM | 700 mmol/L analogue of precursor ketone and 30 h: 94.6% conversion | [50] |
| CN111411094A/B | AtTA | ISM | 800 mmol/L analogue of precursor ketone and 30 h: 95.4% conversion | [51] |
| CN111411095A/B | ShTA, CeTA, AtTA | DR, ISM | 1 000 mmol/L analogue of precursor ketone and 30 h: 97.4% conversion | [53] |
| ISM: Iterative saturation mutagenesis; DR: DNA recombination. | ||||
除了上述底物选择性和催化效率,ωTA稳定性也是其在工业应用中需要考虑的重要性能,对于高效稳定生产及催化剂成本控制都具有重要意义。多项专利报道了对AtTA热稳定性的改造提升(表 2)。基于多种生物信息学及计算生物学分析(如序列一致性分析、共进化网络分析、祖先序列重建分析、分子对接、分子动力学模拟、B-因子结合能量优化分析、二硫键引入分析、蛋白表面电荷互作能分析)并结合定点突变、组合突变、迭代饱和突变等,野生型AtTA的热稳定性及酶活得到明显提高。例如,基于祖先序列重建分析获得的一个多点突变体,其半失活温度较野生型提高了11.1 ℃,半衰期超过1 440 min,为野生型酶的207倍以上。
| Publication No. of patent | Engineering method | Important AtTA mutants | Specific activity improvement (fold) | ΔT50 (℃) |
Δt1/2 (min) |
References |
| CN105441404A/B | BFA, EOA, SM | T130F | – | 2.9 | 6.3 | [25] |
| CN105950581A/B | DBF, BFA, EOA, SM | R131C-D134C | – | 1.6 | 3.5 | [24] |
| CN107058256A/B | SAA, SM | H210N | 1.7 | 6.4 | 25.8 | [23] |
| CN108913671A/B | SAA, DBF, SM | I77L-H210N-M150C-M280C | – | 11.8 | 16.6 | [22] |
| CN109486778A/B | CA, SSM | L118T | 3.5 | 5.3 | 19.1 | [21] |
| CN110144335A/B | CA, ISM | F115L-L118T | – | 8.8 | 59.0 | [20] |
| CN114107241A | CM | H210N-N245D-E253A-G292D | – | 3.3 | 5.7 | [16] |
| CN114181918A | CM | F115L-H210N | – | 11.3 | 94.3 | [17] |
| CN112481230A/B | CM | F115L-H210N-M150C-M280C | – | 13.7 | 165.8 | [15] |
| CN112359030A | IAP, MDA, SM | D268K | 2.9 | 6.1 | 21.0 | [18] |
| CN111826362A/B | IAP, SM | F115L-L118T-E133K | 4.8 | 7.7 | 32.0 | [19] |
| CN114134128A | ASR, GS | D5E-A12Q-I17V-S20A-T21S-E22A-T23S-A42H-I77L-T78S-T85S-L87M-R90K-D96E-Q97E-E104D-T130S-R131K-D134E-I135L-138insN-V143I-D153E-V157T-V162I-V163I-A174S-I175M-V188T-A195S-H210N-Q236E-N245D-A246V-E248R-F250N-F258V-R266Q-T284S-M288K-G292D-Q294K-I295V-A313P-N322E-E323S-R324A-N325S-325insKKSG | 1.7 | 11.1 | > 1 440.0 | [14] |
| –: Information is not available in the patents; BFA: B-factor analysis; EOA: Energy optimization analysis; SM: Site mutagenesis; DBF: Disulfide bond formation; SAA: Sequence aligment analysis; CA: Coevolution analysis; SSM: Site-saturation mutagenesis; ISM: Iterative saturation mutagenesis; CM: Combinatorial mutagenesis; IAP: Interaction analysis of protein surface electronic potential; MDA: Molecular dynamics analysis; ASR: Ancestral sequence reconstruction; GS: Gene synthesis. | ||||||
作为一类酶,ωTA具有广泛的底物选择性。通过选择合适的酶种类,ωTA能够实现对多种不同性质、结构特点手性胺的高效、特异性合成。在本文分析中,具有不同催化性能的ωTA已在多种医药、农药、材料手性胺的不对称生物合成中得到应用,并展现出良好的前景(表 3,图 3)。
| Target amines or their derivatives | Application | Publication No. of patent | References |
| Asymmetric biosynthesis | |||
| Sitagliptin or its intermediate | Antidiabetic drug | CN114540455A, CN111411095A/B, CN111518783A/B, CN111411094A/B, CN111534494A/B, CN110904066A/B, CN110951706A/B, CN110540975A/B, CN107365809A | [48-53, 63-65] |
| Evogliptin | Antidiabetic drug | CN106866551A | [66] |
| Intermediate of sitafloxacin hydrate | Quinolone antimicrobial drug | CN109456952A/B, CN109468297A/B, CN109486783A/B, CN109486784A/B | [67-70] |
| Intermediate of moxifloxacin | Quinolone antimicrobial drug | CN104262225A/B, CN106399418A/B, CN107686852A | [8-9, 71] |
| Intermediate of besifloxacin | Quinolone antimicrobial drug | CN110129306A, CN107663170A/B | [72-73] |
| Pyrrolidinamine | Pharmaceutical intermediate | CN106676142A/B, CN111349667A | [74-75] |
| Piperidinamine | Pharmaceutical intermediate | CN103865964A, CN106520719A/B, CN112824381A | [10, 55, 76] |
| L-2-aminobutyric acid | Intermediate of antiepileptic drug | CN105441403A/B, CN114540441A, CN112680487A | [57, 59, 61] |
| Intermediate of sacubitril | Anti-heart failure drug | CN106977415A/B, CN112174798A, CN109071407A | [77-79] |
| Intermediate of avacopan | Complement drug | CN113957106A | [80] |
| (R)-2, 3(or 2, 5)-dichlorophenethylamine | Pharmaceutical intermediate | CN110964705A | [81] |
| (S)-1-methoxy-2-propylamine | Intermediate of herbicide | CN114134126A | [82] |
| (S)-1-phenylpropylamine | Intermediate of antidepressant | CN112481229A | [83] |
| (R)-2-(1-aminoethyl)-4-chlorophenol | Pharmaceutical intermediate | CN111996222A | [60] |
| (R)-2-(1-aminoethyl)-4-fluorophenol | Intermediate of anticancer drug | CN107586796A/B | [84] |
| 3-amino-5-(α-aminoethyl)-tetrahydrofuran | Intermediate of material molecule | CN109824629A | [85] |
| Trifluoropropylamine | – | CN104894148A | [86] |
| (R)-N1, N1-Diethyl-1, 4-pentanediamine | Intermediate of chloroquine | CN110616236A/B | [87] |
| Dynamic resolution | |||
| L-glufosinate-ammonium | Herbicide | CN112553285A | [88] |
| (R)-3-amino-1-butanol | Intermediate of anti-AIDS drug | CN110358804A/B | [89] |
| Coupled multienzyme catalysis | |||
| Hydroxytyrosol | Natural antioxidant | CN114574417A | [3] |
| 1, 2-amino-alcohol | Pharmaceutical intermediate | CN109321509A/B, CN110713965A | [32, 90] |
| Nylon 12 monomer | Material molecule | CN110643555A | [31] |
| Homoserine, threonine | Multiple applications | CN114107408A | [91] |
| (R)-1-[3, 5-bis(trifluoromethyl)phenyl]ethylamine | Pharmaceutical intermediate | CN114457125A | [92] |
| –: Information is not mentioned in the patents. | |||
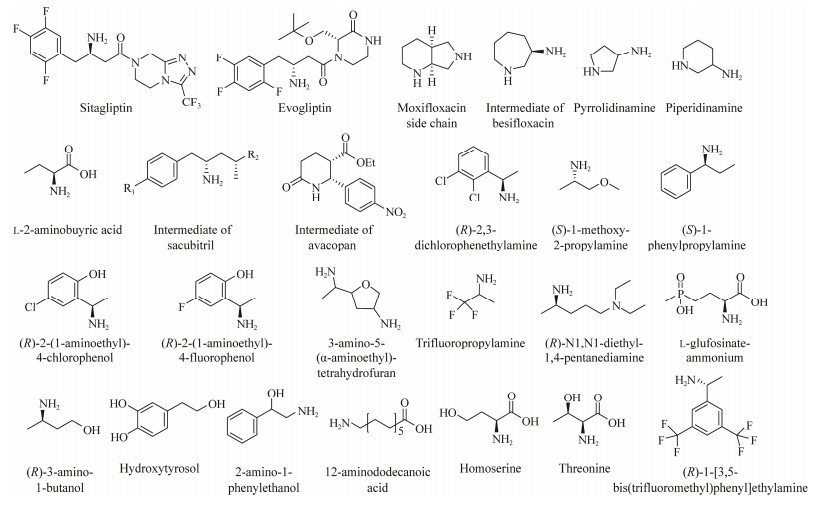
|
| 图 3 本文专利中利用ωTA催化合成的部分手性胺化合物或其衍生物结构一览 Fig. 3 Structures of chiral amines or their derivatives synthesized via ωTA-involved methods in the patents of this study. |
| |
西他列汀(商品名Januvia®)是美国Merck与Codexis公司于2006年推向市场的一种二肽基肽酶-4 (dipeptidyl peptidase-4, DPP-4)抑制剂型降糖药。由于功效显著,西他列汀在Ⅱ型糖尿病防治中被广泛使用,2016年全球销售额超过60亿美元[93]。该药于2017年被纳入我国国家基本医疗保险药品目录[94]。利用高效ωTA催化西他列汀前体酮一步转化为西他列汀,是该药合成的关键步骤,相关酶剂及生产工艺被国外公司专利垄断。因此,开发我国具有自主知识产权的ωTA酶剂及生产工艺对突破国外技术壁垒,实现西他列汀合成技术的国产化具有重要意义。西他列汀前体酮具有较大的分子结构,找到能高效识别并催化该结构的ωTA是研究的一大难点。本文统计中,至少9项专利致力于相关技术的研发。专利CN110540975A/B[64]、CN110951706A/B[48]、CN110904066A/B[49]、CN111411094A/B[51]、CN111534494A/B[50]、CN111411095A/B[53]、CN111518783A/B[52]通过基因挖掘,获得多个具有西他列汀前体酮(或其截短体酮类似物)催化能力的ωTA,并通过定点突变和DNA重组技术,进一步提高了酶活力及溶剂耐受性能。利用重组菌细胞为催化剂,研究者最终在1 mol/L前体酮底物、50% DMSO条件下,实现了97.4%的高转化效率,产品e.e.值高达99%以上。上述研究为西他列汀生物合成技术国产化奠定了坚实基础。除西他列汀外,很多ωTA也被用于喹诺酮类抗菌药物(如西他沙星、莫西沙星、贝西沙星)生物合成中,用来催化各类手性吡咯烷胺中间体的合成。例如,来自江南大学的系列专利(CN109456952A/B[67]、CN109468297A/B[68]、CN109486783A/B[69]、CN109486784A/B[70])对一个源于B. pumilus W3的ωTA进行蛋白工程改造,获得多个高活性突变体,它们均能有效催化西他沙星中间体(S)-5-苄基-5-氮杂螺[2.4]庚烷-7-胺与5-苄基-5-氮杂螺[2.4]庚烷-7-酮之间的转化,展现出其在西他沙星五元环中间体(S)-5-苄基-5-氮杂螺[2.4]庚烷-7-胺不对称合成中的应用价值。又如,专利CN106399418A/B[9]、CN107686852A[8]利用Arthrobacter sp.来源的ωTA,可将不同基团保护的4-(3-氯丙基)-3-吡咯烷酮高效地转化为相应吡咯烷胺。经条件优化,专利CN106399418A/B在约100 g/L的底物(3-(3-氯丙基)-4-羰基吡咯烷-1-甲酸苯甲酯)浓度下利用ωTA催化24 h,实现了99.8%的高转化率,产品纯度(e.e.)达到99.9%[9]。除上述化合物外,ωTA也被用于催化L-2-氨基丁酸、(R)-2, 3(或2, 5)-二氯苯乙胺、(S)-1-苯丙胺、(R)-2-(氨乙基)-4-氯苯酚、(R)-2-(1-氨基乙基)-4-氟苯胺、(R)-N1, N1-二乙基-1, 4-戊二胺等多种手性胺药物中间体的生物合成。
在农药合成方面,专利CN114134126A报道了除草剂农药中间体(S)-1-甲氧基-2-丙胺的生物合成[82]。(S)-1-甲氧基-2-丙胺是合成氯乙酰胺类除草剂——异丙甲草胺、二甲噻草胺的手性中间体。研究者通过对20种不同来源ωTA的筛选,成功获得一种来自Bacillus sp. Soil 768 D1的S型ωTA,可将1-甲氧基-2-丙酮高效转化为(S)-1-甲氧基-2-丙胺。利用高酶活突变体,作者以全细胞为催化剂,异丙胺为氨基供体,在700 mmol/L底物浓度(约62 g/L)条件下反应96 h,实现了85.1%的高转化效率,产品纯度(e.e.)达到99.8%。
在材料合成方面,专利CN109824629A将酶法与化学法相结合,利用来自虾蟹壳废弃物提取的N-乙酰-d-葡萄糖为原料,制备获得聚酰胺单体材料——3-氨基-5-(α-氨基乙基)-四氢呋喃[85]。在上述过程中,对于从中间体3-乙酰氨基-5-乙酰呋喃到3-乙酰氨基-5-(α-氨基乙基)-呋喃的转化,作者利用多种ωTA成功实现了催化。反应产物通过脱乙酰酶脱去酰基,并进一步化学催化加氢,最终获得二元胺产品。该方法利用天然废弃物为原料,通过酶法催化实现了重要中间体的绿色合成,代表了生物基聚酰胺材料合成新的发展方向。
4.2 在动力学拆分中的应用一般来说,ωTA对氨基供体具有严格的立体选择性。基于这一特点,利用ωTA对手性胺外消旋体进行动力学拆分,也是获得手性胺产品的一条途径。与不对称生物合成相比,ωTA在动力学拆分中的应用较为有限,相关专利报道了其在(R)-3-氨基正丁醇和L-草铵膦合成中的应用(表 3)。(R)-3-氨基正丁醇是合成抗艾滋病药物度鲁特韦的中间体,现有的化学、酶法合成技术中仍存在反应原料贵、反应浓度低、转化不稳定的问题。专利CN110358804A/B通过对8种不同S型ωTA的筛选,获得了4种对3-氨基正丁醇具有高效转化能力的ωTA[89]。来源于Brucella neotomae的ωTA (BnTA)在100 g/L 3-氨基正丁醇外消旋体条件下,经过16 h反应,实现了99.55%的R型产品纯度(e.e.),表明(S)-3-氨基正丁醇几乎被完全转化。草铵膦是目前被广泛使用的一类广谱型除草剂,其两种光学异构体(d型和l型)中仅有l型具有植物毒性。专利CN112553285A利用一种Bacillus sp. YM-1来源的R型ωTA,特异性地将d-草铵膦转化为2-羰基-4-(羟基甲基膦酰基)丁酸[88]。通过进一步偶联谷氨酸脱氢酶,将产物转化为L-草铵膦,并在醇脱氢酶的帮助下,实现辅酶与氨基供体(丙酮)的再生。整条路线实现了草铵膦消旋体的原位去消旋化,大幅提高了原料的利用率,最终获得的光学纯度≥85%的L-草铵膦产品,建立了生物酶法拆分合成L-草铵膦的技术路线。
4.3 在酶偶联催化中的应用在ωTA具体应用中,经常会出现产物(或副产物)积累所带来的反应平衡受限问题,大大降低了目标反应转化效率。通过多酶偶联策略,将ωTA与其他生物酶组合使用,不仅能够有效消除产物(或副产物)积累所带来的抑制效应,促进反应平衡的正向进行,还能进一步拓宽ωTA的合成应用范围,合成多种类型产品。
丙氨酸和异丙胺价格便宜、适用性广,经常作为氨基供体在ωTA催化反应中使用。移除反应生成的丙酮酸或丙酮副产物,是提高反应转化效率的有效途径。很多文献报道了利用乳酸脱氢酶[13, 95]、丙酮酸脱羧酶[96]、氨基酸氧化酶[97]、醇脱氢酶[98]等来实现这一目的。本文分析中,专利CN111454971A使用甲酸乙酰转移酶、乳酸脱氢酶的组合来移除丙酮酸副产物,并辅以甲酸脱氢酶进行甲酸产物的继续去除和辅酶再生,有效提高了底物酮的转化效率[99]。此外,专利CN114457125A在利用异丙胺为氨基供体合成(R)-1-[3, 5-双(三氟甲基)苯基]乙胺的过程中,将ωTA与醇脱氢酶偶联[92]。醇脱氢酶不仅将副产物丙酮转化为丙醇,同时还利用助溶剂(乙醇)为底物进行反应,实现了辅酶NADH的再生,目标反应转化率由82.96%提高到99.9%。
除了手性胺的合成,通过酶联反应,ωTA也被应用到氨基醇、氨基酸、羟基酪醇等物质的合成中。1, 2-氨基醇是一类重要的药物中间体,可用来合成拉洛来静(抗心绞痛药)、美托洛尔(心血管药)、奈必洛尔(心血管药)等。通过构建基因工程大肠杆菌,将环氧化物水解酶、醇脱氢酶、ωTA和谷氨酸脱氢酶在细胞内共表达,研究者(CN109321509A/B)成功利用全细胞一步催化环氧化物底物合成1, 2-氨基醇类化合物[32]。在100 mmol/L环氧苯乙烷底物浓度下,转化效率可达96.5%。该方法具有较好的通用性,同样适用于环氧丙烷、环氧丁烷等底物的转化。在氨基酸的合成中,专利CN114107408A将甲醇脱氢酶、醛缩酶与ωTA偶联,成功将甲醇、丙酮酸转化为高丝氨酸;继续偶联高丝氨酸激酶和苏氨酸合成酶,还能进一步将高丝氨酸转化为苏氨酸[91]。上述反应既可在体外体系中进行,也能在细胞内催化。该多酶体系的成功构建,不仅建立了一种新的高丝氨酸和苏氨酸非天然生物合成途径,还实现了将高能密度的甲醇引入氨基酸合成的途径,理论上可实现200%的糖酸摩尔转化率,具有极大的应用前景。此外,含有ωTA的酶联体系也被应用于羟基酪醇(CN114574417A[3])、尼龙12单体(CN110643555A[31])的生物合成中。
5 ωTA的固定化应用在ωTA催化应用中,往往需要添加有机溶剂以帮助底物溶解。有机溶剂的使用容易导致酶催化剂失活,在一定程度上提高了酶剂的使用成本。此外,酶蛋白及其他细胞杂质如果不能从反应体系中有效分离,也会导致产物萃取时严重的乳化现象,增加产品分离纯化难度,降低产品纯度。
为了解决上述问题,已有专利将多种酶固定化技术应用于ωTA。丰亚辉等[72] (CN110129306A)尝试将ωTA固定在4种不同固定化载体上(环氧树脂、氨基载体树脂、吸附载体树脂、离子交换树脂),均获得了高效的固定化酶。经环氧树脂固定化后,固定化酶比活为游离酶的91%,可在55 ℃下连续使用15次,批次反应转化率保持在90%以上,展现出优良的稳定性及连续使用性能。专利CN111647634A利用乙二胺对环氧树脂载体进行修饰,获得性能提升的氨基-环氧树脂载体[100]。用该载体对ATA-W12酶进行固定化处理,酶活回收率达到75%。固定化酶在4 ℃保存30 d后没有明显活性损失,并在重复使用20次后仍然保留了85%的活性,并成功应用于连续流反应体系。对于多酶体系,专利CN110540938A开发了一种有序定向共固定的方法[101]。该方法将长链醇氧化酶与ωTA用硝酸锌、2-甲基咪唑固定,固定化酶进一步分别固定于微孔滤膜上,并按反应顺序组装到渗透汽化膜组件中,形成有序的共固定酶膜反应器。这种组合方式不仅增强了酶的稳定性,还将反应与分离过程一体化,利于酶联体系的高效运行。
6 总结与展望经过近10年的发展,我国利用ωTA进行手性胺及其衍生物的生物合成已取得长足发展。无论在新酶资源挖掘、酶性质的蛋白工程改造,还是在生物合成应用、催化工艺技术完善方面均取得一系列具有应用潜力的成果。但与广大的绿色生产需求相比,目前真正实现规模化生产应用的案例仍极为有限。继续开发具有自主知识产权的高效ωTA催化剂及应用技术,仍是需要继续发展的方向。在新型高效酶资源的开发中,蛋白质工程策略已展现出强大的定向改造能力,是获取目标性能ωTA的重要手段。继续加强对酶基础性质、催化特性及结构特征的解析,结合多种生物信息学、计算生物学技术来进行理性、半理性设计改造,将使酶分子改造更加快速、高效。另一方面,近年来基于生物信息学技术的新酶挖掘策略,也逐渐成为开发新型ωTA资源的重要手段。在1997–2019年鉴定的144种ωTA中[45],基于序列同源性比对、特征或关键结构域分析等手段鉴定的ωTA为105种,占总数的73%,获得了大量具有R型催化能力或较大分子结构底物催化能力的新酶资源[11, 43, 102]。因此,将上述两种策略结合使用,将能更高效地推动我国自主知识产权ωTA资源的开发。
尽管我国ωTA相关应用报道较多,但大部分集中于资源及催化技术开发,关于生产工艺过程及规模化放大技术的报道仍十分有限,这限制了ωTA生物合成技术的实际推广使用。加强ωTA下游应用技术开发,同样也是未来需要努力的方向。
| [1] |
SAVILE CK, JANEY JM, MUNDORFF EC, MOORE JC, TAM S, JARVIS WR, COLBECK JC, KREBBER A, FLEITZ FJ, BRANDS J, DEVINE PN, HUISMAN GW, HUGHES GJ. Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture. Science, 2010, 329(5989): 305-309. DOI:10.1126/science.1188934
|
| [2] |
SLAUB I, GALMAN JL, LLOYD RC, TURNER NJ. Discovery, engineering, and synthetic application of transaminase biocatalysts. ACS Catalysis, 2017, 7(12): 8263-8284. DOI:10.1021/acscatal.7b02686
|
| [3] |
蔡宇杰, 燕毅, 丁彦蕊, 白亚军, 郑晓晖. 一种生产羟基酪醇的菌株及方法: CN202210292883.2[P]. 2022-06-03. CAI YJ, YAN Y, DING YR, BAI YJ, ZHENG XH. The invention relates to a strain and a method for producing hydroxytyrosol: CN202210292883.2[P]. 2022-06-03 (in Chinese). |
| [4] |
YAMADA Y, IWASAKI A, KIZAKI N, MATSUMOTO K, IKENAKA Y, OGURA M, HASEGAWA J. Process for producing optically active amino compounds: WO9848030[P]. 1998-10-29.
|
| [5] |
IWASAKI A, YAMADA Y, IKENAKA Y, HASEGAWA J. Microbial synthesis of (R)- and (S)-3, 4-dimethoxyamphetamines through stereoselective transamination. Biotechnology Letters, 2003, 25(21): 1843-1846. DOI:10.1023/A:1026229610628
|
| [6] |
IWASAKI A, YAMADA Y, KIZAKI N, HASEGAWA J. Microbial synthesis of chiral amines by (R)-specific transamination with Arthrobacter sp. KNK168. Applied Microbiology and Biotechnology, 2006, 69(5): 499-505. DOI:10.1007/s00253-005-0002-1
|
| [7] |
IWASAKI A, MATSUMOTO K, HASEGAWA J, YASOHARA Y. A novel transaminase, (R)-amine: pyruvate aminotransferase, from Arthrobacter sp. KNK168 (FERM BP-5228): purification, characterization, and gene cloning. Applied Microbiology and Biotechnology, 2012, 93(4): 1563-1573. DOI:10.1007/s00253-011-3580-0
|
| [8] |
杨汉荣, 谢凌拾, 陶荣盛, 李涛, 王博. 一种莫西沙星中间体化合物的制备方法: CN201610633427.4[P]. 2018-02-13. YANG HR, XIE LS, TAO RS, LI T, WANG B. The invention relates to a preparation method of a moxifloxacin intermediate compound: CN201610633427.4[P]. 2018-02-13 (in Chinese). |
| [9] |
陶军华, 梁晓亮, 蒋相军, 乐庸堂. 一种生物法制备莫西沙星侧链的方法: CN201510455136.6[P]. 2020-09-25. TAO JH, LIANG XL, JIANG XJ, LE YT. Method for preparing moxifloxacin side chain through biological method: CN201510455136.6[P]. 2020-09-25 (in Chinese). |
| [10] |
杨晟, 陶荣盛, 李涛, 杨汉荣. 转氨酶法合成(R)-3-氨基哌啶的方法: CN201410095994. X[P]. 2014-06-18. YANG S, TAO RS, LI T, YANG HR. Method for synthesizing (R)-3-amino-piperidine by adopting transaminase: CN201410095994. X[P]. 2014-06-18 (in Chinese). |
| [11] |
HÖHNE M, SCHÄTZLE S, JOCHENS H, ROBINS K, BORNSCHEUER UT. Rational assignment of key motifs for function guides in silico enzyme identification. Nature Chemical Biology, 2010, 6(11): 807-813. DOI:10.1038/nchembio.447
|
| [12] |
ŁYSKOWSKI A, GRUBER C, STEINKELLNER G, SCHÜRMANN M, SCHWAB H, GRUBER K, STEINER K. Crystal structure of an (R)-selective ω-transaminase from Aspergillus terreus. PLoS One, 2014, 9(1): e87350. DOI:10.1371/journal.pone.0087350
|
| [13] |
MUTTI FG, FUCHS CS, PRESSNITZ D, SATTLER JH, KROUTIL W. Stereoselectivity of four (R)-selective transaminases for the asymmetric amination of ketones. Advanced Synthesis & Catalysis, 2011, 353(17): 3227-3233.
|
| [14] |
黄俊, 蔡婷婷, 邱帅, 吕常江, 樊芳芳, 李业, 王丰, 李元源. 一种基于祖先序列重建的ω-转氨酶突变体: CN202111482472.1[P]. 2022-03-04. HUANG J, CAI TT, QIU S, LÜ CJ, FAN FF, LI Y, WANG F, LI YY. ω-aminotransferase mutant based on ancestor sequence reconstruction: CN202111482472.1[P]. 2022-03-04 (in Chinese). |
| [15] |
黄俊, 刘春燕, 梅乐和, 陈海滨, 吕常江, 胡升, 王宏鹏, 赵伟睿, 樊芳芳, 李业, 于林凯, 周一峰. 一种通过DNA合成改组组合突变获得的ω-转氨酶突变体及应用: CN202011415007.1[P]. 2021-12-07. HUANG J, LIU CY, MEI LH, CHEN HB, LÜ CJ, HU S, WANG HP, ZHAO WR, FAN FF, LI Y, YU LK, ZHOU YF. ω-aminotransferase mutant obtained by DNA (deoxyribonucleic acid) synthesis, shuffling and combination mutation and application of ω-aminotransferase mutant: CN202011415007.1[P]. 2021-12-07 (in Chinese). |
| [16] |
黄俊, 刘春燕, 梅乐和, 陈海滨, 吕常江, 胡升, 王宏鹏, 赵伟睿, 樊芳芳, 李业, 于林凯, 周一峰. 一种通过DNA合成改组组合突变获得的ω-转氨酶突变体及应用: CN202111331763.0[P]. 2022-03-01. HUANG J, LIU CY, MEI LH, CHEN HB, LÜ CJ, HU S, WANG HP, ZHAO WR, FAN FF, LI Y, YU LK, ZHOU YF. ω-aminotransferase mutant obtained by DNA (deoxyribonucleic acid) synthesis, shuffling and combination mutation and application of ω-aminotransferase mutant: CN202111331763.0[P]. 2022-03-01 (in Chinese). |
| [17] |
黄俊, 刘春燕, 梅乐和, 陈海滨, 吕常江, 胡升, 王宏鹏, 赵伟睿, 樊芳芳, 李业, 于林凯, 周一峰. 一种通过DNA合成改组组合突变获得的ω-转氨酶突变体及应用: CN202111345072.6[P]. 2022-03-15. HUANG J, LIU CY, MEI LH, CHEN HB, LÜ CJ, HU S, WANG HP, ZHAO WR, FAN FF, LI Y, YU LK, ZHOU YF. ω-aminotransferase mutant obtained by DNA (deoxyribonucleic acid) synthesis, shuffling and combination mutation and application of ω-aminotransferase mutant: CN202111345072.6[P]. 2022-03-15 (in Chinese). |
| [18] |
黄俊, 曹佳仁, 梅乐和, 陈海滨, 吕常江, 王宏鹏, 胡升, 赵伟睿, 李业, 樊芳芳, 于林凯, 周一峰. 一种ω-转氨酶突变体及其应用: CN202011344825.7[P]. 2021-02-12. HUANG J, CAO JR, MEI LH, CHEN HB, LÜ CJ, WANG HP, HU S, ZHAO WR, LI Y, FAN FF, YU LK, ZHOU YF. ω-transaminase mutant and application thereof: CN202011344825.7[P]. 2021-02-12 (in Chinese). |
| [19] |
花雨娇, 黄俊, 曹佳仁, 梅乐和, 吕常江, 王宏鹏, 于林凯, 周一峰, 葛青, 樊芳芳, 李业, 叶青文, 陈思艺, 张仪荻. 一种ω-转氨酶突变体、基因及应用: CN202010667173.4[P]. 2020-10-27. HUA YJ, HUANG J, CAO JR, MEI LH, LÜ CJ, WANG HP, YU LK, ZHOU YF, GE Q, FAN FF, LI Y, YE QW, CHEN SY, ZHANG YD. ω-aminotransferase mutant, gene and application: CN202010667173.4[P]. 2020-10-27 (in Chinese). |
| [20] |
黄俊, 梅乐和, 吕常江, 朱婉丽, 王宏鹏, 胡升, 赵伟睿. 一种ω-转氨酶双突变体及其应用: CN201910343331.8[P]. 2019-08-20. HUANG J, MEI LH, LÜ CJ, ZHU WL, WANG HP, HU S, ZHAO WR. ω-aminotransferase double mutant and application thereof: CN201910343331.8[P]. 2019-08-20 (in Chinese). |
| [21] |
黄俊, 梅乐和, 朱婉丽, 吕常江, 胡升, 赵伟睿, 王宏鹏. 一种基于共进化网络的ω-转氨酶突变体以及制备方法和应用: CN201811230792.6[P]. 2020-08-25. HUANG J, MEI LH, ZHU WL, LÜ CJ, HU S, ZHAO WR, WANG HP. ω-aminotransferase mutant based on coevolution network and preparation method and application thereof: CN201811230792.6[P]. 2020-08-25 (in Chinese). |
| [22] |
黄俊, 梅乐和, 谢东芳, 吕常江, 朱婉丽, 胡升, 赵伟睿. 一种ω-转氨酶突变体及其应用: CN201810619322.2[P]. 2020-07-24. HUANG J, MEI LH, XIE DF, LÜ CJ, ZHU WL, HU S, ZHAO WR. ω-transaminase mutant and application thereof: CN201810619322.2[P]. 2020-07-24 (in Chinese). |
| [23] |
黄俊, 谢东芳, 方卉, 梅乐和, 王宏鹏, 胡升, 吕常江, 赵伟睿. ω-转氨酶突变体及其制备方法和应用: CN201710308984.3[P]. 2019-10-18. HUANG J, XIE DF, FANG H, MEI LH, WANG HP, HU S, LÜ CJ, ZHAO WR. ω-aminotransferase mutant and its preparation method and application: CN201710308984.3[P]. 2019-10-18 (in Chinese). |
| [24] |
黄俊, 谢东芳, 梅乐和, 王宏鹏, 胡升, 方卉, 赵伟睿, 吕常江, 李伊莹. 一种引入二硫键的ω-转氨酶突变体及其应用: CN201610456683.0[P]. 2019-11-19. HUANG J, XIE DF, MEI LH, WANG HP, HU S, FANG H, ZHAO WR, LÜ CJ, LI YY. Disulfide-bond-introduced ω-aminotransferase mutant and application thereof: CN201610456683.0[P]. 2019-11-19 (in Chinese). |
| [25] |
黄俊, 谢东芳, 楼坚, 蒋成君, 吴元锋, 龚金炎. ω-转氨酶突变体及其编码基因和制备方法: CN201510901522.3[P]. 2018-09-11. HUANG J, XIE DF, LOU J, JIANG CJ, WU YF, GONG JY. ω-aminotransferase mutant and its coding gene and preparation method: CN201510901522.3[P]. 2018-09-11 (in Chinese). |
| [26] |
KAULMANN U, SMITHIES K, SMITH MEB, HAILES HC, WARD JM. Substrate spectrum of ω-transaminase from Chromobacterium violaceum DSM 30191 and its potential for biocatalysis. Enzyme and Microbial Technology, 2007, 41(5): 628-637. DOI:10.1016/j.enzmictec.2007.05.011
|
| [27] |
SCHELL U, WOHLGEMUTH R, WARD JM. Synthesis of pyridoxamine 5′-phosphate using an MBA: pyruvate transaminase as biocatalyst. Journal of Molecular Catalysis B-Enzymatic, 2009, 59(4): 279-285. DOI:10.1016/j.molcatb.2008.10.005
|
| [28] |
HUMBLE MS, CASSIMJEE KE, HÅKANSSON M, KIMBUNG YR, WALSE B, ABEDI V, FEDERSEL HJ, BERGLUND P, LOGAN DT. Crystal structures of the Chromobacterium violaceum ω-transaminase reveal major structural rearrangements upon binding of coenzyme PLP. FEBS Journal, 2012, 279(5): 779-792. DOI:10.1111/j.1742-4658.2012.08468.x
|
| [29] |
洪浩, 詹姆斯·盖吉, 卢江平, 徐幸福, 于文燕, 黄鑫, 马玉磊, 程逸冰. 转氨酶突变体及其应用: CN201711131103.1[P]. 2020-10-23. HONG H, JAMES G, LU JP, XU XF, YU WY, HUANG X, MA YL, CHENG YB. Transaminase mutant and application thereof: CN201711131103.1[P]. 2020-10-23 (in Chinese). |
| [30] |
洪浩, 詹姆斯·盖吉, 卢江平, 徐幸福, 于文燕, 黄鑫, 马玉磊, 程逸冰. 转氨酶突变体及其应用: CN202011020098.9[P]. 2020-12-18. HONG H, JAMES G, LU JP, XU XF, YU WY, HUANG X, MA YL, CHENG YB. Transaminase mutants and uses thereof: CN202011020098.9[P]. 2020-12-18 (in Chinese). |
| [31] |
叶丽丹, 于洪巍, 葛佳炜. 一种基因工程菌及其构建方法及其在生产尼龙12单体12-氨基月桂酸中的应用: CN201910749344.5[P]. 2020-01-03. YE LD, YU HW, GE JW. Genetically engineered bacterium and construction method thereof and application thereof in production of nylon 12 monomer 12-amino lauric acid: CN201910749344.5[P]. 2020-01-03 (in Chinese). |
| [32] |
饶志明, 刘松, 高仁杰, 张显, 杨套伟, 徐美娟. 一种利用全细胞转化生产1, 2-氨基醇类化合物的方法: CN201811344825. X[P]. 2021-01-29. RAO ZM, LIU S, GAO RJ, ZHANG X, YANG TW, XU MJ. Method for producing 1, 2-amino alcohol compound by using whole-cell conversion: CN201811344825. X[P]. 2021-01-29 (in Chinese). |
| [33] |
洪浩, 詹姆斯·盖吉, 肖毅, 罗杰斯卡·维亚撒·威廉姆斯, 崔瑜霞, 张娜, 赵佳东, 高妍妍. 固定化酶、其制备方法及应用: CN202010038661.9[P]. 2020-05-08. HONG H, JAMES G, XIAO Y, ROGERSCA VW, CUI YX, ZHANG N, ZHAO JD, GAO YY. Immobilized enzyme and preparation method and application of immobilized enzyme: CN202010038661.9[P]. 2020-05-08 (in Chinese). |
| [34] |
SHIN JS, YUN H, JANG JW, PARK I, KIM BG. Purification, characterization, and molecular cloning of a novel amine: pyruvate transaminase from Vibrio fluvialis JS17. Applied Microbiology and Biotechnology, 2003, 61(5-6): 463-471. DOI:10.1007/s00253-003-1250-6
|
| [35] |
YUN H, CHO BK, KIM BG. Kinetic resolution of (R, S)-sec-butylamine using omega-transaminase from Vibrio fluvialis JS17 under reduced pressure. Biotechnology and Bioengineering, 2004, 87(6): 772-778. DOI:10.1002/bit.20186
|
| [36] |
SHIN JS, KIM BG. Transaminase-catalyzed asymmetric synthesis of L-2-aminobutyric acid from achiral reactants. Biotechnology Letters, 2009, 31(10): 1595-1599. DOI:10.1007/s10529-009-0057-7
|
| [37] |
CHEN S, CAMPILLO-BROCAL JC, BERGLUND P, HUMBLE MS. Characterization of the stability of Vibrio fluvialis JS17 amine transaminase. Journal of Biotechnology, 2018, 282: 10-17. DOI:10.1016/j.jbiotec.2018.06.309
|
| [38] |
WU X, FEI M, CHEN Y, WANG Z, CHEN Y. Enzymatic synthesis of L-norephedrine by coupling recombinant pyruvate decarboxylase and ω-transaminase. Applied Microbiology and Biotechnology, 2014, 98(17): 7399-7408. DOI:10.1007/s00253-014-5797-1
|
| [39] |
CHO BK, PARK HY, SEO JH, KIM J, KANG TJ, LEE BS, KIM BG. Redesigning the substrate specificity of ω-aminotransferase for the kinetic resolution of aliphatic chiral amines. Biotechnology and Bioengineering, 2008, 99(2): 275-284. DOI:10.1002/bit.21591
|
| [40] |
MIDELFORT KS, KUMAR R, HAN S, KARMILOWICZ MJ, MCCONNELL K, GEHLHAAR DK, MISTRY A, CHANG JS, ANDERSON M, VILLALOBOS A, MINSHULL J, GOVINDARAJAN S, WONG JW. Redesigning and characterizing the substrate specificity and activity of Vibrio fluvialis aminotransferase for the synthesis of imagabalin. Protein Engineering Design & Selection, 2013, 26(1): 25-33.
|
| [41] |
van OOSTERWIJK N, WILLIES S, HEKELAAR J, van SCHELTINGA ACT, TURNER NJ, DIJKSTRA BW. Structural basis of the substrate range and enantioselectivity of two (S)-selective ω-transaminases. Biochemistry, 2016, 55(31): 4422-4431. DOI:10.1021/acs.biochem.6b00370
|
| [42] |
PARK ES, KIM M, SHIN JS. Molecular determinants for substrate selectivity of ω-transaminases. Applied Microbiology and Biotechnology, 2012, 93(6): 2425-2435. DOI:10.1007/s00253-011-3584-9
|
| [43] |
SCHÄTZLE S, STEFFEN-MUNSBERG F, THONTOWI A, HÖHNE M, ROBINS K, BORNSCHEUER UT. Enzymatic asymmetric synthesis of enantiomerically pure aliphatic, aromatic and arylaliphatic amines with (R)-selective amine transaminases. Advanced Synthesis & Catalysis, 2011, 353(13): 2439-2445.
|
| [44] |
TELZEROW A, PARIS J, HÅKANSSON M, GONZÁLEZ-SABÍN J, RÍOS-LOMBARDÍA N, SCHÜRMANN M, GRÖGER H, MORÍS F, KOURIST R, SCHWAB H, STEINER K. Amine transaminase from Exophiala xenobiotica-crystal structure and engineering of a fold IV transaminase that naturally converts biaryl ketones. ACS Catalysis, 2019, 9(2): 1140-1148. DOI:10.1021/acscatal.8b04524
|
| [45] |
KELLY SA, MIX S, MOODY TS, GILMORE BF. Transaminases for industrial biocatalysis: novel enzyme discovery. Applied Microbiology and Biotechnology, 2020, 104(11): 4781-4794. DOI:10.1007/s00253-020-10585-0
|
| [46] |
朱敦明, 姜进举, 陈曦, 吴洽庆, 冯进辉, 马延和. 一种来源于里氏木霉的新(R)-转氨酶及其应用: CN201310556825.7[P]. 2015-05-20. ZHU DM, JIANG JJ, CHEN X, WU QQ, FENG JH, MA YH. New (R)-transaminase from Trichoderma reesei and application thereof: CN201310556825.7[P]. 2015-05-20 (in Chinese). |
| [47] |
朱敦明, 姜进举, 陈曦, 吴洽庆, 冯进辉, 马延和. 一种来源于尖孢镰刀菌的新(R)-转氨酶及其应用: CN201310556932. X[P]. 2015-05-20. ZHU DM, JIANG JJ, CHEN X, WU QQ, FENG JH, MA YH. New (R)-transaminase from Fusarium oxysporum and application thereof: CN201310556932. X[P]. 2015-05-20 (in Chinese). |
| [48] |
柳志强, 李军良, 贾东旭, 郑裕国, 张晓健, 徐海鹏, 彭晨. 重组R-ω-转氨酶、突变体及在不对称合成西他列汀中的应用: CN201910871261.3[P]. 2021-08-27. LIU ZQ, LI JL, JIA DX, ZHENG YG, ZHANG XJ, XU HP, PENG C. Recombinant R-ω-transaminase, mutant and application thereof in asymmetric synthesis of sitagliptin: CN201910871261.3[P]. 2021-08-27 (in Chinese). |
| [49] |
柳志强, 贾东旭, 郑裕国, 李军良, 彭晨, 徐海鹏, 孙晨奕. 重组R型转氨酶、突变体及其应用: CN201911309350.5[P]. 2021-08-27. LIU ZQ, JIA DX, ZHENG YG, LI JL, PENG C, XU HP, SUN CY. Recombinant R type aminotransferase mutant and application thereof: CN201911309350.5[P]. 2021-08-27 (in Chinese). |
| [50] |
柳志强, 彭晨, 贾东旭, 李军良, 程峰, 张晓健, 郑裕国, 何人宝, 金逸中, 林娇华. (R)-ω-转氨酶突变体及其在制备西他列汀中间体中的应用: CN202010273326.7[P]. 2021-10-01. LIU ZQ, PENG C, JIA DX, LI JL, CHENG F, ZHANG XJ, ZHENG YG, HE RB, JIN YZ, LIN JH. (R)-ω-transaminase mutant and application thereof in preparation of sitagliptin intermediate: CN202010273326.7[P]. 2021-10-01 (in Chinese). |
| [51] |
柳志强, 贾东旭, 彭晨, 李军良, 程峰, 张晓健, 郑裕国, 何人宝, 金逸中, 林娇华. 一种(R)-ω-转氨酶突变体及其应用: CN202010273576.0[P]. 2021-10-01. LIU ZQ, JIA DX, PENG C, LI JL, CHENG F, ZHANG XJ, ZHENG YG, HE RB, JIN YZ, LIN JH. (R)-ω-transaminase mutant and application thereof: CN202010273576.0[P]. 2021-10-01 (in Chinese). |
| [52] |
柳志强, 贾东旭, 彭晨, 李军良, 程峰, 张晓健, 郑裕国, 何人宝, 金逸中, 林娇华. 新型重组(R)-ω-转氨酶、突变体及其在制备西他列汀中的应用: CN202010277476.5[P]. 2021-07-23. LIU ZQ, JIA DX, PENG C, LI JL, CHENG F, ZHANG XJ, ZHENG YG, HE RB, JIN YZ, LIN JH. Novel recombinant (R)-ω-aminotransferase, mutant thereof and application of recombinant (R)-ω-aminotransferase and mutant thereof in preparation of sitagliptin: CN202010277476.5[P]. 2021-07-23 (in Chinese). |
| [53] |
柳志强, 贾东旭, 彭晨, 李军良, 程峰, 张晓健, 郑裕国, 何人宝, 金逸中, 林娇华. 一种新型重组(R)-ω-转氨酶及其突变体和应用: CN202010277479.9[P]. 2021-07-23. LIU ZQ, JIA DX, PENG C, LI JL, CHENG F, ZHANG XJ, ZHENG YG, HE RB, JIN YZ, LIN JH. Novel recombinant (R)-ω-transaminase, and mutant and applications of recombinant (R)-ω-transaminase: CN202010277479.9[P]. 2021-07-23 (in Chinese). |
| [54] |
廖祥儒, 翟李欣, 赖英杰, 杨邵岚, 蔡宇杰, 管政兵. 一种来自短小芽孢杆菌的ω-转氨酶及在生物胺化中的应用: CN201811219769.7[P]. 2020-11-06. LIAO XR, ZHAI LX, LAI YJ, YANG SL, CAI YJ, GUAN ZB. ω-aminotransferase from Bacillus pumilus and application thereof in biological amination: CN201811219769.7[P]. 2020-11-06 (in Chinese). |
| [55] |
王华磊, 谢有余, 王继国, 范海洋, 魏东芝. 一种S型的ω-转氨酶ATA-W12及其基因和应用: CN201611055835.2[P]. 2019-06-07. WANG HL, XIE YY, WANG JG, FAN HY, WEI DZ. A S-type of ω-aminotransferase ATA-W12 and gene and application thereof: CN201611055835.2[P]. 2019-06-07 (in Chinese). |
| [56] |
王继国, 谢有余, 王华磊, 魏东芝. 一种新型ω-转氨酶的工业适应性选择. 生物工程学报, 2020, 36(9): 1929-1938. WANG JG, XIE YY, WANG HL, WEI DZ. Industrial adaptability selection for a novel ω-transaminase. Chinese Journal of Biotechnology, 2020, 36(9): 1929-1938 (in Chinese). |
| [57] |
罗玮, 胡佳桂. 催化长侧链芳香族胺与2-酮丁酸合成L-2-氨基丁酸的方法: CN202110149981.6[P]. 2021-04-20. LUO W, HU JG. Method for synthesizing L-2-aminobutyric acid by catalyzing long-side-chain aromatic amine and 2-ketobutyric acid: CN202110149981.6[P]. 2021-04-20 (in Chinese). |
| [58] |
高新星, 韦平和. ω-转氨酶分子改造研究进展. 生物工程学报, 2018, 34(7): 1057-1068. GAO XX, WEI HP. Advances in the molecular modification of ω-transaminase. Chinese Journal of Biotechnology, 2018, 34(7): 1057-1068 (in Chinese). |
| [59] |
陶荣盛, 朱傅赟, 沈青, 孙梁栋, 沈正权, 蒋宇, 杨晟. 用于生产L-2-氨基丁酸的转氨酶: CN201510900727. X[P]. 2018-07-31. TAO RS, ZHU FB, SHEN Q, SUN LD, SHEN ZQ, JIANG Y, YANG S. Transaminase for the production of L-2-aminobutyric acid: CN201510900727. X[P]. 2018-07-31 (in Chinese). |
| [60] |
傅荣昭, 谢志军, 宋鹏. 采用酶突变技术制备药物中间体(R)-2-(氨乙基)-4-氯苯酚的方法: CN202010939533.1[P]. 2020-11-27. FU RZ, XIE ZJ, SONG P. Method for preparing drug intermediate (R)-2-(aminoethyl)-4-chlorophenol by using enzyme mutation technology: CN202010939533.1[P]. 2020-11-27 (in Chinese). |
| [61] |
马立新, 王亚平, 翟超, 张志威, 刘洋, 李霞. 一种提高L-2-氨基丁酸合成速率的方法: CN202210050424.3[P]. 2022-05-27. MA LX, WANG YP, ZHAI C, ZHANG ZW, LIU Y, LI X. Method for improving synthesis rate of L-2-aminobutyric acid: CN202210050424.3[P]. 2022-05-27 (in Chinese). |
| [62] |
王继国, 王华磊, 刘清海, 魏东芝. 一种S型ω-转氨酶高活性突变体: CN202010072818. X[P]. 2021-08-06. WANG JG, WANG HL, LIU QH, WEI DZ. S-type ω-transaminase high-activity mutant: CN202010072818. X[P]. 2021-08-06 (in Chinese). |
| [63] |
钱武, 宋申超, 赖群萍, 徐诗瑶, 陈广军, 洪黎鹏, 盛力, 沈大冬, 吴国锋. 手性β-氨基酸衍生物的制备方法: CN202011331904.4[P]. 2022-05-27. QIAN W, SONG SC, LAI QP, XU SY, CHEN GJ, HONG LP, SHENG L, SHEN DD, WU GF. A process for the preparation of chiral β-amino acid derivatives: CN202011331904.4[P]. 2022-05-27 (in Chinese). |
| [64] |
柳志强, 程峰, 陈秀玲, 张晓健, 郑裕国, 何人宝, 金逸中, 林娇华. ω-转氨酶突变体及其在制备西他列汀中间体中的应用: CN201910800438.0[P]. 2021-04-30. LIU ZQ, CHENG F, CHEN XL, ZHANG XJ, ZHENG YG, HE RB, JIN YZ, LIN JH. ω-aminotransferase mutant and application thereof in preparation of sitagliptin intermediate: CN201910800438.0[P]. 2021-04-30 (in Chinese). |
| [65] |
李涛. 一种转氨酶法合成(R)-N-BOC-3-氨基-4-(2, 4, 5-三氟苯基)丁酸的方法: CN201610314036.6[P]. 2017-11-21. LI T. Method for synthetizing (R)-N-boc-3-amino-4-(2, 4, 5-trifluorophenyl) butyric acid by adopting transaminase method: CN201610314036.6[P]. 2017-11-21 (in Chinese). |
| [66] |
王永, 刘利刚. 一种依格列汀的制备方法: CN201710131603.9[P]. 2017-06-20. WANG Y, LIU LG. Preparation method of evogliptin: CN201710131603.9[P]. 2017-06-20 (in Chinese). |
| [67] |
廖祥儒, 翟李欣, 赖英杰, 谢子豪, 蔡宇杰, 管政兵. 一种可催化西他沙星五元环关键中间体的ω-转氨酶突变体: CN201811449197.1[P]. 2020-08-04. LIAO XR, ZHAI LX, LAI YJ, XIE ZH, CAI YJ, GUAN ZB. ω-aminotransferase mutant capable of catalyzing sitafloxacin five-membered ring key intermediate: CN201811449197.1[P]. 2020-08-04 (in Chinese). |
| [68] |
廖祥儒, 翟李欣, 赖英杰, 殷方荣, 蔡宇杰, 管政兵. 一种能够催化西他沙星五元环中间体的ω-转氨酶突变体: CN201811449434.4[P]. 2020-11-03. LIAO XR, ZHAI LX, LAI YJ, YAN FR, CAI YJ, GUAN ZB. ω-aminotransferase mutant capable of catalyzing sitafloxacin five-membered ring intermediate: CN201811449434.4[P]. 2020-11-03 (in Chinese). |
| [69] |
廖祥儒, 翟李欣, 赖英杰, 任润鲜, 蔡宇杰, 管政兵. 一种可催化西他沙星五元环中间体的ω-转氨酶突变体: CN201811449183. X[P]. 2020-06-09. LIAO XR, ZHAI LX, LAI YJ, REN RX, CAI YJ, GUAN ZB. ω-aminotransferase mutant capable of catalyzing sitafloxacin five-membered ring intermediate: CN201811449183. X[P]. 2020-06-09 (in Chinese). |
| [70] |
廖祥儒, 翟李欣, 赖英杰, 殷方荣, 蔡宇杰, 管政兵. 一种能催化西他沙星五元环关键中间体的ω-转氨酶突变体: CN201811449438.2[P]. 2020-06-09. LIAO XR, ZHAI LX, LAI YJ, YAN FR, CAI YJ, GUAN ZB. ω-aminotransferase mutant capable of catalyzing sitafloxacin five-membered ring key intermediate: CN201811449438.2[P]. 2020-06-09 (in Chinese). |
| [71] |
林义, 洪华斌, 颜剑波, 王志华. 一种3-氨基吡咯烷化合物及其合成方法和用途: CN201410418987.9[P]. 2017-02-01. LIN Y, HONG HB, YAN JB, WANG ZH. 3-aminopyrrolidine compounds, and synthetic method and uses thereof: CN201410418987.9[P]. 2017-02-01 (in Chinese). |
| [72] |
丰亚辉, 陈明洪, 王仲清, 刘彬, 罗忠华, 黄芳芳. 固定化转氨酶及其应用: CN201910076744.4[P]. 2019-08-16. FENG YH, CHEN MH, WANG ZQ, LIU B, LUO ZH, HUANG FF. Immobilized aminotransferase and application thereof: CN201910076744.4[P]. 2019-08-16 (in Chinese). |
| [73] |
丰亚辉, 孙国栋, 陈明洪, 赖金强, 林伟, 罗忠华, 王仲清. 制备贝西沙星中间体化合物的方法: CN201610616114.8[P]. 2020-02-11. FENG YH, SUN GD, CHEN MH, LAI JQ, LIN W, LUO ZH, WANG ZQ. Method for preparing besifloxacin intermediate compound: CN201610616114.8[P]. 2020-02-11 (in Chinese). |
| [74] |
洪浩, 詹姆斯·盖吉, 卢江平, 刘芳, 张娜, 刘冶, 王祖建. 一种手性氨基杂环化合物及其衍生物的制备方法: CN201610935777.6[P]. 2021-01-22. HONG H, JAMES G, LU JP, LIU F, ZHANG N, LIU Z, WANG ZJ. Preparation method of chiral aminoheterocyclic compound and derivative thereof: CN201610935777.6[P]. 2021-01-22 (in Chinese). |
| [75] |
洪浩, 詹姆斯·盖吉, 卢江平, 刘芳, 张娜, 刘冶, 王祖建. 一种手性氨基杂环化合物及其衍生物的制备方法: CN202010233521.7[P]. 2020-06-30. HONG H, JAMES G, LU JP, LIU F, ZHANG N, LIU Z, WANG ZJ. Preparation method of chiral aminoheterocyclic compound and derivative thereof: CN202010233521.7[P]. 2020-06-30 (in Chinese). |
| [76] |
王仲清, 孙国栋, 胡本全, 罗忠华, 黄芳芳. 一种哌啶胺的制备方法: CN201911146743.9[P]. 2021-05-21. WANG ZQ, SUN GD, HU BQ, LUO ZH, HUANG FF. Preparation method of piperidylamine: CN201911146743.9[P]. 2021-05-21 (in Chinese). |
| [77] |
孙国栋, 陈磊, 韩小东, 李顺, 曾洁滨, 王仲清, 罗忠华. 一种沙库必曲的中间体及其制备方法: CN201710014972. X[P]. 2021-03-26. SUN GD, CHEN L, HAN XD, LI S, ZENG JB, WANG ZQ, LUO ZH. Sacubitril intermediate and preparation method thereof: CN201710014972. X[P]. 2021-03-26 (in Chinese). |
| [78] |
张一平, 吴怡华. 一种沙库巴曲缬沙坦钠LCZ696的合成方法: CN201910595000.3[P]. 2021-01-05. ZHANG YP, WU YH. Synthesis method of sacubitril valsartan sodium LCZ696: CN201910595000.3[P]. 2021-01-05 (in Chinese). |
| [79] |
陈磊, 孙国栋, 韩小东, 李顺, 曾洁滨, 王仲清, 罗忠华. 一种沙库必曲的中间体及其制备方法: CN201780013500.0[P]. 2018-12-21. CHEN L, SUN GD, HAN XD, LI S, ZENG JB, WANG ZQ, LUO ZH. Sacubitril intermediate and preparation method thereof: CN201780013500.0[P]. 2018-12-21 (in Chinese). |
| [80] |
陈剑戈, 顾志锋. 一种Avacopan及其中间体的制备方法: CN202111296132. X[P]. 2022-01-21. CHEN JG, GU ZF. Preparation method of Avopan and intermediate thereof: CN202111296132. X[P]. 2022-01-21 (in Chinese). |
| [81] |
黄俊, 刘春燕, 梅乐和, 吕常江, 王宏鹏, 于林凯, 胡升, 赵伟睿, 蒋成君. (R)-ω-转氨酶突变体的新应用: CN201911215847.0[P]. 2020-04-07. HUANG J, LIU CY, MEI LH, LÜ CJ, WANG HP, YU LK, HU S, ZHAO WR, JIANG CJ. New application of (R)-ω-transaminase mutant: CN201911215847.0[P]. 2020-04-07 (in Chinese). |
| [82] |
杨立荣, 张涛, 周海胜, 张红玉, 吴坚平. 转氨酶及其突变体在制备(S)-1-甲氧基-2-丙胺中的应用: CN202111259352.5[P]. 2022-03-04. YANG LR, ZHANG T, ZHOU HS, ZHANG HY, WU JP. Application of transaminase and mutant thereof in preparation of (S)-1-methoxy-2-propylamine: CN202111259352.5[P]. 2022-03-04 (in Chinese). |
| [83] |
王华磊, 魏东芝, 谢有余. 一种ω转氨酶及其突变体、重组质粒、基因工程菌及其应用: CN202011346097.3[P]. 2021-03-12. WANG HL, WEI DZ, XIE YY. ω-transaminase as well as mutant, recombinant plasmid, genetically engineered bacterium and application thereof: CN202011346097.3[P]. 2021-03-12 (in Chinese). |
| [84] |
陈剑戈, 李斌峰, 杨进. (R)-2-(1-氨基乙基)-4-氟苯胺的合成方法: CN201710593645.4[P]. 2021-08-06. CHEN JG, LI BF, YANG J. Synthesis method of (R)-2-(1-aminoethyl)-4-fluoroaniline: CN201710593645.4[P]. 2021-08-06 (in Chinese). |
| [85] |
陈可泉, 魏国光, 张阿磊, 周宁, 欧阳平凯. 一种利用N-乙酰氨基葡萄糖制备3-氨基-5-(α-氨基乙基)四氢呋喃的方法: CN201910145307.3[P]. 2019-05-31. CHEN KQ, WEI GG, ZHANG AL, ZHOU N, OUYANG PK. Method for preparing 3-amino-5-(α-aminoethyl) tetrahydrofuran by using N-acetylglucosamine: CN201910145307.3[P]. 2019-05-31 (in Chinese). |
| [86] |
黄俊, 蒋成君, 程桂林, 楼坚. 一种ω-转氨酶突变体基因及其应用: CN201510171434.2[P]. 2015-09-09. HUANG J, JIANG CJ, CHENG GL, LOU J. ω-aminotransferase mutant gene and application thereof: CN201510171434.2[P]. 2015-09-09 (in Chinese). |
| [87] |
陈剑戈, 李斌峰, 顾志锋. 一种(R)-N1, N1-二乙基-1, 4-戊二胺的制备方法: CN201910974632.0[P]. 2021-02-26. CHEN JG, LI BF, GU ZF. Preparation method of (R)-N1, N1-diethyl-1, 4-pentanediamine: CN201910974632.0[P]. 2021-02-26 (in Chinese). |
| [88] |
杨立荣, 王子渊, 周海胜, 张红玉, 许金玲, 吴坚平. 一种ω-转氨酶的应用及生物酶法去消旋化制备L-草铵膦的方法: CN202011569978.1[P]. 2021-03-26. YANG LR, WANG ZY, ZHOU HS, ZHANG HY, XU JL, WU JP. Application of ω-transaminase and method for preparing L-glufosinate-ammonium through deracemization by biological enzyme process: CN202011569978.1[P]. 2021-03-26 (in Chinese). |
| [89] |
陶荣盛, 王博, 沈青, 朱傅赟, 孙梁栋, 沈正权, 郑云, 潘震华, 刘萍, 王亚夫. R-3-氨基正丁醇的酶法生产工艺: CN201810313800.7[P]. 2021-06-01. TAO RS, WANG B, SHEN Q, ZHU FB, SUN LD, SHEN ZQ, ZHENG Y, PAN ZH, LIU P, WANG YF. Enzymatic production process of R-3-amino-n-butanol: CN201810313800.7[P]. 2021-06-01 (in Chinese). |
| [90] |
饶志明, 刘松, 高仁杰, 张显, 杨套伟, 徐美娟. 一种利用全细胞转化生产1, 2-氨基醇类化合物的方法: CN201911038853.3[P]. 2020-01-21. RAO ZM, LIU S, GAO RJ, ZHANG X, YANG TW, XU MJ. Method for producing 1, 2-alkamine compound by utilizing whole-cell transformation: CN201911038853.3[P]. 2020-01-21 (in Chinese). |
| [91] |
董红军, 李梁坡, 周海川, 谢永辉. 一种高丝氨酸和苏氨酸生物合成途径的构建方法及应用: CN202111518422.4[P]. 2022-03-01. DONG HJ, LI LP, ZHOU HC, XIE YH. The invention discloses a construction method and application of a homoserine and threonine biosynthetic pathway: CN202111518422.4[P]. 2022-03-01 (in Chinese). |
| [92] |
欧志敏, 卢媛, 李景华, 程朋朋, 王金美, 张楚玥. 转氨酶与乙醇脱氢酶偶联合成(R)-1-[3, 5-双(三氟甲基)苯基]乙胺的方法: CN202111485627.7[P]. 2022-05-10. OU ZM, LU Y, LI JH, CHENG PP, WANG JM, ZHANG CY. Method for synthesizing (R)-1-[3, 5-bis(trifluoromethyl)phenyl]ethylamine by coupling transaminase and ethanol dehydrogenase: CN202111485627.7[P]. 2022-05-10 (in Chinese). |
| [93] |
FERRANDI EE, MONTI D. Amine transaminases in chiral amines synthesis: recent advances and challenges. World Journal of Microbiology and Biotechnology, 2017, 34(1): 13.
|
| [94] |
中华人民共和国人力资源社会保障部关于印发国家基本医疗保险、工伤保险和生育保险药品目录(2017年版)的通知[EB/OL]. [2022-10-11]. http://www.mohrss.gov.cn/wap/zc/zcwj/201702/t20170223_266775.html. Notice of the ministry of human resources and social security of People's Republic of China on printing and distributing the national basic medical insurance, work injury insurance and maternity insurance drug catalogue (2017 edition)[EB/OL]. [2022-10-11]. http://www.mohrss.gov.cn/wap/zc/zcwj/201702/t20170223_266775.html (in Chinese). |
| [95] |
SHIN JS, KIM BG. Asymmetric synthesis of chiral amines with ω-transaminase. Biotechnology and Bioengineering, 1999, 65(2): 206-211. DOI:10.1002/(SICI)1097-0290(19991020)65:2<206::AID-BIT11>3.0.CO;2-9
|
| [96] |
HÖHNE M, KUHL S, ROBINS K, BORNSCHEUER UT. Efficient asymmetric synthesis of chiral amines by combining transaminase and pyruvate decarboxylase. Chembiochem, 2008, 9(3): 363-365. DOI:10.1002/cbic.200700601
|
| [97] |
KOSZELEWSKI D, LAVANDERA I, CLAY D, GUEBITZ GM, ROZZELL D, KROUTIL W. Formal asymmetric biocatalytic reductive amination. Angewandte Chemie-international Edition, 2008, 47(48): 9337-9340. DOI:10.1002/anie.200803763
|
| [98] |
CASSIMJEE KE, BRANNEBY C, ABEDI V, WELLS A, BERGLUND P. Transaminations with isopropyl amine: equilibrium displacement with yeast alcohol dehydrogenase coupled to in situ cofactor regeneration. Chemical Communications (Cambridge), 2010, 46(30): 5569-5571. DOI:10.1039/c0cc00050g
|
| [99] |
宋浩, 赵妍淑, 张金华. 一种提高手性胺转化率的方法: CN202010209530.2[P]. 2020-07-28. SONG H, ZHAO YS, ZHANG JH. The invention relates to a method for improving the conversion rate of chiral amine: CN202010209530.2[P]. 2020-07-28 (in Chinese). |
| [100] |
魏东芝, 王华磊, 汪湘湘. 一种填充床连续流不对称合成(S)-1-Boc-3-氨基哌啶的方法: CN202010659240.8[P]. 2020-09-11. WEI DZ, WANG HL, WANG XX. Method of packed bed to asymmetrically synthesize (S)-1-boc-3-aminopiperidine through continuous flow: CN202010659240.8[P]. 2020-09-11 (in Chinese). |
| [101] |
叶鹏, 祝黛莲. 一种有序定向共固定的酶膜反应器及其制备方法和应用: CN201910618133.8[P]. 2019-12-06. YE P, ZHU DL. Orderly, directional and co-immobilization enzyme membrane reactor and preparation method and application thereof: CN201910618133.8[P]. 2019-12-06 (in Chinese). |
| [102] |
PAVLIDIS IV, WEISS MS, GENZ M, SPURR P, HANLON SP, WIRZ B, IDING H, BORNSCHEUER UT. Identification of (S)-selective transaminases for the asymmetric synthesis of bulky chiral amines. Nature Chemistry, 2016, 8(11): 1076-1082. DOI:10.1038/nchem.2578
|
 2023, Vol. 39
2023, Vol. 39




