中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王杭, 侯小雪, 刘鉴峰, 杨翠红
- WANG Hang, HOU Xiaoxue, LIU Jianfeng, YANG Cuihong
- 纳米材料治疗具核梭杆菌促进的结直肠癌研究进展
- Advances on the treatment of Fusobacterium nucleatum-promoted colorectal cancers using nanomaterials
- 生物工程学报, 2023, 39(9): 3670-3680
- Chinese Journal of Biotechnology, 2023, 39(9): 3670-3680
- 10.13345/j.cjb.220811
-
文章历史
- Received: October 8, 2022
- Accepted: March 20, 2023
结直肠癌(colorectal cancer, CRC)是胃肠道中常见的恶性肿瘤,根据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)在2022年发布的数据,CRC发病率已成为仅次于肺癌的全球第二大癌症。已有多个独立研究团队报道具核梭杆菌(Fusobacterium nucleatum, Fn)在CRC肿瘤中特异性富集[1-3],且在结直肠癌发展过程中,Fn的丰度在肿瘤组织中逐渐增加[4],高丰度Fn的结直肠患者预后更差[5]。
Fn是一种革兰氏阴性口腔共生菌,经消化道、血液循环进入肠道[6-7],借助黏附素FadA和Fap2粘附在肠上皮细胞和CRC细胞[8],使其定殖到CRC组织。Fn通过诱导宿主细胞DNA损伤、激活Wnt通路、塑造肿瘤逃逸微环境,以及促进转移等机制影响CRC的发展进程。另外,一项临床前研究使用Fn阳性CRC患者来源的移植瘤模型进行研究,发现甲硝唑治疗可以抑制肿瘤生长[9],证实了杀灭Fn能有效治疗CRC。然而,抗生素的广谱杀菌会导致细菌耐药和肠道菌群失调。纳米材料的引入,不仅可以替代抗生素发挥杀菌作用,还可以极大地改善传统抗生素的易产生耐药和非特异性杀菌等不足。近年来,多个研究利用纳米材料通过杀伤肿瘤部位的Fn治疗CRC,并取得一定进展。基于此,本综述旨在通过对近年来Fn促进结直肠癌的机制研究的整理,着重关注纳米材料应用于Fn介导的CRC治疗的最新研究进展,并对其设计方向和应用前景进行展望。
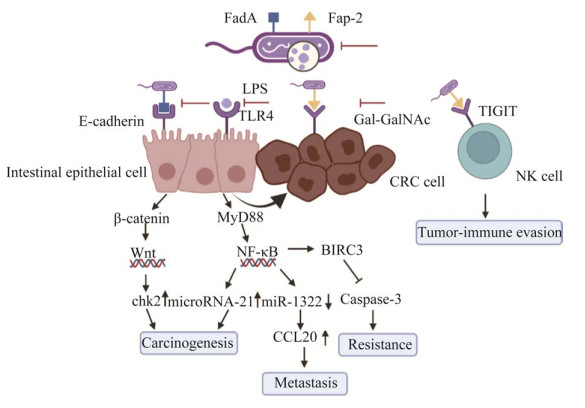
1 具核梭杆菌促进结直肠癌的机制 1.1 具核梭杆菌诱导结直肠癌发生和发展最初Fn被认为存在于口腔中,机会性经消化道入侵肠道,近期发现Fn主要经血液循环选择性定殖CRC[6]。其表面的凝集素如FadA、Fap2和脂多糖(lipopolysaccharide, LPS)等在促癌中发挥重要作用[8]。Fn通过血液循环进入结肠,在压力或疾病条件下产生FadA[10]。FadA与肠上皮细胞表面的E-钙粘蛋白相互作用,激活细胞内β-catenin信号,差异性调节炎症和致癌反应,激活Wnt靶基因[11],导致chk2上调[12],促进结肠癌的发生过程。此外,其表面表达的Fap2能识别并结合结直肠癌细胞高表达的d-半乳糖-β(1−3)-N-乙酰-d-半乳糖胺(d-galactose-β(1−3)-N-acetyl-d-galactosamine, Gal-GalNAc)[8],有利于Fn在CRC的定殖。Fap2还可与NK细胞表面的T细胞免疫球蛋白和免疫受体酪氨酸抑制性基序结构域(T cell immunoreceptor with immnoglobin and immunoreceptor tyrosine-based inhibition motif domain, TIGIT)结合,直接抑制肿瘤浸润性淋巴细胞,从而保护Fn和其附近的肿瘤细胞不被免疫细胞杀死[13]。LPS作为免疫刺激配体可激活宿主细胞的Toll样受体4 (Toll-like receptor 4, TLR4)/髓样分化因子(myeloid differentiation factor 88, MYD88)级联反应和核因子(nuclear factor-κB, Nf-κB)通路,进一步上调microRNA-21的表达,促进癌细胞增殖[14]。同时,TLR4激活引起多种促炎因子如TNF、白介素IL-6、IL-8以及IL-1β等水平的升高而形成促炎肿瘤环境[15]。此外,Fn感染可能引发细胞DNA损伤,直接或间接导致DNA错配修复进而引起表观遗传改变,启动或者促进结直肠癌发生[16]。
1.2 具核梭杆菌促进结直肠癌转移肿瘤转移是一个极其复杂的过程,包括癌细胞从原发肿瘤脱离,进入血液循环,黏附内皮细胞并外渗,到达远端形成转移瘤。Bullman等[9]发现同一Fn菌系同时在人类原发性结肠癌组织和肝转移灶中被检测到,且发生淋巴结转移的CRC患者的Fn丰度显著高于无淋巴结转移者,这表明Fn可能促进了CRC的转移。Fn感染可增加结直肠癌细胞的外泌体分泌,外泌体将miR-1246/92b-3p/27a-3p和CXCL16/RhoA/IL-8从Fn感染的细胞传递到未感染的细胞中,以增强细胞迁移能力并促进肿瘤转移[17]。Xu等[18]发现Fn通过刺激趋化配体因子20 (C–C motif chemokine ligand 20, CCL20)促进巨噬细胞侵润,同时诱导M2巨噬细胞极化;同时,Fn激活NF-κb信号通路,通过降低CRC细胞miR-1322的表达及其与CCL20结合促进CRC转移。细胞间黏附分子-1 (intercellular cell adhesion molecule-1, ICAM1)属于黏附分子中免疫球蛋白超家族中的成员,通过与其特异性受体结合,增强肿瘤细胞、炎症细胞与内皮细胞的黏附,促进内皮细胞活化及肿瘤转移。最近,研究者发现Fn可以通过诱导识别受体阿尔法激酶1 (alpha kinase 1, ALPK1)激活NF-κB通路,上调ICAM1[19]和长链非编码RNA Keratin 7[20]的表达,从而增强CRC细胞与内皮细胞的黏附,促进肿瘤细胞的外渗和转移。
1.3 具核梭杆菌促进结直肠癌耐药临床上CRC的治疗主要使用细胞毒性药物或辅助化疗,包括5-氟尿嘧啶(fluorouracil, 5-FU)、卡培他滨和铂类药物等[21]。大多数晚期结直肠癌患者最初对联合化疗敏感,但最终因耐药而出现癌症复发,导致晚期结直肠癌患者的5年生存率低于10%[22]。具核梭杆菌可促进结直肠癌对奥沙利铂、5-FU、伊立替康和卡培他滨等化疗药物的耐药抗性[9]。从具体分子机制来看,有研究发现Fn通过激活TLR4/MYD88通路,抑制miRNA18a和miRNA4802的表达,这2个microRNA的缺乏让细胞自噬处于“开启”状态,使结直肠癌对化疗产生抵抗[23]。异种移植CRC的小鼠模型中敲低TLR4/MYD88可以改善Fn诱导的CRC化疗抵抗,肿瘤体积显著减少。另有研究表明,杆状病毒IAP重复包含蛋白3 (baculoviral IAP repeat containing 3, BIRC3)作为凋亡抑制蛋白家族的成员,它通过直接抑制caspase级联反应来抑制细胞凋亡,导致CRC的化疗抵抗[24]。Karasawa等[25]研究发现,Fn感染能明显促进CRC荷瘤小鼠对5-Fu的耐药,而BIRC3基因沉默能够显著增加Fn感染CRC荷瘤小鼠对5-Fu的敏感性。
综上所述,如图 1所示,具核梭杆菌对结直肠癌的发生、转移、耐药和免疫微环境调节都发挥了不可忽视的作用。这也提示,对具核梭杆菌进行干预有可能为实现结直肠癌治疗提供新的手段。
|
| 图 1 具核梭杆菌促进CRC发生、转移和耐药并抑制T细胞介导的肿瘤免疫 Fig. 1 Fn promotes the occurrence, metastasis and drug resistance of CRC and inhibits T-cell-mediated immune responses against CRC. Produced on BioRender. |
| |
Bullman等[9]发现使用甲硝唑治疗Fn阳性患者来源的异种移植肿瘤小鼠可降低Fn载量,同时抑制癌细胞增殖和肿瘤生长。这表明通过抗生素干预Fn可以作为CRC患者的潜在治疗方法。研究者发现,抗炎药阿司匹林对Fn具有抗生素活性,可以有效地杀死生长期和静止期的Fn。1 mmol/L阿司匹林可以下调Fn组织定位因子Fap2和FadA的基因表达以达到抑制CRC的目的[26]。一项Meta分析认为定期服用阿司匹林可降低结直肠癌(RR=0.85, 95% CI: 0.78–0.92)发生率[27]。但有研究进一步发现,不同株系的Fn对阿司匹林的敏感性不同,甚至已有耐药株产生。与此同时,有研究者在感染Fn的乳腺癌小鼠中使用甲硝唑治疗,甲硝唑抑制了乳房肿瘤的发展和转移进展[28],再次验证了使用抗生素干预Fn治疗肿瘤的可能性。但在临床大量应用抗生素治疗Fn阳性CRC病例可能会造成患者菌群失调[29],并引发癌症相关的生物失调和炎症进而降低治疗效果。而且,Fn位于CRC深部也限制了抗生素对Fn的杀伤作用。因此,除了抗生素治疗外,亟需开发新的Fn介导的CRC疗法。
纳米材料是由基本构建单元在物理、化学或者生物刺激下组装形成的大小在纳米尺度的材料,具有易于结构和功能修饰、微观形貌多样以及独特的纳米效应等优势[30]。纳米材料的引入,有可能改善抗生素治疗Fn感染的不足以及通过其功能模块设计干扰Fn与结直肠癌细胞的相互作用,进而实现Fn介导的结直肠癌高效治疗。
2.1 纳米材料直接杀伤具核梭杆菌治疗结直肠癌 2.1.1 纳米银离子杀伤具核梭杆菌治疗结直肠癌由于具核梭杆菌与结直肠癌存在共生关系,通过纳米材料杀伤具核梭杆菌是间接治疗结直肠癌的一个重要思路。Fn是革兰氏阴性专性厌氧菌,在生物膜(特别是软组织)中黏附能力强,极易扩散,且Fn已逐渐获得耐药性,这使得Fn的治疗面临着重大挑战。银离子是一种广泛使用的抗菌剂,银离子纳米化能够使其具有显著的表面效应、量子尺寸效应,且纳米银不易产生耐药、易于进行结构修饰赋予其靶向性等特性,显著改善了银离子的抗菌性能[31]。目前有研究利用纳米银离子杀伤Fn,进而达到治疗结直肠癌的目的。Abbas等[32]的研究发现,将银离子通过简单还原法制备成直径为10 nm的纳米银(NanoSilver-IMTA),NanoSilver-IMTA能够剂量依赖性地抑制Fn的增殖。在纳米银的基础上,有研究者将小尺寸纳米银设计成团簇,显著提高了纳米银的杀菌能力。Haidari等[33]设计了高单分散、超小尺寸(< 3 nm)的聚阳离子银纳米团簇(polysliver nanoparticles, pAgNCs),对Fn的最低抑菌浓度(minimum inhibitory concentration, MIC)由超小尺寸纳米银的25 μg/mL降低为3.375 μg/mL,最低杀菌浓度(minimum bactericidal concentratio, MBC)由50 μg/mL降低为6.75 μg/mL。值得注意的是,与独立的纳米银颗粒或常规抗生素相比,pAgNCs显示出显著延迟细菌耐药性发展的能力。
虽然纳米银由于其独特的物理、化学、光学和催化性能被广泛地应用在医疗领域并取得了不错的治疗疗效,但也有研究者发现纳米银在人体多个系统,如呼吸系统、免疫系统和生殖系统等,均存在潜在的细胞毒性[34]。因此,通过深入研究纳米银的潜在细胞毒性机理可进一步改进纳米银材料的生物相容性,这将是发挥纳米银介导的具核梭杆菌相关结直肠癌治疗的一个重要研究方向。
2.1.2 阳离子化合物杀伤具核梭杆菌治疗结直肠癌阳离子化合物通过静电作用与细菌表面带负电荷的蛋白质、多糖结合而破坏细菌细胞膜,具有广谱杀菌性能。目前常用的阳离子化合物有天然阳离子抗菌聚合物、季铵盐聚合物、N-卤代胺类聚合物等,但是用来杀伤具核梭杆菌进而实现结直肠癌治疗的阳离子化合物很少被报道。季铵盐聚合物材料表现出优异的广谱抗菌活性,但其不可忽视的细胞毒性和低选择性限制其在生物医学领域的应用。柱芳烃是由对苯二酚或对苯二酚醚通过亚甲基在苯环的对位连接而成的一类环状低聚物,具有独特的主-客体识别能力、合适的空腔尺寸以识别并包载客体分子。柱[5]芳烃(carboxylatopillar[5]arene, CP[5]A)是该家族最稳定的化合物,在肿瘤微环境的特定条件下能释放季铵盐,提高季铵盐聚合物材料的生物相容性。Liu等[35]设计了由4-(4-异硫氰基苯偶氮)-N, N-二甲基苯胺(AZO)-共轭聚酰胺-胺型树枝状高分子[4-(4-isothio-cyanatophenylazo)-N, N-dimethylaniline, PAMAM-AZO]自组装纳米球,并在纳米球外修饰CP[5]A,形成的PAMAM-AZO @CP[5]A(Q-P-A@CP[5]A)用于抗菌和抗结直肠癌治疗。纳米球在肿瘤微环境的酸性响应解聚为单体,而后偶氮还原酶响应纳米形态恢复为正电荷状态,通过损伤细胞膜治疗结直肠癌。此外,该材料利用季铵盐杀灭Fn,减少了Fn诱导的奥沙利铂的化学抵抗,纳米材料组肿瘤体积明显小于奥沙利铂组,表现出良好的抗癌作用。而且相较于奥沙利铂组小鼠体重下降近10 g,纳米材料组小鼠体重上升近5 g,表现出良好的生物相容性。
该纳米材料利用实体肿瘤部位过表达的偶氮还原酶,设计了酶响应的纳米材料形貌变化实现被动靶向杀伤肿瘤,同时精准杀伤有害细菌Fn。为毒性较高的阳离子抑菌剂提供了一个减少对正常组织的潜在毒性的新方向。
2.1.3 天然脂肪酸杀伤具核梭杆菌治疗结直肠癌月桂酸(lautic aid, LA)是一种天然脂肪酸,通过改变敏感菌株细胞壁的通透性,引起细菌胞内部分蛋白、离子外泄达到抑菌效果。Yan等[36]通过将LA、奥沙利铂前药(OxPt-COOH)和超支化聚缩水甘油(polyglycidol, PG)结合,随后加入葫芦[7]脲(CB[7])引发超分子组装从而构建了超分子纳米药物(PG-Pt-LA/CB[7])。通过纳米材料的增强滞留(enhanced permeability and retention effect, EPR)效应,CRC高表达的精胺竞争性取代超分子PG-PT-LA/CB[7]中PG-Pt-LA, 释放出的奥沙利铂在高表达的谷胱甘肽中激活为Pt(Ⅱ)以产生细胞毒性。同时纳米颗粒缓慢释放LA,有效杀伤肿瘤组织中的Fn,可使Fn诱导的NF-κB、IL-6表达降低,且抑制自噬体和自溶酶体的积累,解除Fn诱导CRC对Pt(Ⅱ)的耐药。
基于结直肠癌肿瘤微环境高表达的精胺和谷胱甘肽及低pH的特点,设计的多重响应的超分子纳米材料PG-Pt-LA/CB[7]在肿瘤中表现出最高的积累量,其24 h累积量是游离奥沙利铂的4倍,明显改善了肿瘤蓄积,从而降低奥沙利铂对正常组织的潜在毒性。同时,通过消除Fn和抑制自噬,可大幅提高化疗耐药CRC的化疗疗效。
2.1.4 具核梭杆菌靶向纳米材料治疗结直肠癌以上纳米材料取得一定效果,但在给药过程中不具有主动靶向性,对周围的细胞、组织甚至器官造成损伤。理想的治疗是仅给药到结直肠肿瘤组织,不影响周围组织。因此,研究者们基于Fn在CRC富集的特点设计了选择性靶向Fn治疗CRC的纳米材料。
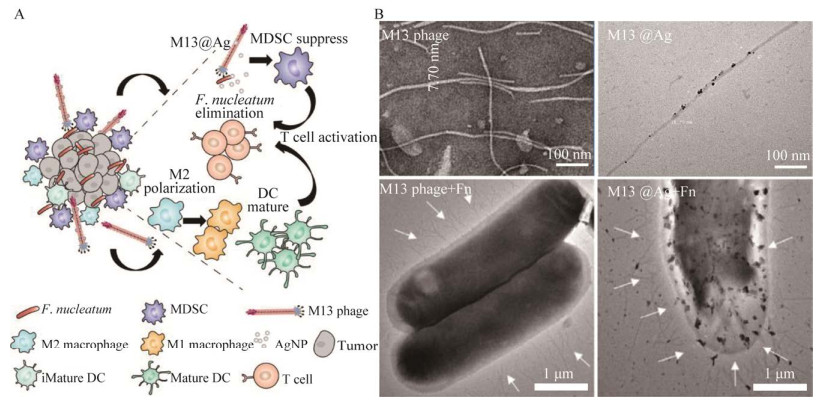
噬菌体是侵袭细菌的病毒,与抗菌药物相比更能对特定菌株进行靶向治疗并具有溶菌活性。Zhang等[37]从人唾液中分离出能特异性消灭Fn的噬菌体,通过叠氮化修饰形成噬菌体A,共价连接负载伊立替康的葡聚糖纳米颗粒,构建了基于噬菌体介导的靶向纳米材料。利用噬菌体特异性裂解具核梭杆菌。同时,纳米系统中的右旋糖苷促进有益菌丁酸梭菌的增殖,抑制结直肠癌生长并通过产生短链脂肪酸诱导抗肿瘤免疫应答。此外,释放出包裹在葡聚糖纳米颗粒中的伊立替康,达到靶向化疗目的。对原位结直肠癌小鼠进行口服或静脉给药,显著增加了结直肠癌的治疗效果。Dong等[38]进一步通过噬菌体展示技术体外筛选了专一结合Fn的M13噬菌体菌株,并将纳米银离子与噬菌体通过静电作用自组装构建负载纳米银粒子的噬菌体(M13@Ag),M13@Ag可选择性清除Fn并逆转Fn诱导的免疫抑制微环境(图 2)。Fn在小鼠肠道内定殖24 h后,M13@Ag处理组肿瘤体积明显缩小。M13@Ag联合α-PD1或FOLFIRI (伊立替康、亚叶酸钙、5-FU联合治疗)治疗有更好的抑瘤效果和更长的生存时间。
|
| 图 2 噬菌体/纳米银混合体系(M13@Ag)的微观形貌和用于Fn介导的CRC免疫治疗的示意图[38] Fig. 2 Schematic illustration of phage/nano-Ag hybrid system (M13@Ag) for Fn-based CRC immune therapy and its micromorphology[38]. A:作用机制示意图. B:M13噬菌体以及负载纳米银的M13噬菌体(M13@Ag)的扫描电子显微镜图及其与Fn相互作用的扫描电子显微镜图 A: Mechanism schematic illustration for CRC therapy. B: Transmission electron microscope images of M13 phages, M13@Ag and their interactions with Fn. The filamentous M13 phages were indicated with white arrows. |
| |
纳米材料可以通过干扰有害的微生物-癌细胞相互作用而作为新的癌症治疗方式。Fn通过表面膜蛋白Fap2、FadA定殖CRC,并激活下游信号促进肿瘤组织的启动、发展和转移。此外,细菌侵入人体后释放其表面的LPS,LPS是CRC发生和发展中发挥重要作用的免疫刺激配体,可激活原位肿瘤下游效应因子(如pNF-κB、p65、COX-2、p-STAT3等)以及刺激炎性因子(如IL-1β,IL-6等)[39]。Song等[40]设计了一种工程化的LPS靶向融合蛋白,将其编码序列添加在脂质-鱼精蛋白-DNA (lipid-protamine-DNA, LPD)纳米粒子系统中,用于选择性表达LPS捕获蛋白,阻断LPS介导的信号通路。这种纳米蛋白捕获系统有效缓解了Fn在内的革兰氏阴性杆菌分泌的LPS所致的肿瘤免疫抑制微环境,CD8+和CD4+ T细胞以及MHCII+和CD86+树突状细胞比例显著增加,而MDSCs显著减少,促进了抗PD-L1单抗对CRC的治疗,甚至减少了CRC肝转移。与PD-L1的联合治疗显示出良好的肿瘤生长抑制效果,与单独的抗PD-L1疗法或单独的LPS陷阱疗法相比,联合疗法延长了荷瘤小鼠的存活时间。肝脏是CRC的主要转移部位,肝转移也是CRC相关死亡的一个重要原因。在这个研究中,LPS捕获和联合治疗组的血清天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平正常,表明LPS捕获治疗不仅可以促进原发性CRC的免疫治疗,也可以减少肝转移的发生。
最近,卢森堡大学的研究者发现,Fn不仅直接与结直肠癌细胞发生相互作用并促进癌症的发生,还能通过其小分子代谢产物甲酸盐触发AhR信号转导驱动CRC的侵袭、转移,同时增加肿瘤干性[41]。捕获或中和甲酸盐的纳米材料用于具核梭杆菌阳性肿瘤和(或)甲酸盐水平升高的患者可能成为一种潜在的新的癌症治疗方向。
3 结语自从2012年Kostic等[9]首次报道了临床样本中Fn在CRC中异常富集以来,Fn与CRC相关性研究的数量在逐年增加,Fn与CRC的发生、发展以及转移和耐药逐渐被报道,但在这一过程中,Fn发挥作用的具体机制尚没有完全确定。随着研究的深入,未来有望揭示Fn在CRC发生、发展以及转移和耐药的具体作用机理,并将这些发现服务于Fn介导的CRC的诊疗中。虽然目前关于纳米材料在Fn介导CRC诊疗中的研究比较少,且集中于治疗领域。但是,基于纳米材料的独特的纳米尺度结构及易于进行修饰的优势,它们能够在复杂的微环境(包括微生物组、肿瘤微环境和肿瘤微生物界面的屏障)中靶向递送药物并实现微环境响应的药物释放,并可以方便地实现多模式协同的疾病诊疗。基于本综述所讨论的针对纳米材料在Fn介导的结直肠癌中的研究基础,利用纳米材料实现Fn介导的CRC早期诊断及高效治疗将是一个新的快速发展的领域。
本课题组在利用纳米组装技术构建细菌感染及癌症的精准诊疗药物方面做了大量的工作。如利用靶向结合诱导的细菌表面原位自组装实现了细菌感染的早期灵敏检测和高效治疗[42-43],利用巨噬细胞膜伪装的MOF纳米基因载体实现了小鼠体内脓毒症的高效治疗[44],构建了谷胱甘肽和酯酶双重响应的自组装肽,实现了三阴乳腺癌的高效治疗[45]。因此,具有内在抗菌特性的纳米材料用于减少有害细菌,联合传统的化学治疗,可以作为一种新的CRC治疗策略。纳米材料在具核梭杆菌介导的结直肠癌治疗中可能的发展方向有:(1) 通过纳米修饰进一步提高纳米材料对Fn的特异性杀伤作用,降低纳米银、阳离子化合物等广谱杀菌材料对其他组织的毒副作用,治疗CRC的同时提高生物相容性;(2) 基于Fn表面膜蛋白与CRC的特异性抗体-受体结合(Fap2-Gal-GalNAc、FadA-E-钙粘蛋白)的纳米材料,通过精准阻断二者结合,阻断Fn介导的CRC启动、发展、转移和耐药;(3) 捕获细菌产物(LPS、甲酸盐)或抑制细菌产物引发的下游信号的纳米材料,提高耐药CRC的治疗效果和降低肿瘤转移;(4) 基于Fn自然分泌的外膜囊泡的靶向修饰及纳米化设计以及根据FadA和Fap2等蛋白的模拟肽设计纳米免疫活化剂,为健康人群提供保护。因此,笔者认为通过精准分子结构设计和灵活的纳米组装技术,纳米材料在Fn介导的结直肠癌治疗中将发挥更大的作用。
| [1] |
BRENNAN CA, GARRETT WS. Gut microbiota, inflammation, and colorectal cancer. Annual Review of Microbiology, 2016, 70: 395-411. DOI:10.1146/annurev-micro-102215-095513
|
| [2] |
LI YY, GE QX, CAO J, ZHOU YJ, DU YL, SHEN B, WAN YJ Y, NIE YQ. Association of Fusobacterium nucleatum infection with colorectal cancer in Chinese patients. World Journal of Gastroenterology, 2016, 22(11): 3227. DOI:10.3748/wjg.v22.i11.3227
|
| [3] |
CASTELLARIN M, WARREN RL, DOUGLAS FREEMAN J, DREOLINI L, KRZYWINSKI M, STRAUSS J, BARNES R, WATSON P, ALLEN-VERCOE E, MOORE RA, HOLT RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Research, 2012, 22(2): 299-306. DOI:10.1101/gr.126516.111
|
| [4] |
MIMA K, NISHIHARA R, QIAN ZR, CAO Y, SUKAWA Y, NOWAK JA, YANG JH, DOU RX, MASUGI Y, SONG MY, KOSTIC AD, GIANNAKIS M, BULLMAN S, MILNER DA, BABA H, GIOVANNUCCI EL, GARRAWAY LA, FREEMAN GJ, DRANOFF G, GARRETT WS, et al. Fusobacterium nucleatum in colorectal carcinoma tissue and patient prognosis. Gut, 2016, 65(12): 1973-1980. DOI:10.1136/gutjnl-2015-310101
|
| [5] |
SALVUCCI M, CRAWFORD N, STOTT K, BULLMAN S, LONGLEY DB, PREHN JHM. Patients with mesenchymal tumours and high Fusobacteriales prevalence have worse prognosis in colorectal cancer (CRC). Gut, 2022, 71(8): 1600-1612.
|
| [6] |
ABED J, MAALOUF N, MANSON AL, EARL AM, PARHI L, EMGÅRD JEM, KLUTSTEIN M, TAYEB S, ALMOGY G, ATLAN KA, CHAUSHU S, ISRAELI E, MANDELBOIM O, GARRETT WS, BACHRACH G. Colon cancer-associated Fusobacterium nucleatum may originate from the oral cavity and reach colon tumors via the circulatory system. Frontiers in Cellular and Infection Microbiology, 2020, 10: 400. DOI:10.3389/fcimb.2020.00400
|
| [7] |
COPPENHAGEN-GLAZER S, SOL A, ABED J, NAOR R, ZHANG X, HAN YW, BACHRACH G. Fap2 of Fusobacterium nucleatum is a galactose-inhibitable adhesin involved in coaggregation, cell adhesion, and preterm birth. Infection and Immunity, 2015, 83(3): 1104-1113. DOI:10.1128/IAI.02838-14
|
| [8] |
ABED J, EMGÅRD JEM, ZAMIR G, FAROJA M, ALMOGY G, GRENOV A, SOL A, NAOR R, PIKARSKY E, ATLAN KA, MELLUL A, CHAUSHU S, MANSON AL, EARL AM, OU N, BRENNAN CA, GARRETT WS, BACHRACH G. Fap2 mediates Fusobacterium nucleatum colorectal adenocarcinoma enrichment by binding to tumor-expressed gal-GalNAc. Cell Host & Microbe, 2016, 20(2): 215-225.
|
| [9] |
BULLMAN S, PEDAMALLU CS, SICINSKA E, CLANCY TE, ZHANG X, CAI D, NEUBERG D, HUANG K, GUEVARA F, NELSON T, CHIPASHVILI O, HAGAN T, WALKER M, RAMACHANDRAN A, DIOSDADO B, SERNA G, MULET N, LANDOLFI S, RAMON Y CAJAL S, FASANI R, et al. Analysis of Fusobacterium persistence and antibiotic response in colorectal cancer. Science, 2017, 358(6369): 1443-1448. DOI:10.1126/science.aal5240
|
| [10] |
MENG Q, GAO QQ, MEHRAZARIN S, TANGWANICHGAPONG K, WANG Y, HUANG YM, PAN YT, ROBINSON S, LIU ZW, ZANGIABADI A, LUX R, PAPAPANOU PN, GUO XE, WANG H, BERCHOWITZ LE, HAN YW. Fusobacterium nucleatum secretes amyloid-like FadA to enhance pathogenicity. EMBO Reports, 2021, 22(7): e52891. DOI:10.15252/embr.202152891
|
| [11] |
LI X, HUANG JP, YU TT, FANG XT, LOU LQ, XIN SJ, JI L, JIANG FZ, LOU YL. Fusobacterium nucleatum promotes the progression of colorectal cancer through Cdk5-activated Wnt/β-catenin signaling. Frontiers in Microbiology, 2021, 11: 545251. DOI:10.3389/fmicb.2020.545251
|
| [12] |
GUO P, TIAN ZB, KONG XJ, YANG L, SHAN XZ, DONG BZ, DING XL, JING X, JIANG C, JIANG N, YU YN. FadA promotes DNA damage and progression of Fusobacterium nucleatum-induced colorectal cancer through up-regulation of chk2. Journal of Experimental & Clinical Cancer Research, 2020, 39(1): 202.
|
| [13] |
GUR C, IBRAHIM Y, ISAACSON B, YAMIN R, ABED J, GAMLIEL M, ENK J, BAR-ON Y, STANIETSKY-KAYNAN N, COPPENHAGEN-GLAZER S, SHUSSMAN N, ALMOGY G, CUAPIO A, HOFER E, MEVORACH D, TABIB A, ORTENBERG R, MARKEL G, MIKLIĆ K, JONJIC S, et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack. Immunity, 2015, 42(2): 344-355. DOI:10.1016/j.immuni.2015.01.010
|
| [14] |
YANG YZ, WENG WH, PENG JJ, HONG LM, YANG L, TOIYAMA Y, GAO RY, LIU MF, YIN MM, PAN C, LI H, GUO BM, ZHU QC, WEI Q, MOYER MP, WANG P, CAI SJ, GOEL A, QIN HL, MA YL. Fusobacterium nucleatum increases proliferation of colorectal cancer cells and tumor development in mice by activating Toll-like receptor 4 signaling to nuclear factor–κB, and up-regulating expression of microRNA-21. Gastroenterology, 2017, 152(4): 851-866.e24. DOI:10.1053/j.gastro.2016.11.018
|
| [15] |
SANTAOLALLA R, SUSSMAN DA, RUIZ JR, DAVIES JM, PASTORINI C, ESPAÑA CL, SOTOLONGO J, BURLINGAME O, BEJARANO PA, PHILIP S, AHMED MM, KO J, DIRISINA R, BARRETT TA, SHANG LM, LIRA SA, FUKATA M, ABREU MT. TLR4 activates the β-catenin pathway to cause intestinal neoplasia. PLoS One, 2013, 8(5): e63298. DOI:10.1371/journal.pone.0063298
|
| [16] |
OKITA Y, KOI M, TAKEDA K, ROSS R, MUKHERJEE B, KOEPPE E, STOFFEL EM, GALANKO JA, McCOY AN, KEKU TO, OKUGAWA Y, KITAJIMA T, TOIYAMA Y, MARTENS E, CARETHERS JM. Fusobacterium nucleatum infection correlates with two types of microsatellite alterations in colorectal cancer and triggers DNA damage. Gut Pathogens, 2020, 12(1): 1-5. DOI:10.1186/s13099-019-0341-6
|
| [17] |
GUO S, CHEN J, CHEN F, ZENG Q, LIU WL, ZHANG G. Exosomes derived from Fusobacterium nucleatum-infected colorectal cancer cells facilitate tumour metastasis by selectively carrying miR-1246/92b-3p/27a-3p and CXCL16. Gut, 2021, 70: 1507-1519. DOI:10.1136/gutjnl-2020-321187
|
| [18] |
XU CC, FAN LN, LIN YF, SHEN WY, QI YD, ZHANG Y, CHEN ZH, WANG L, LONG YQ, HOU TY, SI JM, CHEN SJ. Fusobacterium nucleatum promotes colorectal cancer metastasis through miR-1322/CCL20 axis and M2 polarization. Gut Microbes, 2021, 13(1): 1980347. DOI:10.1080/19490976.2021.1980347
|
| [19] |
ZHANG Y, ZHANG L, ZHENG S, LI MJ, XU CC, JIA D, QI YD, HOU TY, WANG L, WANG BY, LI AQ, CHEN SJ, SI JM, ZHUO W. Fusobacterium nucleatum promotes colorectal cancer cells adhesion to endothelial cells and facilitates extravasation and metastasis by inducing ALPK1/NF-κB/ICAM1 axis. Gut Microbes, 2022, 14(1): 2038852. DOI:10.1080/19490976.2022.2038852
|
| [20] |
CHEN SJ, SU TT, ZHANG Y, LEE A, HE JM, GE QW, WANG L, SI JM, ZHUO W, WANG LJ. Fusobacterium nucleatum promotes colorectal cancer metastasis by modulating KRT7-AS/KRT7. Gut Microbes, 2020, 11(3): 511-525. DOI:10.1080/19490976.2019.1695494
|
| [21] |
GAINES S, SHAO C, HYMAN N, ALVERDY JC. Gut microbiome influences on anastomotic leak and recurrence rates following colorectal cancer surgery. British Journal of Surgery, 2018, 105(2): e131-e141. DOI:10.1002/bjs.10760
|
| [22] |
DAHAN L, SADOK A, FORMENTO JL, SEITZ JF, KOVACIC H. Modulation of cellular redox state underlies antagonism between oxaliplatin and cetuximab in human colorectal cancer cell lines. British Journal of Pharmacology, 2009, 158(2): 610-620. DOI:10.1111/j.1476-5381.2009.00341.x
|
| [23] |
YU T, GUO FF, YU YN, SUN TT, MA D, HAN JX, QIAN Y, KRYCZEK I, SUN DF, NAGARSHETH N, CHEN YX, CHEN HY, HONG J, ZOU WP, FANG JY. Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy. Cell, 2017, 170(3): 548-563.e16. DOI:10.1016/j.cell.2017.07.008
|
| [24] |
ZHANG S, YANG YZ, WENG WH, GUO BM, CAI GX, MA YL, CAI SJ. Fusobacterium nucleatum promotes chemoresistance to 5-fluorouracil by upregulation of BIRC3 expression in colorectal cancer. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 1-13.
|
| [25] |
KARASAWA H, MIURA K, FUJIBUCHI W, ISHIDA K, KANEKO N, KINOUCHI M, OKABE M, ANDO T, MURATA Y, SASAKI H, TAKAMI K, YAMAMURA A, SHIBATA C, SASAKI I. Down-regulation of cIAP2 enhances 5-FU sensitivity through the apoptotic pathway in human colon cancer cells. Cancer Science, 2009, 100(5): 903-913. DOI:10.1111/j.1349-7006.2009.01112.x
|
| [26] |
BRENNAN CA, NAKATSU G, GALLINI COMEAU CA, DREW DA, GLICKMAN JN, SCHOEN RE, CHAN AT, GARRETT WS. Aspirin modulation of the colorectal cancer-associated microbe Fusobacterium nucleatum. mBio, 2021, 12(2): e00547-21.
|
| [27] |
WANG LJ, ZHANG RQ, YU LL, XIAO JR, ZHOU X, LI XX, SONG PG, LI X. Aspirin use and common cancer risk: a meta-analysis of cohort studies and randomized controlled trials. Frontiers in Oncology, 2021, 11: 690219. DOI:10.3389/fonc.2021.690219
|
| [28] |
PARHI L, ALON-MAIMON T, SOL A, NEJMAN D, SHHADEH A, FAINSOD-LEVI T, YAJUK O, ISAACSON B, ABED J, MAALOUF N, NISSAN A, SANDBANK J, YEHUDA-SHNAIDMAN E, PONATH F, VOGEL J, MANDELBOIM O, GRANOT Z, STRAUSSMAN R, BACHRACH G. Breast cancer colonization by Fusobacterium nucleatum accelerates tumor growth and metastatic progression. Nature Communications, 2020, 11: 3259. DOI:10.1038/s41467-020-16967-2
|
| [29] |
MIHAI MM, ION A, GIURCĂNEANU C, NIȚIPIR C, POPA AM, CHIFIRIUC MC, POPA MI, ŘÍČAŘ J, POPA LG, SÂRBU I, LAZĂR V. The impact of long-term antibiotic therapy of cutaneous adverse reactions to EGFR inhibitors in colorectal cancer patients. Journal of Clinical Medicine, 2021, 10(15): 3219. DOI:10.3390/jcm10153219
|
| [30] |
WEI GQ, WANG Y, YANG G, WANG Y, JU R. Recent progress in nanomedicine for enhanced cancer chemotherapy. Theranostics, 2021, 11(13): 6370-6392. DOI:10.7150/thno.57828
|
| [31] |
TANG SH, ZHENG J. Antibacterial activity of silver nanoparticles: structural effects. Advanced Healthcare Materials, 2018, 7(13): 1701503. DOI:10.1002/adhm.201701503
|
| [32] |
ABBAS B, AZAD K, ROGHAYEH G. Evaluation of antibacterial properties of nano silver Iranian MTA against Fusobacterium nucleatum. European Journal of Experimental Biology, 2013, 3(6): 88-94.
|
| [33] |
HAIDARI H, BRIGHT R, KOPECKI Z, ZILM PS, GARG S, COWIN AJ, VASILEV K, GOSWAMI N. Polycationic silver nanoclusters comprising nanoreservoirs of Ag+ ions with high antimicrobial and antibiofilm activity. ACS Applied Materials & Interfaces, 2022, 14(1): 390-403.
|
| [34] |
XU L, WANG YY, HUANG J, CHEN CY, WANG ZX, XIE H. Silver nanoparticles: synthesis, medical applications and biosafety. Theranostics, 2020, 10(20): 8996-9031. DOI:10.7150/thno.45413
|
| [35] |
LIU HY, YANG J, YAN XJ, LI CQ, ELSABAHY M, CHEN L, YANG YW, GAO H. A dendritic polyamidoamine supramolecular system composed of pillar[5]arene and azobenzene for targeting drug-resistant colon cancer. Journal of Materials Chemistry B, 2021, 9(46): 9594-9605. DOI:10.1039/D1TB02134F
|
| [36] |
YAN XJ, MA FH, CHEN QX, GOU XB, LI XH, ZHANG LW, GAO H. Construction of size-transformable supramolecular nano-platform against drug-resistant colorectal cancer caused by Fusobacterium nucleatum. Chemical Engineering Journal, 2022, 450: 137605. DOI:10.1016/j.cej.2022.137605
|
| [37] |
ZHENG DW, DONG X, PAN P, CHEN KW, FAN JX, CHENG SX, ZHANG XZ. Phage-guided modulation of the gut microbiota of mouse models of colorectal cancer augments their responses to chemotherapy. Nature Biomedical Engineering, 2019, 3(9): 717-728. DOI:10.1038/s41551-019-0423-2
|
| [38] |
DONG X, PAN P, ZHENG DW, BAO P, ZENG X, ZHANG XZ. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Science Advances, 2020, 6(20): eaba1590. DOI:10.1126/sciadv.aba1590
|
| [39] |
KILLEEN SD, WANG JH, ANDREWS EJ, REDMOND HP. Bacterial endotoxin enhances colorectal cancer cell adhesion and invasion through TLR-4 and NF-κB-dependent activation of the urokinase plasminogen activator system. British Journal of Cancer, 2009, 100(10): 1589-1602. DOI:10.1038/sj.bjc.6604942
|
| [40] |
SONG WT, TIRUTHANI K, WANG Y, SHEN LM, HU MY, DOROSHEVA O, QIU KY, KINGHORN KA, LIU RH, HUANG L. Trapping of lipopolysaccharide to promote immunotherapy against colorectal cancer and attenuate liver metastasis. Advanced Materials, 2018, 30(52): 1805007. DOI:10.1002/adma.201805007
|
| [41] |
TERNES D, TSENKOVA M, POZDEEV VI, MEYERS M, KONCINA E, ATATRI S, SCHMITZ M, KARTA J, SCHMOETTEN M, HEINKEN A, RODRIGUEZ F, DELBROUCK C, GAIGNEAUX A, GINOLHAC A, DAN NGUYEN TT, GRANDMOUGIN L, FRACHET-BOUR A, MARTIN-GALLAUSIAUX C, PACHECO M, NEUBERGER-CASTILLO L, et al. The gut microbial metabolite formate exacerbates colorectal cancer progression. Nature Metabolism, 2022, 4(4): 458-475. DOI:10.1038/s42255-022-00558-0
|
| [42] |
YANG CH, REN CH, ZHOU J, LIU JJ, ZHANG YM, HUANG F, DING D, XU B, LIU JF. Dual fluorescent- and isotopic-labelled self-assembling vancomycin for in vivo imaging of bacterial infections. Angewandte Chemie International Edition, 2017, 56(9): 2356-2360. DOI:10.1002/anie.201610926
|
| [43] |
YANG CH, HU F, ZHANG X, REN CH, HUANG F, LIU JJ, ZHANG YM, YANG LJ, GAO Y, LIU B, LIU JF. Combating bacterial infection by in situ self-assembly of AIEgen-peptide conjugate. Biomaterials, 2020, 244: 119972. DOI:10.1016/j.biomaterials.2020.119972
|
| [44] |
CAO HM, GAO Y, JIA HX, ZHANG LP, LIU JJ, MU GN, GUI H, WANG YB, YANG CH, LIU JF. Macrophage-membrane-camouflaged nonviral gene vectors for the treatment of multidrug-resistant bacterial sepsis. Nano Letters, 2022, 22(19): 7882-7891. DOI:10.1021/acs.nanolett.2c02560
|
| [45] |
WANG ZL, YANG CH, ZHANG H, GAO Y, XIAO M, WANG ZY, YANG LJ, ZHANG JM, REN CH, LIU JF. In situ transformable supramolecular nanomedicine targeted activating hippo pathway for triple-negative breast cancer growth and metastasis inhibition. ACS Nano, 2022, 16(9): 14644-14657. DOI:10.1021/acsnano.2c05263
|
 2023, Vol. 39
2023, Vol. 39




