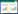中国科学院微生物研究所、中国微生物学会主办
文章信息
- 于双嵘, 钱峰, 章海敏, 孙新强, 王普
- YU Shuangrong, QIAN Feng, ZHANG Haimin, SUN Xinqiang, WANG Pu
- ω-转氨酶定点突变及生物催化制备(S)-1-(2-氟苯基)乙胺
- Site-specific mutation of ω-transaminase and the biocatalytic preparation of (S)-1-(2-fluorophenyl) ethylamine
- 生物工程学报, 2024, 40(3): 821-833
- Chinese Journal of Biotechnology, 2024, 40(3): 821-833
- 10.13345/j.cjb.230478
-
文章历史
- Received: June 30, 2023
- Accepted: November 14, 2023
- Published: December 1, 2023
2. 浙江工业大学 绿色制药技术与装备教育部重点实验室, 浙江 杭州 310014;
3. 浙江昌海制药有限公司, 浙江 绍兴 312000
2. Key Laboratory for Green Pharmaceutical Technologies and Related Equipment of Ministry of Education, Zhejiang University of Technology, Hangzhou 310014, Zhejiang, China;
3. Zhejiang Changhai Pharmaceutical Co., Ltd., Shaoxing 312000, Zhejiang, China
手性胺类化合物是许多小分子药物合成的重要手性砌块,广泛应用于制药和化工领域,在市售药物中有超过90%的药物为胺类或源自胺类中间体,其中约有30%的药物含有手性胺结构[1],如治疗阿尔茨海默病药物卡巴拉汀[2]、治疗帕金森病药物司来吉兰[3]和治疗糖尿病药物西他列汀[4]等。(S)-1-(2-氟苯基)乙胺作为重要的手性胺类砌块,可用于合成抗艾滋病的逆转录酶抑制剂[5]及治疗多种癌症的异柠檬酸脱氢酶1 (isocitrate dehydrogenase 1, IDH1)抑制剂[6]等。
通过亚胺还原或酮还原胺化的化学合成法制备手性胺时通常需使用铑等昂贵的金属催化剂,成本较高且产物中有金属离子残留[7]。利用生物催化法制备手性胺因具有反应条件温和、环境友好、对映体选择性高等优点,近年来备受青睐[4]。有关生物催化合成(S)-1-(2-氟苯基)乙胺还未见报道,有望为其开辟一条新型的生物催化绿色合成路线。已报道的可用于催化合成手性胺的酶包括转氨酶[8]、胺脱氢酶[9]、亚胺还原酶[10]、氨裂解酶[11]、单胺氧化酶[12]和还原胺化酶[13]等。转氨酶属于磷酸吡哆醛(pyridoxal phosphate, PLP)依赖型酶,能催化氨基从合适的供体向羰基受体可逆性转移。根据转化底物类型的不同,转氨酶可分为α-转氨酶和ω-转氨酶,α-转氨酶只能催化α-氨基酸与α-酮酸间的转氨反应,而ω-转氨酶能催化羧酸、酮、醛生成对应的胺,其应用范围更为广泛[14]。
20世纪90年代,Shin等通过富集培养筛选法从土壤中筛选得到具有动力学拆分外消旋α-苯乙胺活性的河流弧菌(Vibrio fluvialis) JS17菌株,并首次将其所含的ω-转氨酶VfTA应用于手性胺的不对称合成[15]。随着基因组测序技术的出现和蛋白质数据库的日益完善,寻找新型ω-转氨酶的策略越来越丰富多样,如氨基酸同源序列搜索法、宏基因组挖掘法等[16]。Kaulmann等[17]利用ω-转氨酶VfTA氨基酸序列为探针,从紫色杆菌(Chromobacterium violaceum) DSM30191的全基因组中挖掘得到一种新型转氨酶CvTA,其与VfTA的序列同源性为38%,且具有ω-转氨酶的保守残基:D259 (与PLP形成氢键)、K288 (催化活性位点)和R416 (与α-羧酸根形成盐桥)。王继国等[18]采用宏基因组挖掘法,从土样中筛选得到ω-转氨酶ATA-W12,其可将500 mmol/L的1-boc-3-哌啶酮几乎完全转化为(S)-(+)-1-boc-3-氨基哌啶。
虽然近年来发现的新型ω-转氨酶种类越来越多,但利用ω-转氨酶催化制备手性胺仍面临诸多问题,如酶的热稳定性不理想[19]、底物谱范围有限[20]、不利的反应平衡[21]等,也在一定程度上限制了ω-转氨酶的工业化应用。
蛋白质工程改造常被用于提高酶的活性、热稳定性和拓宽底物谱。最典型的实例是2010年Savile等[4]对具有(R)选择性的ω-转氨酶ATA-117进行了11轮的定向进化,使酶对西他列汀前体酮的催化活性提高了28 000倍,突变体Rd11能将200 g/L西他列汀前体酮转化为降糖药物西他列汀,产率达92%,对映体过量值(enantiomeric excess, ee) > 99.5%。与化学法相比,利用转氨酶催化提升了产物的产率、减少了副产物形成,且反应过程中不需使用昂贵的过渡金属催化剂。Novick等[22]利用蛋白质工程改造技术实现了治疗心血管疾病的LCZ696活性成分之一的沙库巴曲工业化生产,对具有(S)选择性的ω-转氨酶ATA-217进行11轮定向进化后,酶对沙库巴曲前体酮的催化活性提高了50万倍。曹旭东等[23]通过随机突变和半理性设计结合策略,对节杆菌属(Arthrobacter sp.)来源的ω-转氨酶ArTA进行改造,所得突变体F225M/C281I催化1-萘乙酮合成(R)-1-(1-萘基)乙胺的转化率提高了22%。Xie等[20]对BpTA酶的大结合口袋进行改造,得到的突变体M78F/W82A/I284F/T440Q以kcat/Km计算,其对1-丙烯酮的催化效率提高了470倍以上,且对多种芳基烷基酮的催化活性均有所提高。
为解决转氨酶催化反应中不利的平衡问题,常用的策略有氨基供体过量法、多酶偶联法和提供特殊的氨基供体等。采用异丙胺过量法时,可通过低压挥发去除反应副产物丙酮[24]。Zhang等[25]在催化2-戊酮的反应中引入乳酸脱氢酶/甲酸脱氢酶/甲酸乙酰转移酶(lactate dehydrogenase/formate dehydrogenase/formate acetyltransferase, LDH/FDH/TdcE)体系去除由氨基供体L-丙氨酸生成的副产物丙酮酸,底物转化率达84.5%,产物ee值> 99%。Green等[26]采用新型的氨基供体邻亚二甲苯二胺二盐酸盐,其副产物环亚胺会自发转化为更稳定的芳香族异吲哚并生成黑色沉淀,从而可去除反应体系中的副产物,推动反应平衡向有利的方向进行。
本研究通过同源建模、分子对接和定点突变等手段,对来源于氧化亚铁假古布尔班克氏菌(Pseudogulbenkiania ferrooxidans)的ω-转氨酶PfTA进行半理性设计,以期获得对2-氟苯乙酮具有较高催化活性的突变体,为生物催化制备(S)-1-(2-氟苯基)乙胺提供新型微生物来源的催化剂。
1 材料与方法 1.1 菌株和质粒以来源于Vibrio fluvialis的ω-转氨酶VfTA氨基酸序列为探针,从NCBI数据库中挖掘得到来源于Pseudogulbenkiania ferrooxidans的ω-转氨酶PfTA (GenBank Accession No. WP_008952788.1),其对应的基因序列经密码子优化后,由北京擎科生物科技股份有限公司合成并构建于pET-28a(+)载体上。用于表达PfTA基因的重组大肠杆菌(Escherichia coli) BL21(DE3)/pET-28a(+)-PfTA由本实验室构建并保藏。
1.2 工具酶与试剂PrimeSTAR Max DNA聚合酶购自TaKaRa公司;Dpn Ⅰ购自上海碧云天生物技术有限公司;质粒抽提试剂盒、感受态细胞制备试剂盒和Bradford蛋白浓度测定试剂盒购自生工生物工程(上海)股份有限公司;2-氟苯乙酮购自上海阿拉丁生化科技股份有限公司;(S)-1-(2-氟苯基)乙胺、1-(2-氟苯基)乙胺购自上海皓鸿生物医药科技有限公司;其余试剂均为市售分析纯。
1.3 突变位点的选择和突变文库的建立通过SWISS-MODEL网站(https://swissmodel.expasy.org/)对PfTA进行同源建模,在SAVES网站(https://saves.mbi.ucla.edu/)上对模型进行可靠性评估。使用AutoDockTools软件对PfTA和底物2-氟苯乙酮进行分子对接,用Discovery Studio软件分析对接结果,确定2-氟苯乙酮周围5 Å范围内的氨基酸残基。对这些氨基酸残基进行丙氨酸扫描突变,选取丙氨酸扫描后活性提高的位点进行单点饱和突变,随后将单点突变中活性提高的突变进行叠加突变。
突变文库构建流程:以pET-28a(+)-PfTA质粒作为模板(构建叠加突变体时抽提单点突变体的质粒作为PCR模板),PCR扩增体系为:PrimeSTAR Max DNA聚合酶(2×) 10 μL,模板质粒1 μL,正反向引物(表 1)各0.5 μL,双蒸水8 μL;PCR反应体系为:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸1 min,循环30次;72 ℃终延伸10 min,降温至4 ℃保存。PCR产物经1%琼脂糖凝胶电泳验证条带大小后用Dpn Ⅰ消化模板质粒,用热激法将目标质粒转入E. coli BL21(DE3)感受态细胞中,将感受态细胞涂布于含50 μg/mL卡那霉素的LB平板上培养16 h,挑取较大的单菌落进行测序验证,验证为阳性克隆子后制备甘油管进行保存。
| Primer name | Primer sequence (5′→3′) |
| F22A-F | TGCACCCAGCGACCGACACCGAGAGC |
| F22A-R | GGTGTCGGTCGCTGGGTGCAGATGGTGG |
| L59A-F | GTATGGCAGGTGCGTGGTGCGTTAATATTGG |
| L59A-R | CGCACCACGCACCTGCCATACCATCC |
| W60A-F | GGCAGGTCTGGCGTGCGTTAATATTGGATATGG |
| W60A-R | TAACGCACGCCAGACCTGCCATACCATCC |
| F88A-F | ATAATACCGCGTTTAAAACGACCCACCCGGCGG |
| F88A-R | TGGGTCGTTTTAAACGCGGTATTATAATACGCCAGTTCATCC |
| Y153A-F | GGAATGGCGCGCATGGCAGCACAATTGGG |
| Y153A-R | CTGCCATGCGCGCCATTCCAACGTCCAATCAG |
| M166A-F | TGGGAGGCGCGAGCTATATGCATGAACAGG |
| M166A-R | TATAGCTCGCGCCTCCCAGTGACGCAC |
| Y168A-F | GCATGAGCGCGATGCATGAACAGGGTGATCTG |
| Y168A-R | TTCATGCATCGCGCTCATGCCTCCCAGTGAC |
| K288A-F | CCGCAGCAGCGGGTCTGAGCAGCGG |
| K288A-R | GCTCAGACCCGCTGCTGCGGTAAACAGATCC |
| G319A-F | TAATCATGCGTTTACCTATAGCGGTCATCCGGTTG |
| G319A-R | TAGGTAAACGCATGATTAAAATCACCACCTTCTGCCAG |
| F320A-F | ATCATGGTGCGACCTATAGCGGTCATCCGGTTG |
| F320A-R | GCTATAGGTCGCACCATGATTAAAATCACCACCTTCTGC |
| T321A-F | TGGTTTTGCGTATAGCGGTCATCCGGTTG |
| T321A-R | GACCGCTATACGCAAAACCATGATTAAAATCACCACCTTCT |
| R416A-F | GGCATGAGCCGCATGCATGAACAGGGTGATCTG |
| R416A-R | ATCACCACATGCCGCCATAATCAGATTATGACGAAAAAAAA |
| Y168R-F | GGCATGAGCCGCATGCATGAACAGGGTGATCTG |
| Y168R-R | GTTCATGCATGCGGCTCATGCCTCCCAGTGAC |
| Y168P-F | GGCATGAGCCCGATGCATGAACAGGGTGATCTG |
| Y168P-R | GTTCATGCATCGGGCTCATGCCTCCCAGTGAC |
| R416Q-F | TGATTATGCAGGCATGTGGTGATCATATGGTTGC |
| R416Q-R | ACCACATGCCTGCATAATCAGATTATGACGAAAAAAAATATC |
| R416D-F | CTGATTATGGATGCATGTGGTGATCATATGGTTGC |
| R416D-R | CCACATGCATCCATAATCAGATTATGACGAAAAAAAATATCACG |
| R416C-F | CTGATTATGTGCGCATGTGGTGATCATATGGTTG |
| R416C-R | CCACATGCGCACATAATCAGATTATGACGAAAAAAAATATCAC |
| R416V-F | CTGATTATGGTGGCATGTGGTGATCATATGGTTGCAG |
| R416V-R | CACCACATGCCACCATAATCAGATTATGACGAAAAAAAATATCACG |
| R416G-F | CTGATTATGGGCGCATGTGGTGATCATATGGTTG |
| R416G-R | CACCACATGCGCCCATAATCAGATTATGACGAAAAAAAATATC |
| R416H-F | TGATTATGCATGCATGTGGTGATCATATGG |
| R416H-R | ACATGCATGCATAATCAGATTATGACGAAAAAAAATATC |
将重组菌接种至装有5 mL含50 μg/mL卡那霉素的LB培养基的试管中,37 ℃、180 r/min培养10 h。从试管中移取1 mL菌液接种至含50 μg/mL卡那霉素的100 mL LB培养基的摇瓶中,37 ℃、180 r/min培养2 h,随后降温至16 ℃,加入终浓度为0.2 mmol/L的IPTG,于16 ℃、180 r/min诱导表达16 h。之后,于8 000 r/min、4 ℃离心10 min收集湿菌体,用50 mmol/L的pH 8.0磷酸钾(potassium phosphate, PB)缓冲液洗涤2次并重悬细胞,于冰浴条件下超声破碎(功率400 W,超声3 s,间歇7 s,工作10 min)后,8 000 r/min、4 ℃离心5 min,所得上清液经0.22 μm水膜过滤后得到粗酶液。采用Ni-NTA柱纯化,上样后先用含20 mmol/L咪唑的PB缓冲液洗脱杂蛋白,再用含250 mmol/L咪唑的PB缓冲液洗脱并收集目的蛋白,最后用50 mmol/L的PB缓冲液(pH 8.0)进行超滤替换除盐,即得到纯酶液。
1.5 酶活力测定酶活力单位(U)定义:40 ℃、pH 8.0条件下,以2-氟苯乙酮为底物,每分钟催化生成1 nmol的(S)-1-(2-氟苯基)乙胺所需的酶量定义为一个酶活力单位。
酶活测定反应体系:50 mmol/L,pH 8.0的PB缓冲液1 mL,5 mmol/L底物,100 mmol/L异丙胺盐酸盐,0.5 mmol/L PLP,0.2 mg/mL纯酶液,40 ℃、180 r/min反应20 min。
反应结束后,向反应体系中加入100 μL的4 mol/L NaOH溶液淬灭反应,用2倍体积的乙酸乙酯(含4.4 mmol/L十二烷作为内标物)萃取,离心后取乙酸乙酯相,用无水硫酸镁干燥过夜。取200 μL乙酸乙酯萃取液,加入5 μL乙酸酐和5 μL吡啶,室温下振荡反应30 min使产物胺充分衍生化[27],之后用气相色谱法检测(S)-1-(2-氟苯基)乙胺含量并计算产率。气相色谱检测条件为:安捷伦7820A气相色谱仪,Varian CP-Chirasil-Dex CB毛细管气相色谱柱(25 m×0.25 mm×0.25 μm),FID检测器,进样口温度和检测器温度均为250 ℃,升温程序:初始温度为70 ℃,以20 ℃/min的升温速率升至120 ℃,再以10 ℃/min的升温速率升至160 ℃,进样量1 μL,流量2.5 mL/min,分流比15:1,载气为高纯氮气,流速2 mL/min。
1.6 突变株筛选利用全细胞催化进行突变文库的初筛:将野生型酶和突变体经发酵培养和酶诱导表达后离心收集湿菌体,并进行全细胞催化。反应体系为:1 mL的50 mmol/L PB缓冲液(pH 8.0),5 mmol/L底物,100 mmol/L异丙胺盐酸盐,0.5 mmol/L PLP,50 g/L湿菌体,30 ℃、180 r/min反应2 h,按1.4所述方法检测(S)-1-(2-氟苯基)乙胺含量,以野生型(wild type, WT)酶的酶活计为转氨酶相对活性100%,计算突变体的转氨酶相对活性。
1.7 转氨酶的酶学性质研究考察酶最适反应温度时,分别于20、30、40、50、60 ℃下利用纯酶液进行催化反应,以最高酶活计为100%,计算其他条件下的相对酶活。
考察酶最适反应pH时,将纯酶液分别置于离子强度为50 mmol/L的PB缓冲液(pH 6.0、7.0、8.0)、Tris-HCl缓冲液(pH 8.0、9.0)和甘氨酸-NaOH缓冲液(pH 9.0、10.0)中进行催化反应,以最高酶活计为100%,计算其他条件下的相对酶活。
在最适反应温度和pH条件下,用纯酶液分别催化0.1、0.2、0.5、1.0、2.0、5.0、10.0 mmol/L的2-氟苯乙酮,反应20 min后检测产物(S)-1-(2-氟苯基)乙胺含量,采用Origin软件进行非线性曲线拟合绘制酶的v-[S]图,计算酶的Km、Vmax、kcat及kcat/Km值。
1.8 突变体催化2-氟苯乙酮制备(S)-1-(2-氟苯基)乙胺首先考察了异丙胺盐酸盐浓度、酶浓度和底物浓度对(S)-1-(2-氟苯基)乙胺产率的影响,选取较优条件,继而考察反应时间对(S)-1-(2-氟苯基)乙胺产率的影响。突变体催化2-氟苯乙酮制备(S)-1-(2-氟苯基)乙胺的较佳反应条件为:1.6 mg/mL纯酶液,10 mmol/L 2-氟苯乙酮,400 mmol/L异丙胺盐酸盐,1 mmol/L PLP,2% DMSO,加入50 mmol/L,pH 8.0的PB缓冲液至总体积为1 mL,分别于1、2、4、6、8、10 h取样检测(S)-1-(2-氟苯基)乙胺浓度。
1.9 突变前后酶与底物的分子对接及分析采用1.3所述方法对突变体进行同源建模、分子对接,用Discover Studio软件分析WT和突变体中2-氟苯乙酮周围5 Å范围内的催化活性位点,以及2-氟苯乙酮与氨基酸残基和磷酸吡哆胺(phosphopyridoxamine, PMP) (PMP为辅酶PLP在反应过程中生成的一种醛亚胺中间体)的相互作用力,用Pymol软件分析突变前后酶三维结构的变化。
2 结果与分析 2.1 PfTA基因的挖掘及同源建模以VfTA的氨基酸序列为探针,从NCBI数据库中获得新型ω-转氨酶PfTA,其与探针的序列相似度为35.76%。在SWISS-MODEL网站上,以源自紫色杆菌(Chromobacterium violaceum),相似度为79.26%的ω-转氨酶(PDB ID: 6S4G 1.7 Å)晶体结构为模板,对PfTA进行同源建模,得到PfTA/PMP复合物的三维模型(图 1)。建模结果显示PfTA为二聚体结构,2个PMP分子分别位于酶的2个活性口袋附近。利用SAVES网站对模型进行可靠性评估,拉氏图分析表明落在最适区域(红色)和额外允许区域(黄色)的残基占总数的99.3%,ERRAT结果显示模型整体质量因子为90.44,表明该模型可靠。
|
| 图 1 PfTA三维结构图 Fig. 1 The three-dimensional structure diagram of PfTA. |
| |
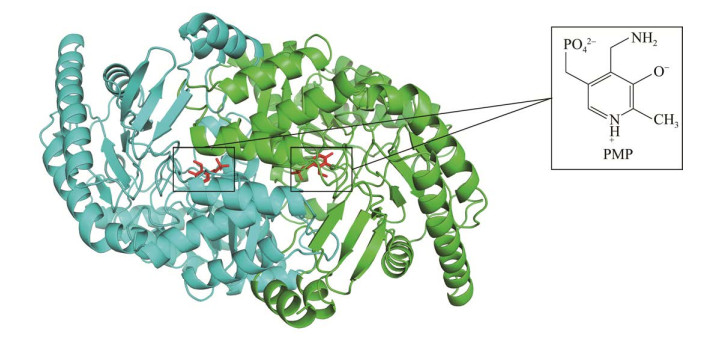
分子对接结果显示,活性中心表面由12个氨基酸残基组成(图 2):F22、L59、W60、F88、Y153、Y168、A231、K288、G319、F320、T321和R416。WT/PMP复合物与2-氟苯乙酮的相互作用力有5个范德华力、4个氢键作用力、1个Pi-阳离子作用力、1个Pi-Pi堆积作用力、1个Pi-Pi T形作用力和1个Pi-烷基作用力。
|
| 图 2 PfTA与2-氟苯乙酮的相互作用力分析 Fig. 2 Analysis of the interaction force between PfTA and 2-fluoroacetophenone. |
| |
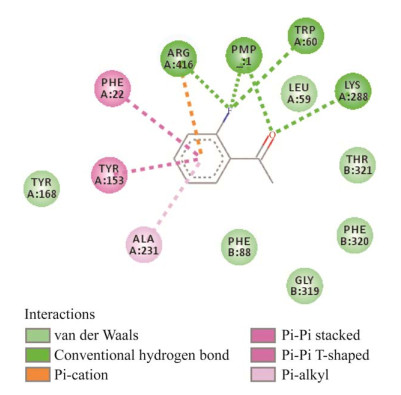
如图 3A所示,对除A231以外的11个活性中心残基进行丙氨酸扫描突变,发现只有突变体R416A和Y168A的相对活性高于WT,L59A、W60A、F88A的相对活性降低,其余位点突变为丙氨酸后酶活力完全丧失。如图 3B和3C所示,对Y168和R416位点分别进行定点饱和突变,发现将168位的Y突变为R、P、A时酶活性提高,其中Y168R的活性较高,为WT的1.20倍;将416位的R突变为Q、D、C、A、V、G、H时活性有所提高,其中Y168R的活性最高,为WT的1.41倍;如图 3D所示,将Y168和R416位点活性提高的突变体进行叠加突变,获得11株较WT活性提高的突变体,其中Y168R/R416Q的活性最高,为WT的1.52倍,同时Y168R和R416Q也是2个位点经单点突变后活性最高的,表明Y168R和R416Q对酶活的提升作用是可叠加的。酶活测定结果表明,Y168R/R416Q突变体的比酶活为47.04 U/mg,较WT的3.72 U/mg提高了11.65倍,故选取Y168R/R416Q进行后续研究。
|
| 图 3 WT与突变体的相对活性 Fig. 3 Relative activities of WT and mutants. A:丙氨酸扫描. B:Y168饱和突变. C:R416饱和突变. D:Y168和R416的叠加突变 A: Alanine scanning. B: Saturation mutagenesis of Y168. C: Saturation mutagenesis of R416. D: Combinatorial mutation of Y168和R416. |
| |
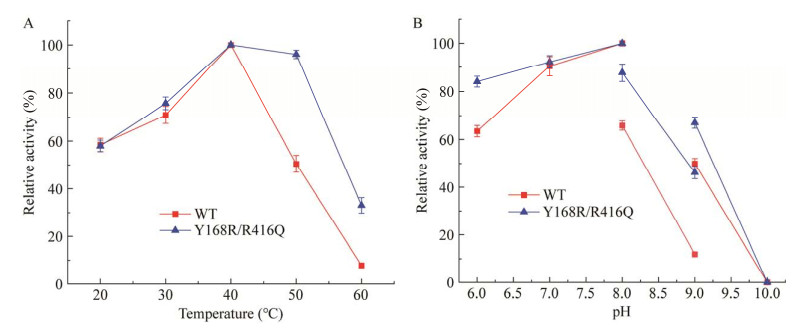
反应温度对WT与Y168R/R416Q活性的影响如图 4A所示,WT与Y168R/R416Q的最适反应温度均为40 ℃。当温度超过40 ℃时,WT的活性迅速下降,在50 ℃时酶活保留率为50.50%,在60 ℃时仅保留7.85%的酶活;而突变体Y168R/R416Q在50 ℃和60 ℃时仍可保留96.05%和33.10%的酶活,表明其耐热性较WT明显提高。
|
| 图 4 反应温度和pH对WT与Y168R/R416Q酶活的影响 Fig. 4 The effect of reaction temperature and pH on the enzymatic activity of WT and Y168R/R416Q. A:反应温度. B:pH A: Reaction temperature. B: pH. |
| |
反应pH值对WT与Y168R/R416Q活性的影响见图 4B,WT与Y168R/R416Q的最适反应pH值均为pH 8.0的PB缓冲液,在pH 6.0−8.0范围内,两者均可保留60%以上的酶活;当pH为9.0时,Y168R/R416Q仍保持46.20%的酶活,而WT仅残余11.9%的酶活,表明突变体Y168R/R416Q的耐碱性较WT有所提高;当pH为10.0时两者均完全失活,表明两者均不宜用于在较高的碱性pH条件下进行催化。
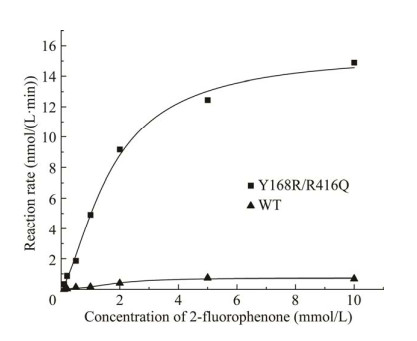
WT与Y168R/R416Q的v-[S]拟合曲线如图 5所示,酶动力学参数比较见表 2,Y168R/R416Q与WT相比,Km仅降低4%,表明突变前后酶对底物的亲和性变化不大;但kcat和kcat/Km分别提高了20.02倍和20.90倍,表明突变体Y168R/R416Q的催化活性和催化效率均有明显提升。
|
| 图 5 WT与Y168R/R416Q的v-[S]拟合曲线 Fig. 5 The v-[S] fitting curve of WT and Y168R/R416Q. |
| |
| Enzyme | Km (mmol/L) |
Vmax (nmol/(L·min)) |
kcat (min−1) |
kcat/Km (L/(mmol·min)) |
| WT | 1.75 | 0.74 | 188.01 | 107.43 |
| Y168R/R416Q | 1.68 | 15.56 | 3 953.25 | 2 353.12 |
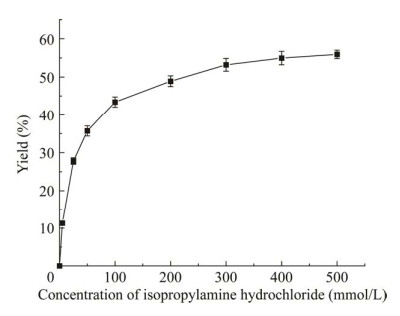
氨基供体过量法是解决ω-转氨酶催化反应平衡问题的常用方法,异丙胺因其价格低廉,成为工业生产中常用的氨基供体之一。本研究以中性的异丙胺盐酸盐为氨基供体,可消除高浓度异丙胺造成的反应体系pH变化的问题。异丙胺盐酸盐浓度对(S)-1-(2-氟苯基)乙胺产率的影响如图 6所示,当底物2-氟苯乙酮浓度为5 mmol/L时,随着异丙胺盐酸盐浓度的增加,(S)-1-(2-氟苯基)乙胺的产率呈现先快速升高后逐渐减缓的趋势,故以300 mmol/L异丙胺盐酸盐浓度为宜,即氨基供体浓度为氨基受体浓度的60倍。
|
| 图 6 异丙胺盐酸盐浓度对产率的影响 Fig. 6 The effect of isopropylamine hydrochloride concentration on the yield. |
| |
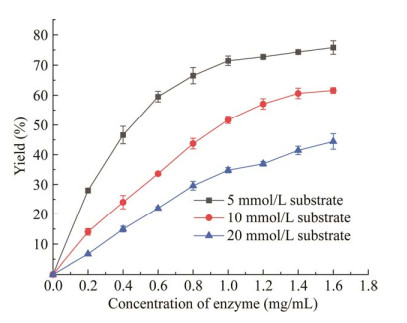
不同酶浓度和底物浓度下(S)-1-(2-氟苯基)乙胺的产率如图 7所示。当酶浓度为1.6 mg/mL时,催化5 mmol/L的2-氟苯乙酮生成(S)-1-(2-氟苯基)乙胺的产率为74.2%,而当2-氟苯乙酮浓度为10 mmol/L和20 mmol/L时,产率分别为60.9%和42.6%,表明底物浓度的增加对酶活性有较明显的抑制。为了使突变体在尽可能高的底物浓度下进行催化反应以达到较高的产物浓度,选择10 mmol/L底物浓度进行后续的条件优化。
|
| 图 7 酶浓度与底物浓度对产率的影响 Fig. 7 The effect of enzyme concentration and substrate concentration on the yield. |
| |
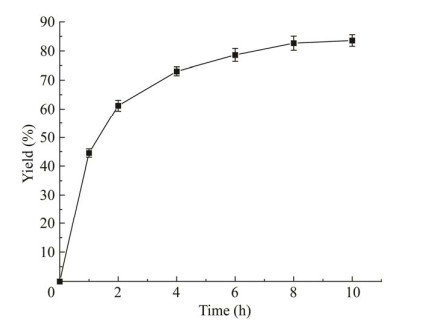
如图 8所示,当突变体Y168R/R416Q催化10 mmol/L 2-氟苯乙酮反应时,反应速率随时间的延长而提高,反应4 h后(S)-1-(2-氟苯基)乙胺产率可达73.05%;之后反应速率逐渐变缓,反应10 h后,(S)-1-(2-氟苯基)乙胺产率为83.58%。
|
| 图 8 突变体Y168R/R416Q催化2-氟苯乙酮转氨的反应进程 Fig. 8 The biocatalytic process of 2-fluorophenone catalyzed by Y168R/R416Q variant. |
| |
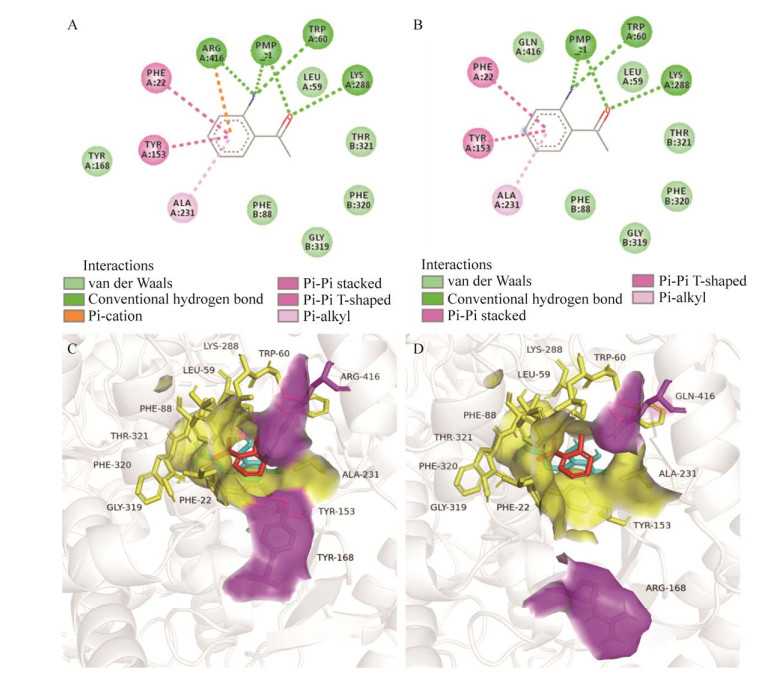
将WT突变为Y168R/R416Q后,除R168和Q416外,其他残基的作用力保持不变,168位突变为R后不在底物5 Å范围内,且与底物没有相互作用力,416位点突变为Q后失去原先R416对2-氟苯乙酮的Pi-阳离子作用力和氢键作用力(图 9A、9B),但突变前后Km变化不大,推测Y168和R416对2-氟苯乙酮的作用力不是影响酶与底物结合的主要作用力。PMP是ω-转氨酶催化过程中生成的一种重要的酮亚胺中间体,K288是参与ω-转氨酶催化的关键活性位点,推测PMP与氟原子和氧原子形成的氢键、K288和氧原子形成的氢键是影响酶与底物结合的主要作用力。R416位点虽然被认为是ω-转氨酶的保守位点之一,但其作用主要是与天然氨基酸和其他羧酸类底物如丙酮酸的羧酸根形成盐桥,本研究的底物2-氟苯乙酮不含羧酸根,该保守位点的突变反而提高了酶活性。突变后酶结合口袋的三维结构发生明显变化(图 9C、9D),在168位,虽然R的侧链基团比Y略大,但其处于远离中心催化区域的位置,可能因此更有利于底物进入中心催化区域;在R416位,当R突变为Q时,侧链基团变小,减小了空间位阻,拓宽了酶活性口袋,从而使得Y168R/R416Q的催化效率kcat/Km显著提升。
|
| 图 9 WT、Y168R/R416Q与2-氟苯乙酮的相互作用力分析和三维结构分析 Fig. 9 Analysis of the interaction forces and three-dimensional structure of WT and Y168R/R416Q while 2-fluorophenylacetone as the ligand. A:WT作用力. B:Y168R/R416Q作用力. C:WT三维结构. D:Y168R/R416Q三维结构 A: Interaction forces of WT. B: Interaction forces of Y168R/R416Q. C: Three-dimensional structure of WT. D: Three-dimensional structure of Y168R/R416Q. |
| |
本研究通过半理性设计法,对从NCBI数据库中挖掘得到的新型ω-转氨酶PfTA进行同源建模和分子对接,确定该酶的催化活性位点后依次进行了丙氨酸扫描、定点饱和突变和叠加突变,得到一株酶活性明显提高的突变株Y168R/R416Q,其可高选择性催化10 mmol/L 2-氟苯乙酮合成(S)-1-(2-氟苯基)乙胺,反应10 h后产率达83.58%,ee值大于99%。与WT相比,突变株Y168R/R416Q的比酶活提高了11.65倍,达47.04 U/mg,催化效率kcat/Km提高20.9倍。分子对接和结构模拟分析表明,引起突变体催化效率提高的原因主要在于突变后拓宽了酶的活性口袋,减少了底物2-氟苯乙酮进入酶活性中心的空间位阻。此外,本研究还揭示了ω-转氨酶的催化反应并非完全受限于传统意义上的酶保守位点,而要根据该保守位点在催化反应中所起的作用判断其在催化不同类型的底物时是否仍然保守。
| [1] |
WU SK, SNAJDROVA R, MOORE JC, BALDENIUS K, BORNSCHEUER UT. Biocatalysis: enzymatic synthesis for industrial applications[J]. Angewandte Chemie International Edition, 2021, 60(1): 88-119. DOI:10.1002/anie.202006648
|
| [2] |
TAN CC, YU JT, WANG HF, TAN MS, MENG XF, WANG C, JIANG T, ZHU XC, TAN L. Efficacy and safety of donepezil, galantamine, rivastigmine, and memantine for the treatment of Alzheimer's disease: a systematic review and meta-analysis[J]. Journal of Alzheimer's Disease: JAD, 2014, 41(2): 615-631. DOI:10.3233/JAD-132690
|
| [3] |
FOX SH, KATZENSCHLAGER R, LIM SY, BARTON B, de BIE RMA, SEPPI K, COELHO M, SAMPAIO C. International Parkinson and movement disorder society evidence-based medicine review: update on treatments for the motor symptoms of Parkinson's disease[J]. Movement Disorders: Official Journal of the Movement Disorder Society, 2018, 33(8): 1248-1266. DOI:10.1002/mds.27372
|
| [4] |
SAVILE CK, JANEY JM, MUNDORFF EC, MOORE JC, TAM S, JARVIS WR, COLBECK JC, KREBBER A, FLEITZ FJ, BRANDS J, DEVINE PN, HUISMAN GW, HUGHES GJ. Biocatalytic asymmetric synthesis of chiral amines from ketones applied to sitagliptin manufacture[J]. Science, 2010, 329(5989): 305-309. DOI:10.1126/science.1188934
|
| [5] |
FAMIGLINI V, la REGINA G, COLUCCIA A, MASCI D, BRANCALE A, BADIA R, RIVEIRA-MUÑOZ E, ESTÉ JA, CRESPAN E, BRAMBILLA A, MAGA G, CATALANO M, LIMATOLA C, FORMICA FR, CIRILLI R, NOVELLINO E, SILVESTRI R. Chiral indolylarylsulfone non-nucleoside reverse transcriptase inhibitors as new potent and broad spectrum anti-HIV-1 agents[J]. Journal of Medicinal Chemistry, 2017, 60(15): 6528-6547. DOI:10.1021/acs.jmedchem.6b01906
|
| [6] |
LEVELL JR, CAFERRO T, CHENAIL G, DIX I, DOOLEY J, FIRESTONE B, FORTIN PD, GIRALDES J, GOULD T, GROWNEY JD, JONES MD, KULATHILA R, LIN F, LIU G, MUELLER A, van der PLAS S, SLOCUM K, SMITH T, TERRANOVA R, TOURÉ BB, et al. Optimization of 3-pyrimidin-4-yl-oxazolidin-2-ones as allosteric and mutant specific inhibitors of IDH1[J]. ACS Medicinal Chemistry Letters, 2017, 8(2): 151-156. DOI:10.1021/acsmedchemlett.6b00334
|
| [7] |
CABRÉ A, VERDAGUER X, RIERA A. Recent advances in the enantioselective synthesis of chiral amines via transition metal-catalyzed asymmetric hydrogenation[J]. Chemical Reviews, 2022, 122(1): 269-339. DOI:10.1021/acs.chemrev.1c00496
|
| [8] |
RODRIGUES CJC, FERRER M, de CARVALHO CCCR. ω-transaminase-mediated asymmetric synthesis of (S)-1-(4-trifluoromethylphenyl) ethylamine[J]. Catalysts, 2021, 11(3): 307. DOI:10.3390/catal11030307
|
| [9] |
MUTTI FG, KNAUS T, SCRUTTON NS, BREUER M, TURNER NJ. Conversion of alcohols to enantiopure amines through dual-enzyme hydrogen-borrowing cascades[J]. Science, 2015, 349(6255): 1525-1529. DOI:10.1126/science.aac9283
|
| [10] |
ZHU FF, ZHANG J, MA YQ, YANG LJ, GAO Q, GAO SS, CUI CS. Semi-rational design of an imine reductase for asymmetric synthesis of alkylated S-4-azepanamines[J]. Organic & Biomolecular Chemistry, 2023, 21(20): 4181-4184.
|
| [11] |
ZHU BF, LIU Y, PEI XQ, WU ZL. Characterization of phenylalanine ammonia lyases from lettuce (Lactuca sativa L.) as robust biocatalysts for the production of D- and L-amino acids[J]. Journal of Agricultural and Food Chemistry, 2023, 71(6): 2935-2942. DOI:10.1021/acs.jafc.2c07890
|
| [12] |
GHISLIERI D, TURNER NJ. Biocatalytic approaches to the synthesis of enantiomerically pure chiral amines[J]. Topics in Catalysis, 2014, 57(5): 284-300. DOI:10.1007/s11244-013-0184-1
|
| [13] |
ALEKU GA, FRANCE SP, MAN H, MANGAS-SANCHEZ J, MONTGOMERY SL, SHARMA M, LEIPOLD F, HUSSAIN S, GROGAN G, TURNER NJ. A reductive aminase from Aspergillus oryzae[J]. Nature Chemistry, 2017, 9(10): 961-969. DOI:10.1038/nchem.2782
|
| [14] |
GOMM A, O'REILLY E. Transaminases for chiral amine synthesis[J]. Current Opinion in Chemical Biology, 2018, 43: 106-112. DOI:10.1016/j.cbpa.2017.12.007
|
| [15] |
SHIN JS, KIM BG. Asymmetric synthesis of chiral amines with omega-transaminase[J]. Biotechnology and Bioengineering, 1999, 65(2): 206-211. DOI:10.1002/(SICI)1097-0290(19991020)65:2<206::AID-BIT11>3.0.CO;2-9
|
| [16] |
KELLY SA, MIX S, MOODY TS, GILMORE BF. Transaminases for industrial biocatalysis: novel enzyme discovery[J]. Applied Microbiology and Biotechnology, 2020, 104(11): 4781-4794. DOI:10.1007/s00253-020-10585-0
|
| [17] |
KAULMANN U, SMITHIES K, SMITH MEB, GILMORE BF. Substrate spectrum of ω-transaminase from Chromobacterium violaceum DSM30191 and its potential for biocatalysis[J]. Enzyme and Microbial Technology, 2007, 41(5): 628-637. DOI:10.1016/j.enzmictec.2007.05.011
|
| [18] |
王继国, 谢有余, 王华磊, 魏东芝. 一种新型ω-转氨酶的工业适应性选择[J]. 生物工程学报, 2020, 36(9): 1929-1938. WANG JG, XIE YY, WANG HL, WEI DZ. Industrial adaptability selection for a novel ω-transaminase[J]. Chinese Journal of Biotechnology, 2020, 36(9): 1929-1938 (in Chinese). |
| [19] |
XIE ZH, ZHAI LX, MENG D, TIAN QP, GUAN ZB, CAI YJ, LIAO XR. Improving the catalytic thermostability of Bacillus altitudinis W3 ω-transaminase by proline substitutions[J]. 3 Biotech, 2020, 10(7): 323. DOI:10.1007/s13205-020-02321-2
|
| [20] |
XIE YY, XU F, YANG L, LIU H, XU XY, WANG HL, WEI DZ. Engineering the large pocket of an (S)-selective transaminase for asymmetric synthesis of (S)-1-amino-1-phenylpropane[J]. Catalysis Science & Technology, 2021, 11(7): 2461-2470.
|
| [21] |
MATASSA C, ORMEROD D, BORNSCHEUER UT, HÖHNE M, SATYAWALI Y. Three-liquid-phase spinning reactor for the transaminase-catalyzed synthesis and recovery of a chiral amine[J]. ChemCatChem, 2020, 12(5): 1288-1291. DOI:10.1002/cctc.201902056
|
| [22] |
NOVICK SJ, DELLAS N, GARCIA R, CHING C, BAUTISTA A, HOMAN D, ALVIZO O, ENTWISTLE D, KLEINBECK F, SCHLAMA T, RUCH T. Engineering an amine transaminase for the efficient production of a chiral sacubitril precursor[J]. ACS Catalysis, 2021, 11(6): 3762-3770. DOI:10.1021/acscatal.0c05450
|
| [23] |
曹旭东, 韩瑞枝, 方红辉, 倪晔. 随机-半理性组合突变改造ω-转氨酶催化合成(R)-1-(1-萘基)乙胺[J]. 生物工程学报, 2020, 36(9): 1828-1837. CAO XD, HAN RZ, FANG HH, NI Y. Engineering ω-transaminase by random mutagenesis and semi-rational design for the synthesis of (R)-(+)-1-(1-naphthyl) ethylamine[J]. Chinese Journal of Biotechnology, 2020, 36(9): 1828-1837 (in Chinese). |
| [24] |
STEFFEN-MUNSBERG F, VICKERS C, THONTOWI A, SCHÄTZLE S, TUMLIRSCH T, SVEDENDAHLHUMBLE M, LAND H, BERGLUND P, BORNSCHEUER UT, HÖHNE M. Connecting unexplored protein crystal structures to enzymatic function[J]. ChemCatChem, 2013, 5(1): 150-153. DOI:10.1002/cctc.201200544
|
| [25] |
ZHANG JH, ZHAO YS, LI C, SONG H. Multi-enzyme pyruvate removal system to enhance (R)-selective reductive amination of ketones[J]. RSC Advances, 2020, 10(48): 28984-28991. DOI:10.1039/D0RA06140A
|
| [26] |
GREEN AP, TURNER NJ, O'REILLY E. Chiral amine synthesis using ω-transaminases: an amine donor that displaces equilibria and enables high-throughput screening[J]. Angewandte Chemie International Edition, 2014, 53(40): 10714-10717. DOI:10.1002/anie.201406571
|
| [27] |
李清华. 酮不对称还原胺化菌株的分离鉴定及其催化性能研究[D]. 上海: 华东理工大学硕士学位论文, 2017. LI QH. Isolation and identification of a new Brevibacterium epidermidis for asymmetric amination of ketones to (S)-chiral amines[D]. Shanghai: Master's Thesis of East China University of Science and Technology, 2017 (in Chinese). |
 2024, Vol. 40
2024, Vol. 40