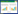| [1] |
WANI MC, TAYLOR HL, WALL ME, COGGON P, McPHAIL AT. Plant antitumor agents. Ⅵ. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia[J]. Journal of the American Chemical Society, 1971, 93(9): 2325-2327. DOI:10.1021/ja00738a045
|
|
| [2] | |
|
| [3] |
ZHANG B, MAITI A, SHIVELY S, LAKHANI F, MCDONALD-JONES G, BRUCE J, LEE EB, XIE SX, JOYCE S, LI C, TOLEIKIS PM, LEE VMY, TROJANOWSKI JQ. Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(1): 227-231.
|
|
| [4] |
EHRLICH A, BOOHER S, BECERRA Y, BORRIS DL, FIGG WD, TURNER ML, BLAUVELT A. Micellar paclitaxel improves severe psoriasis in a prospective phase Ⅱ pilot study[J]. Journal of the American Academy of Dermatology, 2004, 50(4): 533-540. DOI:10.1016/j.jaad.2003.09.018
|
|
| [5] | |
|
| [6] |
冯巍, 谈锋, 谢峻. 曼地亚红豆杉研究进展[J]. 中草药, 2007, 38(10): 1589-1593. FENG W, TAN F, XIE J. Advances in studies on Taxus media[J]. Chinese Traditional and Herbal Drugs, 2007, 38(10): 1589-1593 (in Chinese). DOI:10.3321/j.issn:0253-2670.2007.10.049
|
|
| [7] |
FENG SG, HOU KL, ZHANG HS, CHEN C, HUANG JF, WU QC, ZHANG ZH, GAO YD, WU XM, WANG HZ, SHEN CJ. Investigation of the role of TmMYB16/123 and their targets (TmMTP1/11) in the tolerance of Taxus media to cadmium[J]. Tree Physiology, 2023, 43(6): 1009-1022. DOI:10.1093/treephys/tpad019
|
|
| [8] |
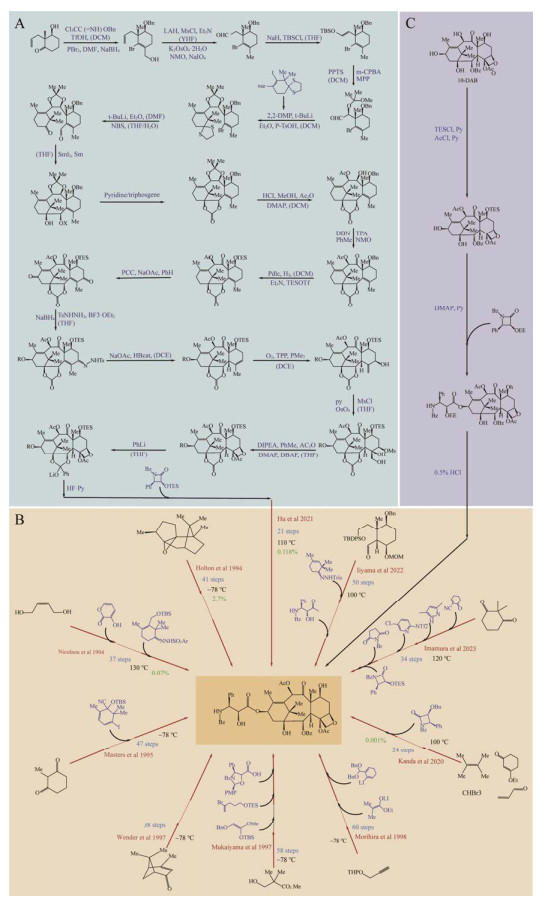
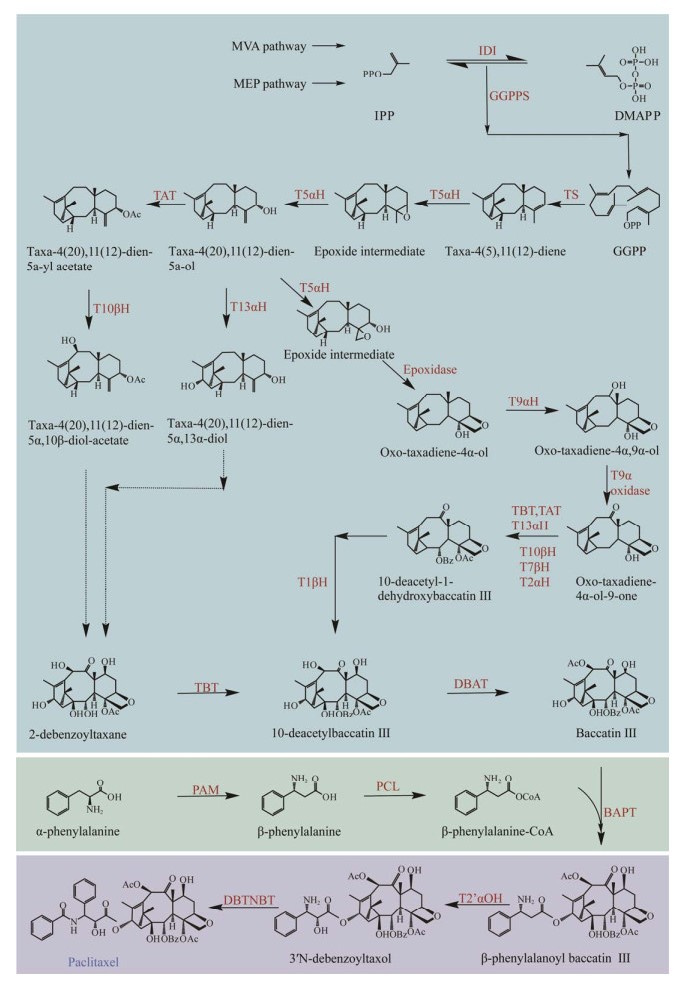
HOLTON RA, KIM HB, SOMOZA C, LIANG F, BIEDIGER RJ, BOATMAN PD, SHINDO M, SMITH CC, KIM SC, NADIZADEH H, SUZUKI Y, TAO CL, VU P, TANG SH, ZHANG PS, MURTHI KK, GENTILE LN, LIU JH. First total synthesis of taxol. 2. Completion of the c-ring and d-ring[J]. Journal of the American Chemical Society, 1994, 116(4): 1599-1600. DOI:10.1021/ja00083a067
|
|
| [9] |
NICOLAOU KC, YANG Z, LIU JJ, UENO H, NANTERMET PG, GUY RK, CLAIBORNE CF, RENAUD J, COULADOUROS EA, PAULVANNAN K. Total synthesis of taxol[J]. Nature, 1994, 367(6464): 630-634. DOI:10.1038/367630a0
|
|
| [10] |
MASTERS JJ, LINK JT, SNYDER LB, YOUNG WB, DANISHEFSKY SJ. A total synthesis of taxol[J]. Angewandte Chemie International Edition in English, 1995, 34(16): 1723-1726. DOI:10.1002/anie.199517231
|
|
| [11] |
WENDER PA, BADHAM NF, CONWAY SP, FLOREANCIG PE, GLASS TE, GRÄNICHER C, HOUZE JB, JÄNICHEN J, LEE D, MARQUESS DG, McGRANE PL, MENG W, MUCCIARO TP, MÜHLEBACH M, NATCHUS MG, PAULSEN H, RAWLINS DB, SATKOFSKY J, SHUKER AJ, SUTTON JC, et al. The pinene path to taxanes. 5. stereocontrolled synthesis of a versatile taxane precursor[J]. Journal of the American Chemical Society, 1997, 119(11): 2755-2756. DOI:10.1021/ja9635387
|
|
| [12] |
MUKAIYAMA T, SHIINA I, IWADARE H, SAKOH H, TANI YI, HASEGAWA M, SAITOH K. Asymmetric total synthesis of taxol[J]. Proceedings of the Japan Academy, Series B, 1997, 73(6): 95-100. DOI:10.2183/pjab.73.95
|
|
| [13] |
MORIHIRA K, HARA R, KAWAHARA S, NISHIMORI T, NAKAMURA N, KUSAMA H, KUWAJIMA I. Enantioselective total synthesis of taxol[J]. Journal of the American Chemical Society, 1998, 120(49): 12980-12981. DOI:10.1021/ja9824932
|
|
| [14] |
KANDA Y, NAKAMURA H, UMEMIYA S, PUTHUKANOORI RK, APPALA VRM, GADDAMANUGU GK, PARASELLI BR, BARAN PS. Two-phase synthesis of taxol[J]. Journal of the American Chemical Society, 2020, 142(23): 10526-10533. DOI:10.1021/jacs.0c03592
|
|
| [15] |
HU YJ, GU CC, WANG XF, MIN L, LI CC. Asymmetric total synthesis of taxol[J]. Journal of the American Chemical Society, 2021, 143(42): 17862-17870. DOI:10.1021/jacs.1c09637
|
|
| [16] |
IIYAMA S, FUKAYA K, YAMAGUCHI Y, WATANABE A, YAMAMOTO H, MOCHIZUKI S, SAIO R, NOGUCHI T, OISHI T, SATO T, CHIDA N. Total synthesis of paclitaxel[J]. Organic Letters, 2022, 24(1): 202-206. DOI:10.1021/acs.orglett.1c03851
|
|
| [17] |
IMAMURA Y, TAKAOKA K, KOMORI Y, NAGATOMO M, INOUE M. Total synthesis of taxol enabled by inter- and intramolecular radical coupling reactions[J]. Angewandte Chemie International Edition, 2023, 62(10): e202219114. DOI:10.1002/anie.202219114
|
|
| [18] |
WAHL A, GUÉRITTE-VOEGELEIN F, GUÉNARD D, Le GOFF MT, POTIER P. Rearrangement reactions of taxanes: structural modifications of 10-deacetylbaccatin Ⅲ[J]. Tetrahedron, 1992, 48(34): 6965-6974. DOI:10.1016/S0040-4020(01)91208-6
|
|
| [19] |
HOLTON ROBERT A. Method for preparation of taxol using an oxazinone. 1990/11/13/Application date.
|
|
| [20] |
ZHAO L, ZHU YH, JIA HY, HAN YG, ZHENG XK, WANG M, FENG WS. From plant to yeast-advances in biosynthesis of artemisinin[J]. Molecules, 2022, 27(20): 6888. DOI:10.3390/molecules27206888
|
|
| [21] |
姜逢霖, 巩婷, 陈晶晶, 陈天娇, 杨金玲, 朱平. 植物来源药用天然产物的合成生物学研究进展[J]. 生物工程学报, 2021, 37(6): 1931-1951. JIANG FL, GONG T, CHEN JJ, CHEN TJ, YANG JL, ZHU P. Synthetic biology of plants-derived medicinal natural products[J]. Chinese Journal of Biotechnology, 2021, 37(6): 1931-1951 (in Chinese).
|
|
| [22] |
LIU XN, CHENG J, ZHANG GH, DING WT, DUAN LJ, YANG J, KUI L, CHENG XZ, RUAN JX, FAN W, CHEN JW, LONG GQ, ZHAO Y, CAI J, WANG W, MA YH, DONG Y, YANG SC, JIANG HF. Engineering yeast for the production of breviscapine by genomic analysis and synthetic biology approaches[J]. Nature Communications, 2018, 9(1): 448. DOI:10.1038/s41467-018-02883-z
|
|
| [23] |
LI XD, WANG YM, FAN ZJ, WANG Y, WANG PP, YAN X, ZHOU ZH. High-level sustainable production of the characteristic protopanaxatriol-type saponins from Panax species in engineered Saccharomyces cerevisiae[J]. Metabolic Engineering, 2021, 66: 87-97. DOI:10.1016/j.ymben.2021.04.006
|
|
| [24] |
LI YR, LI SJ, THODEY K, TRENCHARD I, CRAVENS A, SMOLKE CD. Complete biosynthesis of noscapine and halogenated alkaloids in yeast[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(17): E3922-E3931.
|
|
| [25] |
ROBERTS SC. Production and engineering of terpenoids in plant cell culture[J]. Nature Chemical Biology, 2007, 3(7): 387-395. DOI:10.1038/nchembio.2007.8
|
|
| [26] |
ZHAO Y, LIANG FY, XIE YM, DUAN YT, ANDEADELLI A, PATERAKI I, MAKRIS AM, POMORSKI TG, STAERK D, KAMPRANIS SC. Oxetane ring formation in taxol biosynthesis is catalyzed by a bifunctional cytochrome P450 enzyme[J]. Journal of the American Chemical Society, 2024, 146(1): 801-810. DOI:10.1021/jacs.3c10864
|
|
| [27] |
吴迎梅, 廖庆刚, 尚轶, 龚振平, 苟君波. 多组学助力紫杉醇合成生物学研究[J]. 植物科学学报, 2022, 40(6): 853-866. WU YM, LIAO QG, SHANG Y, GONG ZP, GOU JB. Recent progress of paclitaxel biosynthesis aided by multi-omics[J]. Plant Science Journal, 2022, 40(6): 853-866 (in Chinese).
|
|
| [28] |
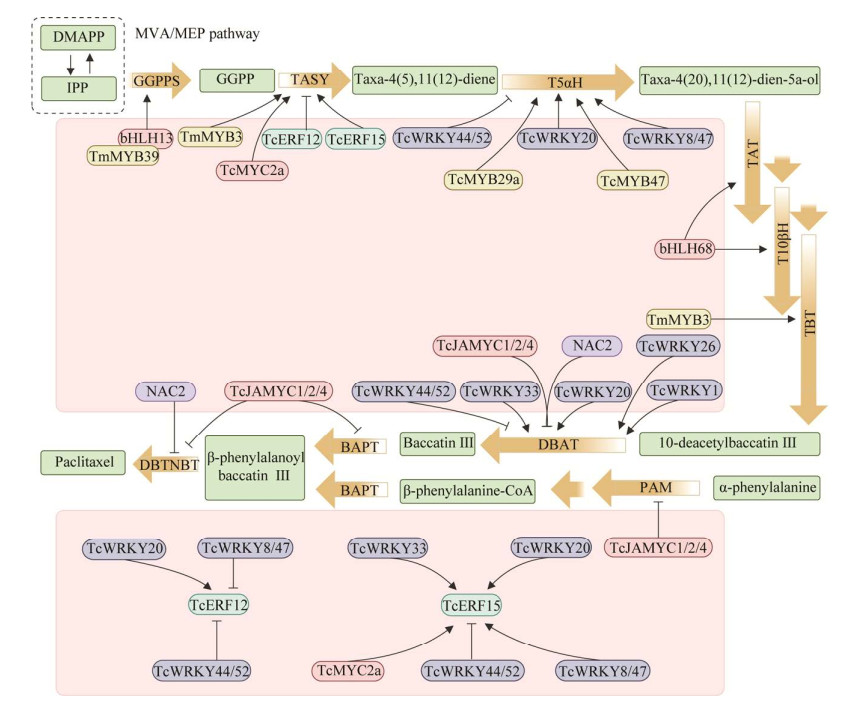
JENNEWEIN S, CROTEAU R. Taxol: biosynthesis, molecular genetics, and biotechnological applications[J]. Applied Microbiology and Biotechnology, 2001, 57(1): 13-19.
|
|
| [29] |
ZHANG YJ, WIESE L, FANG H, ALSEEKH S, PEREZ de SOUZA L, SCOSSA F, MOLLOY JJ, CHRISTMANN M, FERNIE AR. Synthetic biology identifies the minimal gene set required for paclitaxel biosynthesis in a plant chassis[J]. Molecular Plant, 2023, 16(12): 1951-1961. DOI:10.1016/j.molp.2023.10.016
|
|
| [30] |
HEINIG U, JENNEWEIN S. Taxol: a complex diterpenoid natural product with an evolutionarily obscure origin[J]. African Journal of Biotechnology, 2009, 8: 1370-1385.
|
|
| [31] |
STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260(5105): 214-216. DOI:10.1126/science.8097061
|
|
| [32] |
胡凯, 谈锋, 唐克轩, 祝顺琴, 王微. 南方红豆杉中产紫杉醇内生真菌的分离和筛选[J]. 西南师范大学学报(自然科学版), 2006, 31(1): 134-137. HU K, TAN F, TANG KX, ZHU SQ, WANG W. Isolation and screening of endophytic fungi synthesizing taxol from Taxus chinensis var. mairei[J]. Journal of Southwest China Normal University (Natural Science Edition), 2006, 31(1): 134-137 (in Chinese). DOI:10.3969/j.issn.1000-5471.2006.01.029
|
|
| [33] |
田仁鹏, 杨桥, 周国玲, 谈静泉, 张珞珍, 方呈祥. 一株产紫杉醇的南方红豆杉内生真菌的分离及分类研究[J]. 武汉植物学研究, 2006, 24(6): 541-545. TIAN RP, YANG Q, ZHOU GL, TAN JQ, ZHANG LZ, FANG CX. Taxonomic study on a taxol producing fungus isolated from bark of Taxus chinensis var. mairei[J]. Journal of Wuhan Botanical Research, 2006, 24(6): 541-545 (in Chinese).
|
|
| [34] |
ZHANG P, ZHOU PP, YU LJ. An endophytic taxol-producing fungus from Taxus media, Cladosporium cladosporioides MD2[J]. Current Microbiology, 2009, 59(3): 227-232. DOI:10.1007/s00284-008-9270-1
|
|
| [35] |
KUMARAN RS, KIM HJ, HUR BK. Taxol promising fungal endophyte, Pestalotiopsis species isolated from Taxus cuspidata[J]. Journal of Bioscience and Bioengineering, 2010, 110(5): 541-546. DOI:10.1016/j.jbiosc.2010.06.007
|
|
| [36] |
GARYALI S, KUMAR A, REDDY MS. Taxol production by an endophytic fungus, Fusarium redolens, isolated from Himalayan yew[J]. Journal of Microbiology and Biotechnology, 2013, 23(10): 1372-1380. DOI:10.4014/jmb.1305.05070
|
|
| [37] |
WANG X, WANG C, SUN YT, SUN CZ, ZHANG Y, WANG XH, ZHAO K. Taxol produced from endophytic fungi induces apoptosis in human breast, cervical and ovarian cancer cells[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2015, 16(1): 125-131. DOI:10.7314/APJCP.2015.16.1.125
|
|
| [38] |
EL-SAYED ASA, ALI DMI, YASSIN MA, ZAYED RA, ALI GS. Sterol inhibitor "fluconazole" enhance the taxol yield and molecular expression of its encoding genes cluster from Aspergillus flavipes[J]. Process Biochemistry, 2019, 76: 55-67. DOI:10.1016/j.procbio.2018.10.008
|
|
| [39] |
陈国晶, 杨宁, 吴文静, 喻静, 金磊磊, 张爱华, 陈集双. 不同诱导子对曼地亚红豆杉内生真菌产紫杉醇的影响[J]. 南京工业大学学报(自然科学版), 2021, 43(4): 535-539. CHEN GJ, YANG N, WU WJ, YU J, JIN LL, ZHANG AH, CHEN JS. Effects of different elicitors on paclitaxel productions of an endophytic fungus Alternaria sp. isolated from Taxus media[J]. Journal of Nanjing Tech University (Natural Science Edition), 2021, 43(4): 535-539 (in Chinese).
|
|
| [40] |
HUANG QL, ROESSNER CA, CROTEAU R, SCOTT AI. Engineering Escherichia coli for the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol[J]. Bioorganic & Medicinal Chemistry, 2001, 9(9): 2237-2242.
|
|
| [41] |
AJIKUMAR PK, XIAO WH, TYO KEJ, WANG Y, SIMEON F, LEONARD E, MUCHA O, PHON TH, PFEIFER B, STEPHANOPOULOS G. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli[J]. Science, 2010, 330(6000): 70-74. DOI:10.1126/science.1191652
|
|
| [42] |
BIGGS BW, LIM CG, SAGLIANI K, SHANKAR S, STEPHANOPOULOS G, de MEY M, AJIKUMAR PK. Overcoming heterologous protein interdependency to optimize P450-mediated taxol precursor synthesis in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(12): 3209-3214.
|
|
| [43] |
WU QY, HUANG ZY, WANG JY, YU HL, XU JH. Construction of an Escherichia coli cell factory to synthesize taxadien-5α-ol, the key precursor of anti-cancer drug paclitaxel[J]. Bioresources and Bioprocessing, 2022, 9(1): 82. DOI:10.1186/s40643-022-00569-5
|
|
| [44] |
王伟, 孟超, 朱平, 程克棣. 代谢工程酵母菌合成紫杉烯的研究[J]. 中国生物工程杂志, 2005, 25(8): 103-108. WANG W, MENG C, ZHU P, CHENG KD. Preliminary study on metabolic engineering of yeast for producing taxadiene[J]. China Biotechnology, 2005, 25(8): 103-108 (in Chinese).
|
|
| [45] |
DEJONG JM, LIU YL, BOLLON AP, LONG RM, JENNEWEIN S, WILLIAMS D, CROTEAU RB. Genetic engineering of taxol biosynthetic genes in Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering, 2006, 93(2): 212-224. DOI:10.1002/bit.20694
|
|
| [46] |
ENGELS B, DAHM P, JENNEWEIN S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards taxol (paclitaxel) production[J]. Metabolic Engineering, 2008, 10(3/4): 201-206.
|
|
| [47] |
DING MZ, YAN HF, LI LF, ZHAI F, SHANG LQ, YIN Z, YUAN YJ. Biosynthesis of taxadiene in Saccharomyces cerevisiae: selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy[J]. PLoS One, 2014, 9(10): e109348.
|
|
| [48] |
NOWROUZI B, LI RA, WALLS LE, D'ESPAUX L, MALCı K, LIANG LG, JONGUITUD-BORREGO N, LERMA-ESCALERA AI, MORONES-RAMIREZ JR, KEASLING JD, RIOS-SOLIS L. Enhanced production of taxadiene in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2020, 19(1): 200.
|
|
| [49] |
WALLS LE, MALCı K, NOWROUZI B, LI RA, D'ESPAUX L, WONG J, DENNIS JA, SEMIÃO AJC, WALLACE S, MARTINEZ JL, KEASLING JD, RIOS-SOLIS L. Optimizing the biosynthesis of oxygenated and acetylated taxol precursors in Saccharomyces cerevisiae using advanced bioprocessing strategies[J]. Biotechnology and Bioengineering, 2021, 118(1): 279-293.
|
|
| [50] |
WALLS L E, MARTINEZ J L, RIOS-SOLIS L. Enhancing Saccharomyces cerevisiae taxane biosynthesis and overcoming nutritional stress-induced pseudohyphal growth[J]. Microorganisms, 2022, 10(1): 163.
|
|
| [51] |
辛燕花, 肖招燕, 尤琳烽, 郭丽琼, 林俊芳. 紫杉二烯合酶基因在灵芝中的表达[J]. 中国农业科学, 2014, 47(3): 546-552. XIN YH, XIAO ZY, YOU LF, GUO LQ, LIN JF. Heterologous expression of taxadiene synthase gene in Ganoderma lucidum[J]. Scientia Agricultura Sinica, 2014, 47(3): 546-552 (in Chinese).
|
|
| [52] |
BIAN GK, YUAN YJ, TAO H, SHI XF, ZHONG XF, HAN YC, FU S, FANG CX, DENG ZX, LIU TG. Production of taxadiene by engineering of mevalonate pathway in Escherichia coli and endophytic fungus Alternaria alternata TPF6[J]. Biotechnology Journal, 2017, 12(4): 1600697.
|
|
| [53] |
朱泽燕, 李军超, 王启明, 杨淑慎. 农杆菌介导Txpam基因转化烟曲霉TMS-26及其产紫杉醇效果评价[J]. 菌物学报, 2021, 40(8): 2087-2101. ZHU ZY, LI JC, WANG QM, YANG SS. Agrobacterium-mediated transformation of Aspergillus fumigatus TMS-26 with a phenylalanine aminomutase gene and evaluation of the transformant potential for paclitaxel production[J]. Mycosystema, 2021, 40(8): 2087-2101 (in Chinese).
|
|
| [54] |
BESUMBES O, SAURET-GÜETO S, PHILLIPS MA, IMPERIAL S, RODRÍGUEZ-CONCEPCIÓN M, BORONAT A. Metabolic engineering of isoprenoid biosynthesis in Arabidopsis for the production of taxadiene, the first committed precursor of taxol[J]. Biotechnology and Bioengineering, 2004, 88(2): 168-175.
|
|
| [55] |
KOVACS K, ZHANG LN, LINFORTH RST, WHITTAKER B, HAYES CJ, FRAY RG. Redirection of carotenoid metabolism for the efficient production of taxadiene (taxa-4(5), 11(12)-diene) in transgenic tomato fruit[J]. Transgenic Research, 2007, 16(1): 121-126.
|
|
| [56] |
HASAN MM, KIM HS, JEON JH, KIM SH, MOON B, SONG JY, SHIM SH, BAEK KH. Metabolic engineering of Nicotiana benthamiana for the increased production of taxadiene[J]. Plant Cell Reports, 2014, 33(6): 895-904.
|
|
| [57] |
LI MY, JIANG FS, YU XL, MIAO ZQ. Engineering isoprenoid biosynthesis in Artemisia annua L. for the production of taxadiene: a key intermediate of taxol[J]. BioMed Research International, 2015, 2015, 504932.
|
|
| [58] |
LI JH, MUTANDA I, WANG KB, YANG L, WANG JW, WANG Y. Chloroplastic metabolic engineering coupled with isoprenoid pool enhancement for committed taxanes biosynthesis in Nicotiana benthamiana[J]. Nature Communications, 2019, 10(1): 4850.
|
|
| [59] |
FU JQ, XU WB, HUANG W, WANG BP, LI SC, ZHANG J, CHANG L. Importation of taxadiene synthase into chloroplast improves taxadiene production in tobacco[J]. Planta, 2021, 253(5): 107.
|
|
| [60] |
ROHR R. Production de cals par les gametophytes males de Taxus Baccata L. Cultives sur un milieu artificiel. Etude en microscopie photonique et electronique[J]. Caryologia, 1973, 25(sup1): 177-189.
|
|
| [61] | |
|
| [62] |
WICKREMESINHE ERM, ARTEEA RN. Taxus callus cultures: initiation, growth optimization, characterization and taxol production[J]. Plant Cell, Tissue and Organ Culture, 1993, 35(2): 181-193.
|
|
| [63] |
FETT-NETO AG, PENNINGTON JJ, DiCOSMO F. Effect of white light on taxol and baccatin Ⅲ accumulation in cell cultures of Taxus cuspidata Sieb and Zucc.[J]. Journal of Plant Physiology, 1995, 146(5/6): 584-590.
|
|
| [64] |
张宗勤, 罗新谈, 王之, 郝联芳. 红豆杉的愈伤组织诱导及培养研究(初报)[J]. 西北植物学报, 1996, 16(5): 16-18. ZHANG ZQ, LUO XT, WANG Z, HAO LF. Study on callus induction and culture of Taxus chinensis (preliminary report)[J]. Acta Botanica Boreali-Occidentalia Sinica, 1996, 16(5): 16-18 (in Chinese).
|
|
| [65] | |
|
| [66] |
苏应娟, 王艇, 杨礼香, 李雪雁, 范国宽, 柯亚永, 朱建明, 吴惠勤, 葛发欢. 南方红豆杉芽愈伤组织的诱导和培养[J]. 中草药, 2001, 32(7): 637-639. SU YJ, WANG T, YANG LX, LI XY, FAN GK, KE YY, ZHU JM, WU HQ, GE FH. Induction and culture on callus of Taxus chinensis var. mairei bud[J]. Chinese Traditional and Herbal Drugs, 2001, 32(7): 637-639 (in Chinese).
|
|
| [67] |
金贞兰, 刘继生, 鲁京兰, 刘宪虎, 许明子. 不同培养基对东北红豆杉愈伤组织诱导的影响[J]. 安徽农业科学, 2010, 38(19): 9993-9994, 9997. JIN ZL, LIU JS, LU JL, LIU XH, XU MZ. Effects of different medium on callus induction from Taxus cuspidate sieb. et Zucc[J]. Journal of Anhui Agricultural Sciences, 2010, 38(19): 9993-9994, 9997 (in Chinese).
|
|
| [68] |
王淑杰, 袁丽娜, 张健雄, 刘丽丽, 王赵玉. 抑菌剂在东北红豆杉开放式组培中的应用研究[J]. 园艺学报, 2011, 38(S): 2638. WANG SJ, YUAN LN, ZHANG JX, LIU LL, WANG ZY. Application of antibacterial agents in open tissue culture of Taxus cuspidata Sieb and Zucc.[J]. Acta Horticulturae Sinica, 2011, 38(S): 2638 (in Chinese).
|
|
| [69] |
余响华, 邵金华, 袁志辉, 赵昌会, 戴永强. 植物细胞工程技术生产紫杉醇研究进展[J]. 西北植物学报, 2013, 33(6): 1279-1284. YU XH, SHAO JH, YUAN ZH, ZHAO CH, DAI YQ. Research progress on production of taxol by plant cell engineering[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(6): 1279-1284 (in Chinese).
|
|
| [70] | |
|
| [71] |
王淑杰, 李晓卉, 白贺, 李瞳, 李纯, 王胡军. 东北红豆杉悬浮细胞诱导紫杉醇培养基优化研究[J]. 中国园艺学会2018年学术年会论文摘要集, 2018.
WANG SJ, LI XH, BAI H, LI T, LI C, WANG HJ. Optimization of paclitaxel culture medium induced by suspension cells of Taxus cuspidata Sieb and Zucc. [J]. Collected abstracts of papers from the 2018 Academic Annual Conference of the Chinese Horticultural Society, 2018 (in Chinese).
|
|
| [72] |
徐志荣, 王婷, 娄佳兰, 魏赛金. 南方红豆杉细胞悬浮培养体系优化及动力学研究[J]. 林业科学研究, 2019, 32(1): 8-14. XU ZR, WANG T, LOU JL, WEI SJ. Study on optimization of cell suspension culture system and kinetics of Taxus chinensis var. mairer[J]. Forest Research, 2019, 32(1): 8-14 (in Chinese).
|
|
| [73] |
MALIK S, CUSIDÓ RM, MIRJALILI MH, MOYANO E, PALAZÓN J, BONFILL M. Production of the anticancer drug taxol in Taxus baccata suspension cultures: a review[J]. Process Biochemistry, 2011, 46(1): 23-34.
|
|
| [74] |
YUKIMUNE Y, TABATA H, HIGASHI Y, HARA Y. Methyl jasmonate-induced overproduction of paclitaxel and baccatin Ⅲ in Taxus cell suspension cultures[J]. Nature Biotechnology, 1996, 14: 1129-1132.
|
|
| [75] |
QIAN ZG, ZHAO ZJ, XU YF, QIAN XH, ZHONG JJ. Novel chemically synthesized hydroxyl-containing jasmonates as powerful inducing signals for plant secondary metabolism[J]. Biotechnology and Bioengineering, 2004, 86(7): 809-816.
|
|
| [76] |
NAILL MC, ROBERTS SC. Cell cycle analysis of Taxus suspension cultures at the single cell level as an indicator of culture heterogeneity[J]. Biotechnology and Bioengineering, 2005, 90(4): 491-500.
|
|
| [77] |
ONRUBIA M, MOYANO E, BONFILL M, EXPÓSITO O, PALAZÓN J, CUSIDÓ RM. An approach to the molecular mechanism of methyl jasmonate and vanadyl sulphate elicitation in Taxus baccata cell cultures: the role of txs and bapt gene expression[J]. Biochemical Engineering Journal, 2010, 53(1): 104-111.
|
|
| [78] |
BENDER CL, ALARCÓN-CHAIDEZ F, GROSS DC. Pseudomonas syringae phytotoxins: mode of action, regulation, and biosynthesis by peptide and polyketide synthetases[J]. Microbiology and Molecular Biology Reviews: MMBR, 1999, 63(2): 266-292.
|
|
| [79] |
KATSIR L, SCHILMILLER AL, STASWICK PE, HE SY, HOWE GA. COI1 is a critical component of a receptor for jasmonate and the bacterial virulence factor coronatine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(19): 7100-7105.
|
|
| [80] |
ONRUBIA M, MOYANO E, BONFILL M, CUSIDÓ RM, GOOSSENS A, PALAZÓN J. Coronatine, a more powerful elicitor for inducing taxane biosynthesis in Taxus media cell cultures than methyl jasmonate[J]. Journal of Plant Physiology, 2013, 170(2): 211-219.
|
|
| [81] |
赵疆, 党昇荣, 姚阳阳, 李羽翡, 王宝民, 沙洁, 杨涛. 外源水杨酸和冠菌素对当归早期抽薹的影响[J]. 甘肃农业大学学报, 2023, 58(4): 137-145. ZHAO J, DANG SR, YAO YY, LI YF, WANG BM, SHA J, YANG T. Effects of exogenous salicylic acid and coronatine on early bolting of Angelica sinensis[J]. Journal of Gansu Agricultural University, 2023, 58(4): 137-145 (in Chinese).
|
|
| [82] | |
|
| [83] |
WANG YD, WU JC, YUAN YJ. Salicylic acid-induced taxol production and isopentenyl pyrophosphate biosynthesis in suspension cultures of Taxus chinensis var. mairei[J]. Cell Biology International, 2007, 31(10): 1179-1183.
|
|
| [84] |
YAMAMOTO K, TANIKAWA T, TOMITA J, ISHIDA Y, NAKATA D, TERAO K, INOUE Y. Characterization, preparation, and promotion of plant growth of 1, 3-diphenylurea/β-cyclodextrin derivatives inclusion complexes[J]. ACS Omega, 2023, 8(38): 34972-34981.
|
|
| [85] |
SABATER-JARA AB, ONRUBIA M, MOYANO E, BONFILL M, PALAZÓN J, PEDREÑO MA, CUSIDÓ RM. Synergistic effect of cyclodextrins and methyl jasmonate on taxane production in Taxus x media cell cultures[J]. Plant Biotechnology Journal, 2014, 12(8): 1075-1084.
|
|
| [86] |
张长平, 李春, 元英进, 孙安慈, 胡昌序. 真菌诱导子对悬浮培养南方红豆杉细胞态势及紫杉醇合成的影响[J]. 生物工程学报, 2001, 17(4): 436-440. ZHANG CP, LI C, YUAN YJ, SUN AC, HU CX. Effects of fungal elicitor on cell status and taxol production in cells suspension cultures of Taxus chinesis var. mairei[J]. Chinese Journal of Biotechnology, 2001, 17(4): 436-440 (in Chinese).
|
|
| [87] |
LI YC, TAO WY. Interactions of taxol-producing endophytic fungus with its host (Taxus spp.) during taxol accumulation[J]. Cell Biology International, 2009, 33(1): 106-112.
|
|
| [88] |
邱涵, 孟丽媛, 杨婉婷, 凌树玉, 任凯利, 魏赛金. 灵芝诱导子对南方红豆杉悬浮培养细胞产紫杉醇的影响[J]. 河南农业科学, 2023, 52(10): 52-59. QIU H, MENG LY, YANG WT, LING SY, REN KL, WEI SJ. Effect of Ganoderma lucidum elicitor on paclitaxel production by Taxus wallichiana var. mairei suspension culture cells[J]. Journal of Henan Agricultural Sciences, 2023, 52(10): 52-59 (in Chinese).
|
|
| [89] |
HE Y, LOH C. Cerium and lanthanum promote floral initiation and reproductive growth of Arabidopsis thaliana[J]. Plant Science: an International Journal of Experimental Plant Biology, 2000, 159(1): 117-124.
|
|
| [90] |
YUAN YJ, HU GW, WANG CG, JING Y, SHEN PW. Effect of La, Ce on Taxus cuspidata cell growth, biosynthesis and release of taxol[J]. Journal of Rare Earths, 1998, 16(4): 61-67.
|
|
| [91] |
YANG S, LU SH, YUAN YJ. Lipidomic analysis reveals differential defense responses of Taxus cuspidata cells to two elicitors, methyl jasmonate and cerium (Ce4+)[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2008, 1781(3): 123-134.
|
|
| [92] |
BONET IJM, ARALDI D, GREEN PG, LEVINE JD. Topical coapplication of hyaluronan with transdermal drug delivery enhancers attenuates inflammatory and neuropathic pain[J]. Pain, 2023, 164(12): 2653-2664.
|
|
| [93] |
KAJANI AA, MOGHIM S, MOFID MR. Enhanced taxane production and secretion from Taxus baccata cell culture by adding dimethylsulfoxide[J]. Biotechnology and Applied Biochemistry, 2012, 59(3): 223-227.
|
|
| [94] |
OKRAH A, LI SL, AGATHOKLEOUS E, FENG ZZ. Elevated ozone effects on potato leaf physiology, growth, and yield: a meta-analysis[J]. Environmental Science and Pollution Research, 2023, 30(57): 120483-120495.
|
|
| [95] |
XU MJ, JIN HH, DONG JF, ZHANG M, XU XB, ZHOU T. Abscisic acid plays critical role in ozone-induced taxol production of Taxus chinensis suspension cell cultures[J]. Biotechnology Progress, 2011, 27(5): 1415-1420.
|
|
| [96] | |
|
| [97] |
ZHANG L, XU Y, LI YT, ZHENG SS, ZHAO ZM, CHEN ML, YANG HJ, YI HL, WU JX. Transcription factor CsMYB77 negatively regulates fruit ripening and fruit size in citrus[J]. Plant Physiology, 2023, kiad592.
|
|
| [98] |
YU CN, LUO XJ, ZHANG CC, XU XY, HUANG JF, CHEN YY, FENG SG, ZHAN XR, ZHANG L, YUAN HW, ZHENG BS, WANG HZ, SHEN CJ. Tissue-specific study across the stem of Taxus media identifies a phloem-specific TmMYB3 involved in the transcriptional regulation of paclitaxel biosynthesis[J]. The Plant Journal: for Cell and Molecular Biology, 2020, 103(1): 95-110.
|
|
| [99] |
CAO XY, XU LX, LI LD, WAN W, JIANG JH. TcMYB29a, an ABA-responsive R2R3-MYB transcriptional factor, upregulates taxol biosynthesis in Taxus chinensis[J]. Frontiers in Plant Science, 2022, 13: 804593.
|
|
| [100] |
YU CN, HUANG JF, WU QC, ZHANG CC, LI XL, XU XY, FENG SG, ZHAN XR, CHEN ZH, WANG HZ, SHEN CJ. Role of female-predominant MYB39-bHLH13 complex in sexually dimorphic accumulation of taxol in Taxus media[J]. Horticulture Research, 2022, 9: uhac062.
|
|
| [101] |
YU CN, HOU KL, ZHANG HS, LIANG XS, CHEN C, WANG ZJ, WU QC, CHEN GL, HE JX, BAI EH, LI XF, DU TR, WANG YF, WANG MS, FENG SG, WANG HZ, SHEN CJ. Integrated mass spectrometry imaging and single-cell transcriptome atlas strategies provide novel insights into taxoid biosynthesis and transport in Taxus mairei stems[J]. The Plant Journal: for Cell and Molecular Biology, 2023, 115(5): 1243-1260.
|
|
| [102] | |
|
| [103] |
ZHANG M, LI ST, NIE L, CHEN QP, XU XP, YU LJ, FU CH. Two jasmonate-responsive factors, TcERF12 and TcERF15, respectively act as repressor and activator of tasy gene of taxol biosynthesis in Taxus chinensis[J]. Plant Molecular Biology, 2015, 89(4): 463-473.
|
|
| [104] |
REN LP, WAN WY, YIN DD, DENG XH, MA ZX, GAO T, CAO XH. Genome-wide analysis of WRKY transcription factor genes in Toona sinensis: an insight into evolutionary characteristics and terpene synthesis[J]. Frontiers in Plant Science, 2023, 13: 1063850.
|
|
| [105] |
LI S, ZHANG P, ZHANG M, FU C, YU L. Functional analysis of a WRKY transcription factor involved in transcriptional activation of the DBAT gene in Taxus chinensis[J]. Plant Biology, 2013, 15(1): 19-26.
|
|
| [106] |
ZHANG M, CHEN Y, NIE L, JIN XF, LIAO WF, ZHAO SY, FU CH, YU LJ. Transcriptome-wide identification and screening of WRKY factors involved in the regulation of taxol biosynthesis in Taxus chinensis[J]. Scientific Reports, 2018, 8: 5197.
|
|
| [107] |
CHEN Y, ZHANG H, ZHANG M, ZHANG WL, OU ZQ, PENG ZH, FU CH, ZHAO CF, YU LJ. Salicylic acid-responsive factor TcWRKY33 positively regulates taxol biosynthesis in Taxus chinensis in direct and indirect ways[J]. Frontiers in Plant Science, 2021, 12: 697476.
|
|
| [108] |
李罡, 李文龙, 许雪梅, 李成浩. MYC 2转录因子参与植物发育调控的研究进展[J]. 植物生理学报, 2019, 55(2): 125-132. LI G, LI WL, XU XM, LI CH. Research progress of MYC 2 transcription factors participating in plant development and regulation[J]. Plant Physiology Journal, 2019, 55(2): 125-132 (in Chinese).
|
|
| [109] |
LENKA SK, NIMS NE, VONGPASEUTH K, BOSHAR RA, ROBERTS SC, WALKER EL. Jasmonate-responsive expression of paclitaxel biosynthesis genes in Taxus cuspidata cultured cells is negatively regulated by the bHLH transcription factors TcJAMYC1, TcJAMYC2, and TcJAMYC4[J]. Frontiers in Plant Science, 2015, 6: 115.
|
|
| [110] |
ZHANG M, JIN XF, CHEN Y, WEI M, LIAO WF, ZHAO SY, FU CH, YU LJ. TcMYC2a, a basic helix-loop-helix transcription factor, transduces JA-signals and regulates taxol biosynthesis in Taxus chinensis[J]. Frontiers in Plant Science, 2018, 9: 863.
|
|
| [111] |
LIU JCT, de la PEÑA R, TOCOL C, SATTELY ES. Reconstitution of early paclitaxel biosynthetic network[J]. Nature Communications, 2024, 14(1): 1419.
|
|
 2024, Vol. 40
2024, Vol. 40