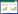中国科学院微生物研究所、中国微生物学会主办
文章信息
- 唐雅倩, 林彩宝, 柯崇榕, 陶勇, 黄建忠, 杨欣伟
- TANG Yaqian, LIN Caibao, KE Chongrong, TAO Yong, HUANG Jianzhong, YANG Xinwei
- 胞磷胆碱的合成策略及研究进展
- Advances in the synthesis of cytidine-5′-diphosphate choline
- 生物工程学报, 2024, 40(6): 1644-1660
- Chinese Journal of Biotechnology, 2024, 40(6): 1644-1660
- 10.13345/j.cjb.230715
-
文章历史
- Received: October 19, 2023
- Accepted: December 19, 2023
- Published: December 20, 2023
2. 中国科学院微生物研究所 中国科学院微生物生理与代谢工程重点实验室, 北京 100101
2. CAS Key Laboratory of Microbial Physiological and Metabolic Engineering, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
胞磷胆碱(cytidine-5′-diphosphate choline, CDP-choline)又名胞苷-5′-二磷酸胆碱、胞二磷胆碱等,是一种核苷衍生物,由核糖、胞嘧啶、焦磷酸和胆碱组成,分子式为C14H26N4O11P2,分子量488.3,结构式如图 1所示。胞磷胆碱钠是胞磷胆碱稳定的钠盐衍生物,是其商品化的主要形式。胞磷胆碱是细胞膜主要成分磷脂酰胆碱的重要前体,参与细胞膜的磷脂双分子层的形成,对于稳定细胞区室化、刺激受损神经元细胞膜的修复和再生等具有重要的作用[1]。此外,胞磷胆碱也是乙酰胆碱的前体物质,可以增加神经递质的水平。因此,胞磷胆碱在缺血、出血所引起的细胞膜功能紊乱和神经退行性疾病中,有明显的临床治疗效果,广泛用于治疗创伤性脑损伤、急性缺血性卒中、认知障碍、帕金森和老年痴呆等[2],现已被中国药典收录作为细胞代谢改善药[3]。美国和欧盟分别于2009年和2014年批准胞磷胆碱作为膳食补充剂,在食品市场,胞磷胆碱被称为“脑营养素”。随着我国人口老龄化的加剧,人们对脑功能保护和改善的需求增加,胞磷胆碱在医药和保健品领域的市场需求量逐步扩大。
|
| 图 1 胞磷胆碱的分子结构式 Fig. 1 The structure of CDP-choline. |
| |
20世纪60年代,日本武田公司首次开发出作为神经保护药物的胞磷胆碱,并以商品名尼可林(Nicholin, Citicoline)上市。1988年,胞磷胆碱被引进我国,至今国内已有上百家胞磷胆碱钠制剂的生产企业和6家获得国家药品监督管理局药品审评中心(Center for Drug Evaluation, CDE)批准的原料药生产企业。然而,受技术因素限制,目前只有苏州正济药业、开平牵牛生化制药有限公司和新乡制药股份有限公司这3家原料药生产企业能够规模化生产胞磷胆碱。胞磷胆碱的生产策略有化学合成法和生物合成法两种,自1956年Kennedy等确定了胞磷胆碱的分子结构之后[4],其化学合成工艺的建立与优化便拉开了序幕,但由于化学合成法效率较低、成本高且污染环境,不是生产胞磷胆碱的首选技术方案。生物合成法利用微生物或细胞中的酶为催化剂生产胞磷胆碱,具有转化效率高、反应条件温和、安全环保等优点,成为了胞磷胆碱的主要生产方式。本文对胞磷胆碱的化学合成与生物合成策略进行了综述,重点关注生物催化法与微生物发酵法的合成途径和研究进展,旨在为胞磷胆碱的高效生产提供参考。
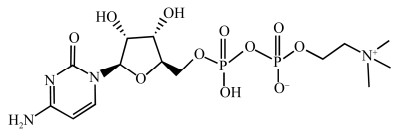
1 胞磷胆碱的生理活性胞磷胆碱是细胞膜的关键成分磷脂酰胆碱的重要前体[5],可以调节膜的流动性、抵抗膜的氧化损伤,如刺激受损神经元细胞膜的修复和再生。此外,胞磷胆碱还可提高胞内神经递质乙酰胆碱的水平。胞磷胆碱进入体内后被水解为胞苷和胆碱,胆碱穿过血脑屏障,和乙酰辅酶A在胆碱乙酰化酶催化下合成乙酰胆碱,提高神经系统兴奋性,改善因缺乏乙酰胆碱而导致的记忆力减退、注意力不集中、反应迟钝和语言功能下降等与认知功能有关的症状[6-7]。除合成乙酰胆碱外,胞磷胆碱还被证实可以提高神经递质多巴胺、去甲肾上腺素和血清素的水平,有助于稳定神经递质系统,促进大脑的能量代谢[8]。研究表明,胞磷胆碱还能通过抑制膜磷脂分解成花生四烯酸,减少炎症、活性氧物质(reactive oxygen species, ROS)的形成和神经元损伤[9],避免神经细胞凋亡或死亡[10]。此外,胞磷胆碱还是大脑代谢的激活剂,可以降低血管的阻力、增加脑血流量,从而改善脑部的血液循环,尤其可使脑干部位血流量增加[11]。总之,胞磷胆碱具有神经保护和神经修复特性,能有效治疗颅脑损伤或脑血管意外引起的神经系统后遗症等。动物学实验和临床研究证实,胞磷胆碱是一种安全性较高的药物,副作用较少且轻微[12-13]。基于它的生理活性,胞磷胆碱已被广泛用于治疗脑血管疾病[14],如血管性痴呆[15-16]、急性缺血性卒中[17]和阿尔茨海默病[18]等。胞磷胆碱辅助治疗帕金森患者具有良好的疗效,对延缓认知障碍的发展、改善运动迟缓以及一定程度的震颤也具有积极作用[19],是现有药物的极佳补充[20]。胞磷胆碱不仅对弱视、斜视、青光眼有改善作用[21-25],还可以缓解抑郁、降低发病率[26]、减轻一氧化碳中毒患者的症状[27]。此外,胞磷胆碱可促进多发性硬化髓鞘再生,可能是治疗髓鞘多发性硬化的新候选药物[28-29],同时对肾脏[30-31]、肺[32]、肝脏[33]等也有一定的保护作用(图 2)。
|
| 图 2 胞磷胆碱的临床应用 Fig. 2 The clinical applications of CDP-choline. |
| |
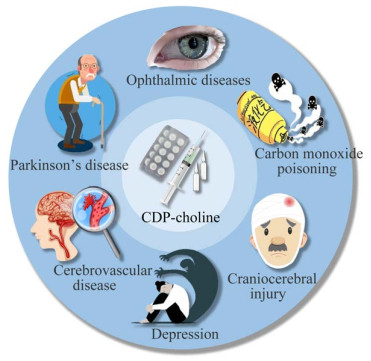
20世纪50年代,Kennedy等以胞苷酸(cytidine 5′-monophosphate, CMP)和磷酸胆碱(choline phosphate)为底物,将N,N-二环己基碳二亚胺(N,N-dicyclohexylcarbodiimide, DCC)作为缩合剂,聚合吡啶等溶剂合成胞磷胆碱[4, 34],开创了胞磷胆碱的化学合成工艺,但是收率仅为46%。研究人员用对甲苯磺酰氯(p-toluenesulfonyl chloride, PTSC)替换DCC作为缩合剂[35-38],并进行工艺优化,收率提高到60%[35]。余中华[39]使用草酰氯替代PTSC作为缩合剂,成本降低了87%,促进胞磷胆碱化学合成法的工业化。具体工艺流程为:以氯化磷酰胆碱钙(calcium phosphorylcholine chloride)为底物,在吡啶中溶解,加苯共沸除水后,加入草酰氯反应0.5−2 h,最后加入CMP制备获得胞磷胆碱[39]。
缩合剂和原料价格是决定化学合成工艺成本的重要因素。为了降低原料成本,部分工艺以CMP和磷酸胆碱的前体或盐为底物,如上述方法用到的氯化磷酰胆碱钙等。Sun等采用核苷磷酰哌啶(nucleoside phosphoryl piperidine)为原料代替CMP,在40 ℃条件下,利用酸性活化剂4,5-二氰基咪唑(4,5-dicyanoimidazole, DCI)和无水N-甲基吡咯烷酮(N-methylpyrrolidone, NMP)与磷酰胆碱偶联,待反应溶液冷却到室温后,过滤分离粗产物,收率可达82%[40-41]。杨邵华等以胞苷(cytidine)、三氯氧磷和磷酸胆碱为原料代替CMP,首先将胞苷和三氯氧磷进行磷酸化,然后直接缩合磷酸胆碱得到中间体,最后经过水解得到粗品胞磷胆碱;进一步采用离子交换树脂处理,精制得到成品胞磷胆碱,总收率达到80%以上[42]。夏然等以廉价易得的二氯磷酰吗啉(morpholinophosphonic dichloride)为原料,加入乙二醇反应,得到乙二醇酯磷酰吗啉;再和CMP缩合,得到乙二醇酯磷酰胞苷酸;最后采用三丁胺对乙二醇酯磷酰吗啉的乙二醇酯开环,得到胞磷胆碱,总收率为78%[43]。上述方法收率有了显著提高,但部分工艺繁杂,副产物较多,胞磷胆碱成品的纯度并未达到原料药的标准。
提高CMP偶联反应效果,可以有效减少副产物、简化纯化工艺并提高胞磷胆碱的纯度。比如,将CMP转换为活性磷酸[44]或磷酰胺[45]等活性中间体。Depaix等在40 ℃条件下,使用2-氯-1,3-二甲基咪唑六氟磷酸盐(2-chloro-1,3-dimethylimidazolinium hexafluorophosphate, DMP)和咪唑(imidazole, Im)在水和乙腈溶液中活化CMP生成磷酰咪唑中间体,磷酰咪唑中间体和氯化磷酰胆碱钙缩合得到胞磷胆碱。该方法条件温和,无二聚体的形成,分离后产品收率为34%[46]。Ghezal等使用N,N′‑羰基二咪唑(N,N′-carbonyldiimidazole, CDI)将CMP转换成活性酯,再和氯化磷酰胆碱钙缩合生成胞磷胆碱,去除了大量可溶性杂质[47]。上述两种方案虽然提高了产品纯度,但是收率低且使用的CDI价格昂贵,无法进行工业化生产(图 3)。陈建峰等使用乙酰氯和反应过程中产生的黏稠物进行反应,乙酰氯加水后容易除去,工艺中的全部溶剂可以回收利用,成本可控且产品纯度达到98%,符合原料药要求[48]。李长松等对磷酸胆碱盐进行保护,将CMP转换成单钠盐或钾盐,然后两者进行缩合反应,有效避免了二聚体的产生,再通过直接结晶,得到高纯度的胞磷胆碱,工艺收率91%,所得成品符合中国药典规定的原料药标准[49]。
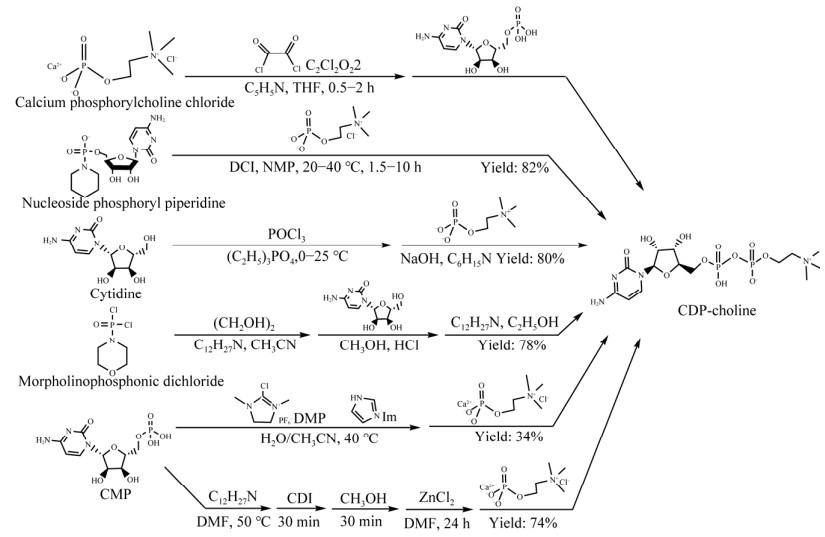
|
| 图 3 不同底物化学合成胞磷胆碱的反应 Fig. 3 Chemical synthesis of CDP-choline using different substrates. The following are key substances: Oxaloyl chloride (C2Cl2O2); Pyridine (C5H5N); Tetrahydrofuran (THF); Phosphorus oxychloride pyridine (POCl3); Triethyl phosphate ((C2H5)3PO4); Triethylamine (C6H15N); Ethylene glycol ((CH2OH)2); Tributylamine (C12H27N); Acetonitrile (CH3CN); Methanol (CH3OH); Ethyl alcohol (C2H5OH); Dimethylformamide (DMF); Zinc chloride (ZnCl2); Sodium hydroxide (NaOH). 以下为关键物质:草酰氯(C2Cl2O2);吡啶(C5H5N);四氢呋喃(THF);三氯氧磷(POCl3);磷酸三乙酯[(C2H5)3PO4];三乙胺(C6H15N);乙二醇[(CH2OH)2];三丁胺(C12H27N);乙腈(CH3CN);甲醇(CH3OH);乙醇(C2H5OH);二甲基甲酰胺(DMF);氯化锌(ZnCl2);氢氧化钠(NaOH) |
| |
胞磷胆碱最早的化学合成工艺采用缩合剂一步法直接缩合CMP和磷酸胆碱,但由于缩合剂昂贵且存在收率低和反应条件剧烈等问题,无法进行工业化推广。随后,开发出以性价比高的缩合剂和底物为原料的多步胞磷胆碱合成工艺,虽然降低了合成成本,但是产品纯度较低、步骤繁琐、反应试剂仍较为昂贵且有毒。目前,工业化的胞磷胆碱化学合成工艺是以胞苷酸和氯化胆碱(choline chloride)为底物的优化合成工艺,大量有机溶剂造成的环保压力以及低合成效率限制了化学合成法的应用与发展(表 1)。因此,胞磷胆碱的化学合成策略被生物合成法逐步替代。
| Substrates | Time | Conversion (%) | Steps | References |
| CMP, choline phosphate | 1956 | 46 | 1 | [34] |
| CMP, choline phosphate | 1971 | 60 | 1 | [35] |
| CMP, choline phosphate | 1971 | 54 | 1 | [36] |
| CMP, choline phosphate | 1975/2007 | 35−40 | 1 | [37-38] |
| CMP, calcium phosphorylcholine chloride | 2014 | NA | 2 | [39] |
| CMP, calcium phosphorylcholine chloride | 2014 | 74 | 5 | [47] |
| Nucleoside phosphoryl piperidine, choline phosphate | 2015 | 82 | 1 | [40-41] |
| CMP, calcium phosphorylcholine chloride | 2016 | NA | 4 | [48] |
| CMP, morpholinophosphonic dichloride | 2016 | 78 | 3 | [43] |
| CMP, calcium phosphorylcholine chloride | 2017 | 34 | 2 | [46] |
| Cytidine, POCl3, choline phosphate | 2021 | 80 | 2 | [42] |
| CMP, choline chloride phosphate | 2021 | 93.7 | 3 | [49] |
| NA: Not available. | ||||
生物合成法选择性强、高效、环境友好且极具市场竞争力,是胞磷胆碱工业和制药应用的优良选择[50]。近年来,对胞磷胆碱生物合成法的研究较多,生物催化法(即体外酶催化法/全细胞催化法)和微生物发酵法是目前主要的生物合成制备方法。
3.1 生物催化法胞磷胆碱的生物合成反应为:1分子的磷酸胆碱与1分子的胞苷5′-三磷酸(cytidine 5′-triphosphate, CTP)在磷酸胆碱胞苷酰转移酶(choline phosphate cytidylyltransferase, CCT)的催化下,生成1分子胞磷胆碱和1分子焦磷酸盐(inorganic pyrophosphate, PPi)。磷酸胆碱和CTP价格较高且不稳定,促使研究者们寻找价格更低且化学性质稳定的前体来作为底物,以降低生产成本,如氯化胆碱、CMP和乳清酸。因此,目前的生物催化法按底物组成可分为2种:一种是以磷酸胆碱(氯化胆碱)和CMP为核心底物(图 4A、4B);另一种是以磷酸胆碱(氯化胆碱)和乳清酸为核心底物(图 4A、C)。而无论是哪种合成反应,都涉及CCT,研究证明CCT是途径中的限速酶[51],提高CCT的催化活性对提升胞磷胆碱生物合成效率极其重要。
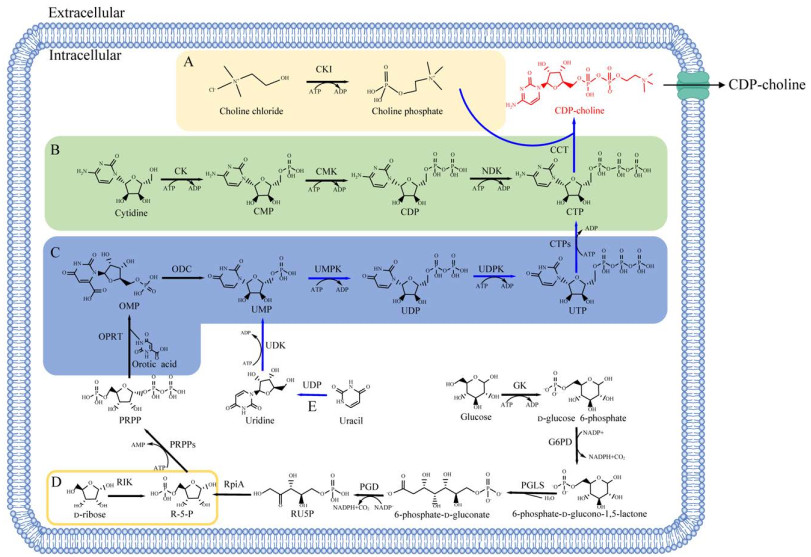
|
| 图 4 不同底物生物合成胞磷胆碱的途径 Fig. 4 The biosynthetic pathway of CDP-choline using different substrates. The following are key enzymes and substances: Choline kinase (CKI); Choline phosphate cytidylyltransferase (CCT); Cytidine kinase (CK); CMP kinase (CMK); CDP kinase (NDK); Orotidine-5′-phosphate decarboxylase (ODC); UMP kinase (UMPK); UDP kinase (UDPK); CTP synthetase (CTPs); Orotate phosphoribosyltransferase (OPRT); Uridine kinase (UDK); Uridine phosphorylase (UDP); Glucokinase (GK); Glucose-6-phosphate dehydrogenase (G6PD); Phosphoribosyl pyrophosphate synthetase (PRPPs); Ribokinase (RIK); Ribose 5-phosphate isomerase A (RpiA); Phosphogluconate dehydrogenase (PGD); 6-phosphogluconolactonase (PGLS); Cytidine-5′-diphosphate choline (CDP-choline); Cytidine 5′-monophosphate (CMP); Cytidine-5′-diphosphocholine (CDP); Cytidine 5′-triphosphate (CTP); Orotidylic acid (OMP); Uridine 5′-monophosphate (UMP); Uridine 5′-diphosphate (UDP); Uridine 5-triphosphate (UTP); 5-phosphoribosyl-1-pyrophosphate (PRPP); D-glucose 6-phosphate (G-6-P); Ribose 5-phosphate (R-5-P); Ribulose 5-phosphate (RU5P); Adenosine triphosphate (ATP); Adenosine diphosphate (ADP); Adenosine monophosphate (AMP). 以下为关键酶和物质:胆碱激酶(CKI);磷酸胆碱胞苷酰转移酶(CCT);胞苷激酶(CK);胞苷一磷酸激酶(CMK);胞苷二磷酸激酶(NDK);乳清酸核苷脱羧酶(ODC);尿嘧啶核苷酸激酶(UMPK);核苷二磷酸激酶(UDPK);CTP合成酶(CTPS);乳清酸磷酸核糖转移酶(OPRT);尿苷激酶(UDK);尿苷磷酸化酶(UDP);葡萄糖激酶(GK);葡萄糖-6-磷酸脱氢酶(G6PD);磷酸核糖焦磷酸激酶(PRPPs);核糖激酶(RIK);5-磷酸核糖异构酶(RpiA);磷酸葡糖酸脱氢酶(PGD);6-磷酸葡糖酸内酯酶(PGLS);胞磷胆碱(CDP-choline);胞苷酸(CMP);胞苷-5′-二磷酸(CDP);胞苷-5′-三磷酸(CTP);乳清酸核苷-5′-单磷酸(OMP);尿苷-5′-单磷酸(UMP);尿苷-5′-二磷酸(UDP);尿苷-5′-三磷酸(UTP);5-磷酸核糖焦磷酸(PRPP);6-磷酸葡萄糖(G-6-P);5-磷酸核糖(R-5-P);5-磷酸核酮糖(RU5P);三磷酸腺苷(ATP);二磷酸腺苷(ADP);磷酸腺苷(AMP) |
| |
CCT是胞磷胆碱合成反应的关键酶,筛选出酶学性质优良的CCT是提高催化效率的一种策略。胡晨龙比较了酿酒酵母(Saccharomyces cerevisiae S288c)、具核梭杆菌(Fusobacterium nucleatum)和肺炎链球菌(Streptococcus pneumoniae)来源的CCT在大肠杆菌的异源表达情况,结果表明,F. nucleatum与S. pneumoniae来源的CCT催化效果相近,并且远优于S. cerevisiae来源的CCT的催化效果[52]。范晓光等进一步研究发现F. nucleatum ATCC 25586来源CCT的比酶活是S. cerevisiae S288c来源CCT的3.12倍[53]。
对CCT进行分子改造是高效稳定催化生产胞磷胆碱的另一策略。Zheng等通过对比不同的宿主和启动子对S. cerevisiae BY4742来源的CCT表达的影响,选择BL21(DE3) (pET28a-CCT)组合构建高活性的CCT,酶活性达到(204±5.17) U/g细胞湿重[54]。在此基础上,缪榕新将人工智能领域的机器学习模型应用于酶改造过程,首先对潜在的催化位点进行定点饱和突变,构建并筛选了441个保持催化活性的突变体,获得1个性能最为优异的预测模型并进行区域性易错PCR建库,在319−349区间上获得了1个相对酶活为野生型1.81倍的最高突变菌株K340T,在工业多酶级联催化过程中产率相较于原体系提高了34.53%[55]。催化体系中添加NaOH或氨水维持pH以及添加乙酰磷酸作为磷源供体,联合乙酸激酶(acetate kinase, ACK)构建ATP循环系统,导致反应后期积累高浓度的磷酸盐和乙酸盐。盐的积累使得CCT活性被抑制,最终导致产量和产物积累速率的降低。因此,利用耐盐酶、酶固定化或在线产品分离来缓解酶抑制尤为重要[56]。最近的研究表明,修饰表面残基可使酶产生耐盐性[57],Wang等[58]根据天然嗜盐酶的特征,对CCT进行理性突变:通过同源建模模拟CCT的结构,选择蛋白质表面最易变化的残基位置作为突变点,替换为酸性氨基酸。将耐盐CCT应用到胞磷胆碱的生产工艺中,最高可合成(161±3.5) mmol/L (82.2 g/L)胞磷胆碱,是生物合成法目前报道的最高产量。该耐盐系统有效解决了反应体系中盐积累带来的抑制问题,具有巨大的工业应用潜力[58]。
晶体结构的确定有助于CCT潜在突变位点的选择,正确选择位点可以极大地提高改造效率,以便于完成酶的理性设计与定向进化,然而目前对该酶的晶体结构解析仅有大鼠来源的CCTα,因此通过理性设计的方法进行人为改造较为困难。未来的研究将集中于解析CCT的晶体结构,以进一步提高突变的有效性。同时,可以寻找CCT酶活保护剂,使其在反应过程中保持酶活,提高能量利用效率。
3.1.2 生物催化法——以磷酸胆碱(氯化胆碱)和CMP为核心底物磷酸胆碱和CTP是胞磷胆碱生物合成的两个关键底物,但由于磷酸胆碱和CTP价格昂贵,大部分的研究以它们的前体作为底物。如氯化胆碱在胆碱激酶(choline kinase, CKI)催化下合成磷酸胆碱(图 4A)。虽然该方法降低了生产成本,但是关键酶CKI的活性普遍不高,在大肠杆菌、酵母以及昆虫细胞中进行过表达时可溶性蛋白表达水平低,难以用于大规模工业化生产[59]。王骏之等通过融合谷胱甘肽S-转移酶(glutathione S-transferase, GST)标签、构建CKI和CCT共表达系统提高了S. cerevisiae S288c来源的CKI的表达水平,含有CCT-CKI融合蛋白的大肠杆菌Rosetta (DE3)/ pET28a- CCT-CKI中CKI酶活达到1.94 U/mg,且大部分蛋白在细胞内可溶表达[60]。乔玮博等通过对野生型S. cerevisiae的CKI进行突变,在具有更高酶活性的突变体CKIKG79‑80DE、CKIS368D、CKIK569E的N端引入来源于丁香假单胞杆菌(Pseudomonas syringae)的inKN标签,反应6 h胞磷胆碱产量最高可达130 mmol/L (66.4 g/L),转化率为92.8%,远高于野生型[59]。为了缓解体外生物合成胞磷胆碱过程中盐的积累导致的反应受限,Zheng等增加S. cerevisiae S288C (NP_013234.1)来源的CKI酶表面酸性残基的数量,提高了其耐盐性,最高可合成(151±3.2) mmol/L (77.1 g/L)胞磷胆碱[61]。
CTP是合成胞磷胆碱的另一个关键底物,有两个合成途径:补救合成途径和从头合成途径。补救合成CTP一般是以CMP (或胞苷)为底物,经过2次(或3次)磷酸化生成CTP (图 4B)。因此,以CMP和氯化胆碱(磷酸胆碱)为底物生产胞磷胆碱的多酶催化体系应运而生,该体系包括CCT、CKI、胞苷一磷酸激酶(CMP kinase, CMK)和胞苷二磷酸激酶(CDP kinase, NDK)。CMP在CMK的催化下合成胞苷5′-二磷酸(cytidine-5′-diphosphocholine, CDP),接着NDK催化CDP生成CTP。
CTP的合成需要消耗ATP,生成副产物ADP来供应能量。Kimura等开发了CGS (CMP-glucose-S. cerevisiae)工艺,该工艺以CMP和氯化胆碱为底物,通过糖酵解途径提供ATP,在酵母细胞中合成胞磷胆碱[62]。除了外源添加和利用葡萄糖糖酵解产生ATP外,工业上还可通过构建ATP循环系统实现ATP再生,从而降低生产成本。Liu等开发了CAE (CMP- acetyl phosphate-Escherichia coli)工艺,该工艺利用E. coli来源的乙酸激酶和乙酰磷酸构建ATP循环系统,并联合E. coli来源的CMK、NDK和S. cerevisiae来源的CCT、CKI催化CMP和氯化胆碱生成胞磷胆碱[56]。同时,由于CMP浓度高时会分解为尿苷和尿嘧啶等[62],从而使CMP的转化率下降,该研究通过流加CMP有效提高了转化率、减少副产物的生成,反应中还使用对酶活性影响更小的KOH代替NaOH调节pH,24 h后,胞磷胆碱最高产量达到(124.1±2.7) mmol/L (63.6 g/L)[56]。另外,也有以ATP和多聚磷酸盐,如六偏磷酸钠作为磷源供体,联合多聚磷酸激酶(polyphosphate kinase, PPK)的ATP循环系统[53, 63]。
CMP作为主要原料是相对昂贵的,尤其是对于大规模工业生产而言。因此,部分研究使用胞苷为原料,在胞苷激酶(cytidine kinase, CK)的催化下合成CMP[64-65]。范晓光等以胞苷、氯化胆碱和ATP为底物,利用来源于类球红细菌(Rhodobacter sphaeroides)的PPK和来源于嗜热栖热菌(Thermophilic thermophiles)的尿苷激酶(uridine kinase, UDK),实现胞苷的磷酸化并为合成胞磷胆碱的多酶催化体系提供能量。反应6 h,产生27.4 mmol/L (14 g/L)胞磷胆碱,胞苷的摩尔转化率达到91.5%[53]。徐庆阳等构建了一株可利用胞苷、氯化胆碱作为底物催化生产胞磷胆碱的重组基因工程菌E. coli CKI‑CCT‑CMK‑NDK‑UDK,其中E. coli来源的UDK可催化胞苷生成CMP,反应30 h合成15 g/L胞磷胆碱[66]。
3.1.3 生物催化法——以磷酸胆碱(氯化胆碱)和乳清酸为核心底物相较于补救合成CTP的路径,利用从头合成途径生产CTP更为经济合理。乳清酸是CTP从头合成途径的关键中间产物,乳清酸在乳清酸磷酸核糖转移酶(orotate phosphoribosyltransferase, OPRT)的催化下与5′-磷酸核糖焦磷酸(5- phosphoribosyl-1-pyrophosphate, PRPP)生成乳清酸核苷酸(orotidylic acid, OMP),再在乳清酸核苷脱羧酶(orotidine-5′-phosphate decarboxylase, ODC)作用下发生脱羧反应合成尿苷酸(uridine 5′-monophosphate, UMP),接着UMP在尿嘧啶核苷酸激酶(UMP kinase, UMPK)和核苷二磷酸激酶(UDP kinase, UDPK)的连续作用下经过2次磷酸化生成尿苷5′-三磷酸(uridine 5-triphosphate, UTP) (图 4C),最后,UTP在CTP合成酶(CTP synthetase, CTPS)的催化下合成CTP。因此,合成胞磷胆碱另一种常见的体系是以乳清酸和磷酸胆碱(氯化胆碱)为底物,搭配OPRT、ODC、UMPK、UDPK、CTPs、CCT和CKI的多酶催化体系。
1997年,Fujio等研发了制备胞磷胆碱的全细胞催化工艺——乳清酸-葡萄糖-产氨棒杆菌-大肠杆菌(orotic acid-glucose-Corynebacterium ammoniagenes-E. coli, OGCE),该工艺以乳清酸、氯化胆碱和葡萄糖为原料底物,首先利用产氨棒杆菌(Corynebacterium ammoniae)的静息细胞将乳清酸转化为UTP,将葡萄糖分解产生ATP,再使用重组大肠杆菌过表达CTPs、CCT以及CKI,将UTP和氯化胆碱转化为胞磷胆碱,32 ℃反应23 h后,产物的积累量、摩尔得率分别达到21.6 mmol/L (11 g/L)、45.7%,证明了一次性混合反应生产胞磷胆碱的可行性[67-68]。在此基础上,Liu等[56]和Zheng等[54]对OGCE中的CTPs、CCT和CKI进行宿主和密码子等参数的优化;通过对比发现大肠杆菌宿主菌株BL21(DE3)、pET24a中T7启动子和产自乳酸乳杆菌(Lactobacillus lactis)的CTPs活性更优,因此选择菌株BL21(DE3) (pET24a-llpyrG)作为酶源,该菌株表达的CTPs活性为(98.1±4.27) U/g细胞湿重;对CCT和CKI也进行了类似的比较,最终选择菌株BL21(DE3) (pET28a-CCT)和Rosetta (DE3) (pET28a-CKI),CCT和CKI活性分别为(204±5.17) U/g细胞湿重和(208.9±9.15) U/g细胞湿重。此外,还降低了菌株培养时对数期氧供,控制催化体系pH 8.5,反应24 h后,胞磷胆碱产量提高到(37.6±1.1) mmol/L (19.2 g/L)[54, 56]。
PRPP是合成CTP的关键中间体,通过5-磷酸核糖(ribose 5-phosphate, R-5-P)在磷酸核糖焦磷酸激酶(phosphoribosyl pyrophosphate synthetase, PRPPs)的催化下合成。OGCE工艺中,R-5-P是以葡萄糖为原料,通过磷酸戊糖途径生成。除此之外,R-5-P也可由D-核糖(D-ribose)在核糖激酶(ribokinase, RIK)的催化下合成(图 4D)。Zheng等设计并优化了一条新的胞磷胆碱体外多酶生产工艺——ORAE,该工艺通过RIK、PRPPs和OPRT这3种酶将D-核糖转化为OMP,然后加入乳清酸将OMP转换为UMP;再以UMP、氯化胆碱为底物,在UMPK、NDK、CTPs、CKI和CCT的催化下将其转化为胞磷胆碱,并应用了高效的乙酸激酶和乙酰磷酸构建的ATP再生模块,最终胞磷胆碱产量为6 g/L[69]。除了OGCE和ORAE工艺中以OMP为前体合成UMP外,日本协和发酵工业株式会社以尿嘧啶为底物,在尿苷磷酸化酶(uridine phosphorylase, UDP)和UDK的催化下生成UMP,再通过一系列酶催化反应制备胞磷胆碱(图 4E,蓝色箭头),产量为12.1 g/L[70]。
上述生物催化生产胞磷胆碱的策略,主要是利用筛选改造酶、优化生产工艺、建立辅因子循环体系以及设计更经济的合成途径等手段,来降低生产成本、提高产量和转化率。除了生物催化法,微生物发酵法在培养细胞的同时进行胞磷胆碱的合成,由于活细胞能够不断产生酶和ATP,生产工艺相对生物催化法更为简便,因此也备受关注。
3.2 微生物发酵法微生物发酵法包括从头发酵法和添加前体物发酵法。胞磷胆碱的发酵,一般以氯化胆碱、CMP或胞苷作为底物,极少数方法以氯化胆碱、葡萄糖为底物,利用微生物细胞内的嘧啶从头合成途径提供CTP。因此下文也将微生物发酵法称为前体发酵法。大肠杆菌和毕赤酵母(Pichia pastoris)作为合成胞磷胆碱的表达宿主是一个较新、值得研究的领域。对工程菌进行改造以获得高产菌株,是前体发酵法的研究重点,主要包括以下几个策略:(1) 筛选、表达与优化胞磷胆碱合成关键酶CCT、CKI;(2) 过表达胆碱转运蛋白,如大肠杆菌的BetT或酵母的ScHnm1,增加外源胆碱运输[71-75];(3) 通过表达或敲除代谢途径的基因来加强CTP的积累,降低CTP的支路代谢;(4) 阻断底物CMP、磷酸胆碱、产物胞磷胆碱的降解;(5) 调节能量代谢,增加细胞内ATP水平;(6) 优化关键底物浓度、培养条件。
外源性胆碱的运输可能是胞磷胆碱合成的一个限制性步骤[76],而进入细胞的胆碱量取决于转运蛋白[77],大肠杆菌自身含有胆碱转运蛋白BetT,可以从外部获取胆碱[75],是潜在的胞磷胆碱生产的新菌种。胡晨龙以野生型大肠杆菌K12 MG1655为出发菌株,在其基因组上整合了S. pneumoniae来源的CKI和CCT,同时通过整合T. thermophiles来源的胞嘧啶核苷激酶编码基因udk、枯草芽孢杆菌(Bacillus subtilis)来源的胞苷酸激酶编码基因cmk和二磷酸核苷激酶编码基因ndk,加强了胞苷到CTP的代谢,以此构建的工程菌MG6以胞苷和氯化胆碱为底物,摇瓶发酵32 h制备胞磷胆碱41.3 mg/g细胞湿重[52]。除过表达关键酶CCT、CKI外,胡志浩等[78]和张玮琪等[79]利用不同的策略对大肠杆菌进行了改良。胡志浩等敲除了胞磷胆碱、胆碱、磷酸胆碱、CTP和UMP降解途径中胞苷-5′-二磷酸‑二酰基甘油焦磷酸酶的编码基因cdh、胞苷-5′-二磷酸醇水解酶的编码基因ushA、尿苷-5′-单磷酸磷酸酶的编码基因umpH/umpG等,过表达BetT,敲除阻遏蛋白编码的基因purR、argR等以解除嘧啶核苷合成的反馈抑制和反馈阻遏,最终5 L发酵罐产20 g/L以上胞磷胆碱[78]。张玮琪等敲除了CTP的降解及利用基因,包括dCTP脱氨酶基因dcd、磷酸核苷激酶基因ndk、核糖核苷三磷酸还原酶基因nrdD和三磷酸核苷焦磷酸水解酶基因mazG,促进底物氯化胆碱高效进入细胞内,并将S. cerevisiae来源的ScCCT酶111位的Val氨基酸残基突变为Ala,构建获得的重组大肠杆菌以氯化胆碱、葡萄糖为底物发酵生产的胞磷胆碱水平可达28.3 g/L[79]。王硕等发现,CDPC-01菌株(天津科技大学代谢工程实验室提供)在发酵后期,大量的Cl−会影响细胞膜合成,抑制三羧酸循环、糖酵解过程,为了消除Cl−对菌体活力的影响,对底物氯化胆碱溶液进行了预处理,即采用A201强碱性阴离子交换树脂吸附Cl−得到胆碱溶液,再向溶液中加入磷酸制备磷酸胆碱。最终5 L罐中胞磷胆碱产量达到了32.2 g/L,为目前国内发酵法生产胞磷胆碱的最高水平[80]。
迄今为止,研究人员以毕赤酵母为底盘合成了多种蛋白质、小分子药物和食品添加剂[81-83],Ren等[76]的研究指出毕赤酵母活细胞是发酵合成胞磷胆碱的可行宿主,过表达酵母胆碱转运蛋白ScHnm1极大地提高了胆碱底物的利用率,提高细胞内ATP水平能够促进胞磷胆碱的合成。据报道,过表达酵母胆碱转运蛋白ScHnm1和溶血素[84-86]可以改善胆碱底物的运输。Ren等[76]在利用CMP和磷酸胆碱(氯化胆碱)作为底物对胞磷胆碱合成途径进行代谢工程改造时,通过过表达酵母胆碱转运蛋白ScHnm1、添加柠檬酸盐、过表达线粒体内的ATP合成酶(mitochondrial ATP synthase small subunit, sATP6)以及对关键底物和培养条件进行正交优化,最终合成胞磷胆碱6 g/L[76]。在此基础上,2021年,Ren等[87]通过敲除5′-核苷酸酶(5′-nucleotidase, 5′-NT)和胞嘧啶核苷脱氨酶(cytidine deaminase, CDA)等的编码基因来阻断CMP和UMP的分支通路,并优化底物浓度,该菌株可以产生29.7 g/L的胞磷胆碱,较前期工作提高了400%;同时,CMP对胞磷胆碱的摩尔产率也从40%提高到84.7% (表 2);与已报道的通透化酵母细胞相比,工程活酵母细胞具有更高的胞磷胆碱产量和更强的合成能力。
| Substrates | Time | CDP-choline production (g/L) | References |
| Biological catalysis | |||
| Choline chloride, orotic acid, glucose | 2021 | 19.2 | [54] |
| Choline chloride, CMP, glucose | 2017 | 63.6 (conversion=83.8%) |
[56] |
| Choline phosphate, CMP | 2018 | 82.2 (conversion=84.2%) |
[58] |
| Choline phosphate, CTP, glucose | 2015 | NA | [60] |
| Choline phosphate, CMP | 2019 | 77.1 (conversion=85.3%) |
[61] |
| Choline chloride, orotic acid, glucose | 1997 | 11.0 | [67] |
| Choline chloride, D-ribose, orotic acid | 2021 | 6.0 | [69] |
| Precursor fermentation | |||
| Choline chloride, cytidine, glucose | 2021 | 41.3 mg/g | [52] |
| Choline chloride, cytidine, glucose | 2020 | 14.0 (conversion=91.5%) |
[53] |
| Choline phosphate, CMP, glucose | 2020 | 6.0 | [76] |
| Choline chloride, glucose | 2017 | 20.0 | [78] |
| Choline chloride, glucose | 2023 | 28.3 | [79] |
| Choline chloride, glucose | 2023 | 32.2 | [80] |
| Choline phosphate, CMP, glucose | 2021 | 29.7 | [87] |
| NA: Not available. | |||
微生物发酵周期较长,导致产能有限,设备利用率比较低。为此,宋臻[88]提出一种新式灌流系统,该灌流系统包括补料系统、循环过滤系统、出料系统、自动控制系统和其他辅助系统[在线清洗系统(cleaning-in-place, CIP系统)和在线灭菌系统(sterilization in-place, SIP系统)],利用物料循环和切向过滤的原理,将生物发酵产物不断分离出来。灌流系统在胞磷胆碱合成工艺中的应用,实现了连续培养的过程,极大提高了产能和产量,有助于增加企业市场竞争力和企业效益[88]。
前体发酵法原料相对低廉,且活细胞可以持续产生酶和ATP,使生物转化过程工艺简单。然而,由于底物进入细胞的障碍[62]以及微生物复杂的代谢调控机制,胞磷胆碱的产量和转化率都较低,目前国内报道的最高产量仅为32.2 g/L[80]。生物催化法采用两步法制备胞磷胆碱,即在加入底物进行生物催化反应前,先进行细胞培养,再对细胞破碎或者通透化处理,整体工艺较为复杂。值得肯定的是,生物催化法利用酶对底物进行催化,专一性强且高效,目前报道的最高产量可达82.2 g/L,转化率为84.2%[58]。除此之外,生物催化法的优化有效降低了生产成本,如催化体系中ATP循环系统的构建以及新途径的引入。总之,在工业生产中,生物催化法制备胞磷胆碱更有优势,但在产量、转化率、成本控制和后续的分离提纯等方面,依然需要进一步探索与提高。
4 结论与展望胞磷胆碱可以改善脑组织代谢、调节脑血管张力及保护脑神经,因此在临床上应用广泛,受到了越来越多的关注。2022年,根据药融云的数据,胞磷胆碱成品药的全国医院销售额接近20亿元,是我国脑保护类临床用量最大的神经激活剂[89]。目前,胞磷胆碱的工业化生产策略主要为生物催化法,虽然已经开发出了多种利用廉价原料的生物合成途径,但其产量与转化率都有进一步提升的空间。未来,随着胞磷胆碱生物合成和代谢调控的深入研究、合成关键酶结构的全面解析、酶的理性设计与定向进化的逐步开展以及合成工艺的持续优化,必将为胞磷胆碱的规模化生产提供更广阔的思路。
| [1] |
GIBELLINI F, SMITH TK. The Kennedy pathway: de novo synthesis of phosphatidylethanolamine and phosphatidylcholine[J]. IUBMB Life, 2010, 62(6): 414-428. DOI:10.1002/iub.337
|
| [2] |
SECADES JJ, GARERI P. Citicoline: pharmacological and clinical review, 2022 update[J]. Revista de Neurologia, 2022, 75(S05): S1-S89. DOI:10.33588/rn.75S05.2022311
|
| [3] |
国家药典委员会. 中华人民共和国药典(一部): 2020年版[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. People's republic of China (PRC) Pharmacopoeia (Part Ⅰ): 2020 Edition[M]. Beijing: China Medical Science Press, 2020 (in Chinese). |
| [4] |
KENNEDY EP. The synthesis of cytidine diphosphate choline, cytidine diphosphate ethanolamine, and related compounds[J]. Journal of Biological Chemistry, 1956, 222(1): 185-191. DOI:10.1016/S0021-9258(19)50784-0
|
| [5] |
ROSSITER RJ, MCMURRAY WC, STRICKLAND KP. Biosynthesis of phosphatides in brain and nerve[J]. Federation Proceedings, 1957, 16(3): 853-855.
|
| [6] |
TAYEBATI SK, AMENTA F. Choline-containing phospholipids: relevance to brain functional pathways[J]. Clinical Chemistry and Laboratory Medicine, 2013, 51(3): 513-521.
|
| [7] |
IULIA C, RUXANDRA T, COSTIN LB, LILIANA-MARY V. Citicoline-a neuroprotector with proven effects on glaucomatous disease[J]. Romanian Journal of Ophthalmology, 2017, 61(3): 152-158. DOI:10.22336/rjo.2017.29
|
| [8] |
WIGNALL ND, BROWN ES. Citicoline in addictive disorders: a review of the literature[J]. The American Journal of Drug and Alcohol Abuse, 2014, 40(4): 262-268. DOI:10.3109/00952990.2014.925467
|
| [9] |
ADIBHATLA RM, HATCHER JF. Citicoline decreases phospholipase A2 stimulation and hydroxyl radical generation in transient cerebral ischemia[J]. Journal of Neuroscience Research, 2003, 73(3): 308-315. DOI:10.1002/jnr.10672
|
| [10] |
GANDOLFI S, MARCHINI G, CAPOROSSI A, SCUDERI G, TOMASSO L, BRUNORO A. Cytidine 5′-diphosphocholine (citicoline): evidence for a neuroprotective role in Glaucoma[J]. Nutrients, 2020, 12(3): 793. DOI:10.3390/nu12030793
|
| [11] |
MIYAZAKI M. Agentss to improve cerebrovascular circulation and cerebral metabolism-citicoline[J]. Nihon Rinsho, 1985, 43(2): 372-375.
|
| [12] |
SECADES JJ, FRONTERA G. CDP-choline: pharmacological and clinical review[J]. Methods and Findings in Experimental and Clinical Pharmacology, 1995, 17(suppl B): 1-54.
|
| [13] |
SECADES JJ. Citicoline: pharmacological and clinical review, 2016 update[J]. Revista de Neurologia, 2016, 63(S03): S1-S73. DOI:10.33588/rn.63S03.2016508
|
| [14] |
朱平华. 胞磷胆碱钠联合奥拉西坦治疗脑出血的临床疗效观察[J]. 中国临床新医学, 2017, 10(10): 996-998. ZHU PH. The clinical efficacy of citicoline sodium and oxiracetam in patients with cerebral hemorrhage[J]. Chinese Journal of New Clinical Medicine, 2017, 10(10): 996-998 (in Chinese). DOI:10.3969/j.issn.1674-3806.2017.10.21 |
| [15] |
王湘慧. 胞磷胆碱和脑活素对合并血管性痴呆的脑血管病患者进行治疗的效果对比评价[J]. 临床医药文献电子杂志, 2017, 4(75): 14804-14806. WANG XH. Comparative evaluation of citicoline and cerebrolysin in the treatment of cerebrovascular disease patients complicated with vascular dementia[J]. Electronic Journal of Clinical Medical Literature, 2017, 4(75): 14804-14806 (in Chinese). DOI:10.3877/j.issn.2095-8242.2017.75.086 |
| [16] |
暴焕英, 潘运高. 胞磷胆碱、多奈哌齐联合治疗血管性痴呆的价值分析[J]. 首都食品与医药, 2019, 26(2): 57. BAO HY, PAN YG. Value analysis of citicoline combined with donepezil in the treatment of vascular dementia[J]. Capital Food Medicine, 2019, 26(2): 57 (in Chinese). DOI:10.3969/j.issn.1005-8257.2019.02.046 |
| [17] |
MEHTA A, MAHALE R, BUDDARAJU K, JAVALI M, ACHARYA P, SRINIVASA R. Efficacy of neuroprotective drugs in acute ischemic stroke: is it helpful?[J]. Journal of Neurosciences in Rural Practice, 2019, 10(4): 576-581. DOI:10.1055/s-0039-1700790
|
| [18] |
ALVAREZ-SABÍN J, ROMÁN GC. Citicoline in vascular cognitive impairment and vascular dementia after stroke[J]. Stroke, 2011, 42(1 suppl): S40-S43.
|
| [19] |
胡耀凯, 张凯. 胞磷胆碱辅助治疗帕金森病患者的效果及对其脑神经功能的影响[J]. 临床研究, 2022, 30(2): 83-86. HU YK, ZHANG K. Effects of citicoline adjuvant therapy for parkinson's patients and its effect on brain nerve function[J]. Clinical Research, 2022, 30(2): 83-86 (in Chinese). |
| [20] |
QUE DS, JAMORA RDG. Citicoline as adjuvant therapy in parkinson's disease: a systematic review[J]. Clinical Therapeutics, 2021, 43(1): e19-e31. DOI:10.1016/j.clinthera.2020.11.009
|
| [21] |
张杰, 赵光辉. 胞磷胆碱钠胶囊治疗弱视的效果观察[J]. 当代医药论丛, 2019, 17(19): 116. ZHANG J, ZHAO GH. Effect of citicoline sodium capsule on amblyopia[J]. Contemporary Medical Symposium, 2019, 17(19): 116 (in Chinese). DOI:10.3969/j.issn.2095-7629.2019.19.088 |
| [22] |
熊留生. 胞磷胆碱钠胶囊治疗弱视的临床效果[J]. 临床合理用药, 2023, 16(2): 152-154. XIONG LS. Clinical effect of citicoline sodium capsule in the treatment of amblyopia[J]. Chinese Journal of Clinical Rational Drug Use, 2023, 16(2): 152-154 (in Chinese). |
| [23] |
LOEBIS R, ZULKARNAIN BS, SISWANTO FA. Effectiveness of citicoline in pediatric patients with refractive amblyopia in Surabaya, East Java, Indonesia[J]. Journal of Basic and Clinical Physiology and Pharmacology, 2021, 32(4): 657-661. DOI:10.1515/jbcpp-2020-0480
|
| [24] |
沈霄霄. 胞二磷胆碱治疗青光眼视神经萎缩的有效性及对患者眼部血流动力学指标的影响[J]. 临床医学研究与实践, 2022, 7(18): 90-92. SHEN XX. Efficacy of cytidine diphosphate choline in the treatment of glaucomatous optic atrophy and its influence on ocular hemodynamics indexes[J]. Clinical Research and Practice, 2022, 7(18): 90-92 (in Chinese). |
| [25] |
陈俊杰, 黄晓燕, 叶良生. 复方血栓通胶囊联合胞二磷胆碱治疗青光眼视神经萎缩的效果观察[J]. 华夏医学, 2020, 33(1): 43-46. CHEN JJ, HUANG XY, YE LS. Effect observation of compound Xueshuantong capsule combined with citicoline in treatment of glaucoma optic atrophy[J]. Acta Medicinae Sinica, 2020, 33(1): 43-46 (in Chinese). |
| [26] |
ROOHI-AZIZI M, ARABZADEH S, AMIDFAR M, SALIMI S, ZARINDAST MR, TALAEI A, AKHONDZADEH S. Citicoline combination therapy for major depressive disorder: a randomized, double-blind, placebo-controlled trial[J]. Clinical Neuropharmacology, 2017, 40(1): 1-5. DOI:10.1097/WNF.0000000000000185
|
| [27] |
黄莹, 樊冬梅. 奥拉西坦与胞磷胆碱联合治疗急性一氧化碳中毒的效果及对患者血液流变学指标与NT-proBNP、MMP-9水平的影响[J]. 中国医药导刊, 2022, 24(12): 1211-1216. HUANG Y, FAN DM. The effect of oxiracetam combined with citicoline on acute carbon monoxide poisoning and its effects on hemorheology indexes, NT-proBNP and MMP-9 levels of the patients[J]. Chinese Journal of Medicinal Guide, 2022, 24(12): 1211-1216 (in Chinese). DOI:10.3969/j.issn.1009-0959.2022.12.012 |
| [28] |
GUDI V, GRIEB P, LINKER RA, SKRIPULETZ T. CDP-choline to promote remyelination in multiple sclerosis: the need for a clinical trial[J]. Neural Regeneration Research, 2023, 18(12): 2599-2605. DOI:10.4103/1673-5374.373671
|
| [29] |
GUDI V, SCHÄFER N, GINGELE S, STANGEL M, SKRIPULETZ T. Regenerative effects of CDP-choline: a dose-dependent study in the toxic cuprizone model of de- and remyelination[J]. Pharmaceuticals (Basel), 2021, 14(11): 1156. DOI:10.3390/ph14111156
|
| [30] |
BUELNA-CHONTAL M, FRANCO M, HERNÁNDEZ-ESQUIVEL L, PAVÓN N, RODRÍGUEZ-ZAVALA JS, CORREA F, JASSO R, PICHARDO-RAMOS G, SANTAMARÍA J, GONZÁLEZ-PACHECO H, SOTO V, DÍAZ-RUÍZ JL, CHÁVEZ E. CDP-choline circumvents mercury-induced mitochondrial damage and renal dysfunction[J]. Cell Biology International, 2017, 41(12): 1356-1366. DOI:10.1002/cbin.10871
|
| [31] |
BARIS E, SIMSEK O, ARICI MA, TOSUN M. Choline and citicoline ameliorate oxidative stress in acute kidney injury in rats[J]. Bratislavske Lekarske Listy, 2023, 124(1): 47-52.
|
| [32] |
DOOLITTLE LM, BINZEL K, NOLAN KE, CRAIG K, ROSAS LE, BERNIER MC, JOSEPH LM, WOODS PS, KNOPP MV, DAVIS IC. Cytidine 5′-diphosphocholine corrects alveolar type Ⅱ cell mitochondrial dysfunction in influenza-infected mice[J]. American Journal of Respiratory Cell and Molecular Biology, 2022, 66(6): 682-693. DOI:10.1165/rcmb.2021-0512OC
|
| [33] |
ZAZUETA C, BUELNA-CHONTAL M, MACÍAS-LÓPEZ A, ROMÁN-ANGUIANO NG, GONZÁLEZ-PACHECO H, PAVÓN N, SPRINGALL R, ARANDA-FRAUSTO A, BOJALIL R, SILVA-PALACIOS A, VELÁZQUEZ-ESPEJEL R, ARZATE SG, CORREA F. Cytidine-5′-diphosphocholine protects the liver from ischemia/reperfusion injury preserving mitochondrial function and reducing oxidative stress[J]. Liver Transplantation: Official Publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society, 2018, 24(8): 1070-1083. DOI:10.1002/lt.25179
|
| [34] |
KENNEDY EP, WEISS SB. The function of cytidine coenzymes in the biosynthesis of phospholipides[J]. Journal of Biological Chemistry, 1956, 222(1): 193-214. DOI:10.1016/S0021-9258(19)50785-2
|
| [35] |
KIKUGAWA K, ICHINO M. Synthesis of a nucleotide coenzyme, CDP-choline[J]. Chemical and Pharmaceutical Bulletin, 1971, 19(5): 1011-1016. DOI:10.1248/cpb.19.1011
|
| [36] |
KIKUGAWA K, ICHINO M, KAWASHIMA T. Studies on the vilsmeier-haack reaction. Ⅲ. Synthesis of cytidine diphosphate choline[J]. Chemical and Pharmaceutical Bulletin, 1971, 19(12): 2466-2471. DOI:10.1248/cpb.19.2466
|
| [37] |
胞嘧啶核苷二磷酸胆碱的制备[J]. 生物化学与生物物理进展, 1975(1): 19-24. Synthesis of cytidine diphosphate choline[J]. Progress in Biochemistry and Biophysics, 1975(1): 19-24 (in Chinese). |
| [38] |
顾复昌, 杨亮懿. 胞二磷胆碱的生产[J]. 发酵科技通讯, 2007, 36(1): 9-11. GU FC, YANG LY. Production of cytidine diphosphate choline[J]. Bulletin of Fermentation Science and Technology, 2007, 36(1): 9-11 (in Chinese). |
| [39] |
余中华. 一种利用草酰氯制备胞磷胆碱钠的方法: CN104004040A[P]. 2014-08-27. YU ZH. A method for synthesizing citicoline sodium by oxaloyl chloride: CN104004040A[P]. 2014-08-27 (in Chinese). |
| [40] |
SUN Q, LI XC, GONG SS, SUN J, WANG CJ, WANG XC. Efficient synthesis of cytidine diphosphate choline (CDP-choline) and its analogs[J]. Nucleosides, Nucleotides and Nucleic Acids, 2015, 34(6): 379-387. DOI:10.1080/15257770.2015.1004340
|
| [41] |
孙麒, 龚珊珊, 李小川, 孙剑. 一种合成核苷二磷酸胆碱钠盐的方法: CN104592335A[P]. 2015-05-06. SUN Q, GONG SS, LI XC, SUN J. A method for synthesizing the nucleoside diphosphate choline sodium salt: CN104592335A[P]. 2015-05-06 (in Chinese). |
| [42] |
杨邵华, 李涛, 靳海燕, 王德地, 石田清, 张赛楠. 一种合成胞二磷胆碱钠的方法: CN114057813B[P]. 2023-06-02. YANG SH, LI T, JIN HY, WANG DD, SHI TQ, ZHANG SN. A method for synthesizing citicoline sodium: CN114057813B[P]. 2023-06-02 (in Chinese). |
| [43] |
夏然, 陈磊山, 孙莉萍, 王艳. 一种胞二磷胆碱及不使用氯化磷酸胆碱钙的胞二磷胆碱的合成方法: CN105693798A[P]. 2016-06-22. XIA R, CHEN LS, SUN LP, WANG Y. A method for synthesizing cytidine diphosphate choline without calcium choline phosphate chloride: CN105693798A[P]. 2016-06-22 (in Chinese). |
| [44] |
KURIHARA T, YAMAMOTO I, HATA T. A novel method for the synthesis of cytidine diphosphate-choline[J]. Bulletin of the Chemical Society of Japan, 1975, 48(3): 1077-1078. DOI:10.1246/bcsj.48.1077
|
| [45] |
VARLAMOVA TV, KOLODKINA Ⅱ, YURKEVICH AM. Simple synthesis of cytidine diphosphate choline[J]. Pharmaceutical Chemistry Journal, 1989, 23(11): 932-935. DOI:10.1007/BF00764626
|
| [46] |
DEPAIX A, PEYROTTES S, ROY B. One‐pot synthesis of nucleotides and conjugates in aqueous medium[J]. European Journal of Organic Chemistry, 2017(2): 241-245.
|
| [47] |
GHEZAL S, THOMASSON MS, LEFEBVRE-TOURNIER I, PÉRIGAUD C, MACNAUGHTAN MA, ROY B. CDP-ethanolamine and CDP-choline: one-pot synthesis and 31P NMR study[J]. Tetrahedron Letters, 2014, 55(38): 5306-5310. DOI:10.1016/j.tetlet.2014.07.076
|
| [48] |
陈建峰, 孟浩影. 一种胞磷胆碱钠的制备方法: CN106146590A[P]. 2016-11-23. CHEN JF, MENG HY. A method for synthesizing citicoline sodium: CN106146590A[P]. 2016-11-23 (in Chinese). |
| [49] |
李长松, 陈埔, 刘乙平, 李英富. 一种化合物及其制备方法、该化合物制备胞磷胆碱的方法、应用: CN114106043A[P]. 2022-03-01. LI CS, CHEN P, LIU YP, LI YF. A compound and its synthesis, a method and application for synthesizing cytidine diphosphate choline: CN114106043A[P]. 2022-03-01 (in Chinese). |
| [50] |
SHIN KC, OH DK. An integrative approach to improving the biocatalytic reactions of whole cells expressing recombinant enzymes[J]. World Journal of Microbiology and Biotechnology, 2021, 37(6): 105. DOI:10.1007/s11274-021-03075-6
|
| [51] |
LYKIDIS A. Comparative genomics and evolution of eukaryotic phospholipid biosynthesis[J]. Progress in Lipid Research, 2007, 46(3-4): 171-199. DOI:10.1016/j.plipres.2007.03.003
|
| [52] |
胡晨龙. 代谢工程改造大肠杆菌制备胞二磷胆碱[D]. 天津: 天津科技大学硕士学位论文, 2021. HU CL. Metabolic engineering of Escherichia coli for CDP-choline production[D]. Tianjin: Master's Thesis of Tianjin University of Science and Technology, 2021 (in Chinese). |
| [53] |
范晓光, 胡晨龙, 宋雪静, 安俊侠, 谢希贤, 徐庆阳. 制备胞二磷胆碱用酶制剂以及酶催化制备胞二磷胆碱的方法: CN112481233A[P]. 2021-03-12. FAN XG, HU CL, SONG XJ, AN JX, XIE XX, XU QY. Method for preparing cytidiphosphocholine by enzyme preparation and enzymatic catalysis: CN112481233A[P]. 2021-03-12 (in Chinese). |
| [54] |
ZHENG C, MIAORX, LIU YM, CAO Y, LIU D, WANG JZ, YING HJ. A procedure to design one-pot multi-enzyme system for industrial CDP-choline production[J]. Applied Biochemistry and Biotechnology, 2021, 193(9): 2769-2780. DOI:10.1007/s12010-021-03564-2
|
| [55] |
缪榕新. 机器学习辅助下的磷酸胆碱胞苷酰转移酶活性改造[D]. 郑州: 郑州大学硕士学位论文, 2022. MIAO RX. Improve the catalytic activity of phosphorylcholine cytidyltransferase with machine learning[D]. Zhengzhou: Master's Thesis of Zhengzhou University, 2022 (in Chinese). |
| [56] |
LIU YM, WANG JZ, XU CM, CHEN Y, YANG JJ, LIU D, NIU HQ, JIANG Y, YANG S, YING HJ. Efficient multi-enzyme-catalyzed CDP-choline production driven by an ATP donor module[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1409-1417. DOI:10.1007/s00253-016-7874-0
|
| [57] |
WARDEN AC, WILLIAMS M, PEAT TS, SEABROOK SA, NEWMAN J, DOJCHINOV G, HARITOS VS. Rational engineering of a mesohalophilic carbonic anhydrase to an extreme halotolerant biocatalyst[J]. Nature Communications, 2015, 6: 10278. DOI:10.1038/ncomms10278
|
| [58] |
WANG JZ, ZHENG C, CAO Y, TAN ZT, LIU D, CHENG ZP, YING HJ, NIU HQ. Rational design of an efficient halotolerant enzymatic system for in vitro one-pot synthesis of cytidine diphosphate choline[J]. Biotechnology Journal, 2018, 13(7): e1700577. DOI:10.1002/biot.201700577
|
| [59] |
乔玮博, 马成伟, 李杰, 林振泉. 胆碱激酶突变体及其在胞磷胆碱生产中的应用: CN116240193A[P]. 2023-06-09. QIAO WB, MA CW, LI J, LIN ZL. Choline kinase mutant and its application in the production of citicoline: CN116240193A[P]. 2023-06-09 (in Chinese). |
| [60] |
王骏之, 应汉杰. 胞磷胆碱生产过程中的关键酶: 胆碱激酶的表达优化[C]. 中国生物工程学会第六次全国会员代表大会暨第九届学术年会, 中国生物工程学会, 中国上海. 2015: 43-51. WANG JZ, YING HJ. Optimization of the expression of choline kinase, a key enzyme in the production of citicoline[C]. The Sixth National Member Congress and the Ninth Academic Annual Conference of the Chinese Society of Biotechnology, Chinese Society of Biotechnology, China, Shanghai, 2015: 43-51 (in Chinese). |
| [61] |
ZHENG C, LI Z, YANG H, ZHANG T, NIU H, LIU D, WANG J, YING H. Computation-aided rational design of a halophilic choline kinase for cytidine diphosphate choline production in high-salt condition[J]. Journal of Biotechnology, 2019, 290: 59-66. DOI:10.1016/j.jbiotec.2018.11.008
|
| [62] |
KIMURA A, MORITA M, TOCHIKURA T. Fermentative production of CDP-choline by yeasts[J]. Agricultural and Biological Chemistry, 1971, 35(12): 1955-1960.
|
| [63] |
李国庆, 李思琦. 一种利用胞苷酶法合成胞磷胆碱钠的方法: CN114262726A[P]. 2022-04-01. LI GQ, LI SQ. A enzymic method for synthesizing citicoline sodium using cytidine: CN114262726A[P]. 2022-04-01 (in Chinese). |
| [64] |
LI ZL, NING X, ZHAO YR, ZHANG XD, XIAO C, LI ZM. Efficient one-pot synthesis of cytidine 5′-monophosphate using an extremophilic enzyme cascade system[J]. Journal of Agricultural and Food Chemistry, 2020, 68(34): 9188-9194.
|
| [65] |
FAN XG, XIE XX, WU SJ, HU CL, SONG XJ, GE Y, CHEN N, XU QY, ZHANG CL, LI YJ, MA Q. Method for the enzymatic production of uridine monophosphate and cytidine monophosphate: AU2019101117A4[P]. 2020-02-20.
|
| [66] |
徐庆阳, 王硕, 王锐麒. 一种生产胞磷胆碱的基因工程菌及其构建方法与应用: CN116144559A[P]. 2023-05-23. XU QY, WANG S, WANG RQ. A genetically engineered bacterium producing citicoline and its construction method and application: CN116144559A[P]. 2023-05-23 (in Chinese). |
| [67] |
FUJIO T, MARUYAMA A. Enzymatic production of pyrimidine nucleotides using corynebacterium ammoniagenes cells and recombinant Escherichia coli cells: enzymatic production of CDP-choline from orotic acid and choline chloride (part I)[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(6): 956-959.
|
| [68] |
FUJIO T, TESHIBA S, MARUYAMA A. Construction of a plasmid carrying both CTP synthetase and a fused gene formed from cholinephosphate cytidylyltransferase and choline kinase genes and its application to industrial CDP-choline production: enzymatic production of CDP-choline from orotic acid (part Ⅱ)[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(6): 960-964.
|
| [69] |
ZHENG C, QU MJ, LIU YM, WANG JZ, YING HJ. Design and optimizing a new CDP-choline in vitro multienzyme producing process starts from D-ribose[J]. Biotechnology and Applied Biochemistry, 2022, 69(3): 1029-1035.
|
| [70] |
桥本信一, 小田秀树. 胞苷5′-二磷酸胆碱的制备方法: CN1653188[P]. 2005-08-10. HASHIMOTO S, ODA H. Synthetic method of cytidine 5′-choline diphosphate: CN1653188[P]. 2005-08-10 (in Chinese). |
| [71] |
FERNÁNDEZ-MURRAY JP, GASPARD GJ, JESCH SA, MCMASTER CR. NTE1-encoded phosphatidylcholine phospholipase b regulates transcription of phospholipid biosynthetic genes[J]. Journal of Biological Chemistry, 2009, 284(52): 36034-36046.
|
| [72] |
MURRAY JPF, MCMASTER CR. Nte1p-mediated deacylation of phosphatidylcholine functionally interacts with Sec14p[J]. Journal of Biological Chemistry, 2005, 280(9): 8544-8552.
|
| [73] |
NIKAWA J, HOSAKA K, TSUKAGOSHI Y, YAMASHITA S. Primary structure of the yeast choline transport gene and regulation of its expression[J]. Journal of Biological Chemistry, 1990, 265(26): 15996-16003.
|
| [74] |
NIKAWA J, TSUKAGOSHI Y, YAMASHITA S. Cloning of a gene encoding choline transport in Saccharomyces cerevisiae[J]. Journal of Bacteriology, 1986, 166(1): 328-330.
|
| [75] |
TØNDERVIK A, STRØM AR. Membrane topology and mutational analysis of the osmotically activated BetT choline transporter of Escherichia coli[J]. Microbiology, 2007, 153(3): 803-813.
|
| [76] |
REN YN, LIU Q, LIU HF, ZHOU XS, ZHANG YX, CAI MH. Engineering substrate and energy metabolism for living cell production of cytidine-5′-diphosphocholine[J]. Biotechnology and Bioengineering, 2020, 117(5): 1426-1435.
|
| [77] |
FERNÁNDEZ-MURRAY JP, NGO MH, MCMASTER CR. Choline transport activity regulates phosphatidylcholine synthesis through choline transporter Hnm1 stability[J]. Journal of Biological Chemistry, 2013, 288(50): 36106-36115.
|
| [78] |
胡志浩, 江君君, 范俊英, 刘爱霞, 秦天宇, 田锋, 张凯林, 王欣彤. 一种生产胞二磷胆碱的重组微生物及生产胞二磷胆碱的方法: CN109207415B[P]. 2022-09-16. HU ZH, JIANG JJ, FAN JY, LIU AX, QIN TY, TIAN F, ZHANG KL, WANG XT. A recombinant microbe for producing cytidiphosphocholine and a method for producing cytidiphosphocholine: CN109207415B[P]. 2022-09-16 (in Chinese). |
| [79] |
张玮琪, 张剑. 一种生产胞二磷胆碱的方法: CN116445385A[P]. 2023-07-18. ZHANG WQ, ZHANG J. A method for producing cytidiphosphate choline: CN116445385A[P]. 2023-07-18 (in Chinese). |
| [80] |
王硕, 刘玮韪, 李旭, 徐庆阳. 底物及底物处理方法对胞磷胆碱发酵的影响[J/OL]. [2023-12-15]. https://doi.org/10.13995/j.cnki.11-1802/ts.037042. WANG S, LIU WW, LI X, XU QY. Effect of substrate and substrate treatment on the fermentation of cytosolic choline[J/OL]. [2023-12-15]. https://doi.org/10.13995/j.cnki.11-1802/ts.037042 (in Chinese). |
| [81] |
SAFDER I, KHAN S, ISLAM IU, ALI MK, WAQAS M. Pichia pastoris expression system: a potential candidate to express protein in industrial and biopharmaceutical domains[J]. Biomedical Letters, 2018, 4(1): 1-14.
|
| [82] |
MEEHL MA, STADHEIM TA. Biopharmaceutical discovery and production in yeast[J]. Current Opinion in Biotechnology, 2014, 30: 120-127.
|
| [83] |
PEÑA DA, GASSER B, ZANGHELLINI J, STEIGER MG, MATTANOVICH D. Metabolic engineering of Pichia pastoris[J]. Metabolic Engineering, 2018, 50: 2-15.
|
| [84] |
CHEN JD, LAI SY, HUANG SL. Molecular cloning, characterization, and sequencing of the hemolysin gene from Edwardsiella tarda[J]. Archives of Microbiology, 1996, 165(1): 9-17.
|
| [85] |
HIRONO I, TANGE N, AOKI T. Iron-regulated haemolysin gene from Edwardsiella tarda[J]. Molecular Microbiology, 1997, 24(4): 851-856.
|
| [86] |
WEN Y, CHEN SW, JIANG ZW, WANG Z, TAN JC, HU TJ, WANG QY, ZHOU XS, ZHANG YX, LIU Q, YANG DH. Dysregulated haemolysin promotes bacterial outer membrane vesicles-induced pyroptotic-like cell death in zebrafish[J]. Cellular Microbiology, 2019, 21(6): e13010.
|
| [87] |
REN YN, LIU Q, LIU HF, ZHOU XS, ZHANG YX, CAI MH. High-level living cell production of cytidine-5′-diphosphocholine in metabolically engineered yeast[J]. Journal of Biotechnology, 2021, 341: 129-136.
|
| [88] |
宋臻. 一种新式灌流系统在胞磷胆碱合成中的应用[J]. 发酵科技通讯, 2015, 44(2): 34-38. SONG Z. Application of a new perfusion system in CDPC biosynthesis[J]. Bulletin of Fermentation Science and Technology, 2015, 44(2): 34-38 (in Chinese). |
| [89] |
年产100吨生物酶转化产品胞磷胆碱、胞磷胆碱钠项目(附胞磷胆碱钠浅析)[EB/OL]. [2023-11-20]. https://mp.weixin.qq.com/s/NdOrTG-3Zou3RweIUZnEhg.
|
 2024, Vol. 40
2024, Vol. 40