中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李园子, 高靖怡, 王凤寰, 廖永红
- LI Yuanzi, GAO Jingyi, WANG Fenghuan, LIAO Yonghong
- 2-苯乙醇合成研究进展
- Advances in synthesis of 2-phenylethanol
- 生物工程学报, 2024, 40(6): 1694-1710
- Chinese Journal of Biotechnology, 2024, 40(6): 1694-1710
- 10.13345/j.cjb.230762
-
文章历史
- Received: November 5, 2023
- Accepted: March 25, 2024
- Published: April 12, 2024
2-苯乙醇是许多植物果实和鲜花香气的重要贡献成分,也是葡萄酒、黄酒、啤酒和面包等多种发酵食品中含有的风味物质,广泛应用于化工、医药、食品等行业中[1]。2-苯乙醇的全球年产量超过10 000 t,是全球用量第二大的香料物质[2-3]。
2-苯乙醇的分子式为C8H10O,分子量为122.17,相对密度为1.02,相对折光指数为1.53,熔点为−27 ℃,闪点为102 ℃,沸点为219−221 ℃,在常温常压下是具有挥发性的无色液体,易溶于醇、酯和醛等有机溶剂,能溶于水,1 L水中可溶解21.99 g的2-苯乙醇(25 ℃)[4]。
芳香族氨基酸生物合成途径及其下游分支是最有价值的生物合成途径之一,从这一途径衍生的产品范围广泛,涵盖大宗化学品、特种化学品以及高附加值天然产品等领域[5]。2-苯乙醇具有诸多生物学功能。2-苯乙醇能用作植物保鲜剂,保护植物果实和鲜花。当2-苯乙醇浓度介于2−3 g/L之间时,能完全抑制大部分细菌和真菌的生长,可以用作天然杀菌剂。Sun等[6]研究了2-苯乙醇的生物防治功能,发现2-苯乙醇可破坏禾谷镰刀菌(Fusarium graminearum)细胞结构,抑制其产生霉菌毒素,从而控制小麦黑星病。Zou等[7]发现1种酵母(Scheffersomyces spartinae)产生的挥发性有机化合物(volatile organic compounds, VOCs)对草莓果实上的灰霉菌具有抗真菌作用,其中以2-苯乙醇的抗真菌活性最强。Lu等[8]发现2-苯乙醇可阻断氧化磷酸化途径,抑制致病疫霉菌(Phytophthora infestans)的ATP生成,使病原菌死亡,从而防治马铃薯晚疫病。2-苯乙醇还能作为底物合成其他高附加值的化合物,如苯乙酸乙酯既可以作为香料又可以配制神经类药物;苯乙醇苷具有抗菌、抗病毒、抗肿瘤等作用[9-10]。
在自然界中,2-苯乙醇主要存在于裸子植物、被子植物及以鲜花或果实为原料提取的精油中。2-苯乙醇既可以天然提取,也可以通过化学或生物方法合成。由于在植物中天然提取2-苯乙醇产量很低,工业化量产2-苯乙醇大多通过化学合成法进行生产[3]。由于化学合成法具有环境不友好、副产物多、“天然性”不足等缺点,越来越多研究开始集中于改造植物或微生物进行生物合成。本文综述了2-苯乙醇的合成方法,阐述了微生物从头合成2-苯乙醇的研究进展,对2-苯乙醇生物合成研究前景进行展望,以期为2-苯乙醇工业化合成提供思路。
1 2-苯乙醇的合成方法 1.1 化学法合成2-苯乙醇的研究现状化学合成法是以工业化合物为原料通过化学反应合成2-苯乙醇的方法。1876年Radziesewski最早在实验室中用钠还原苯乙醛得到2-苯乙醇[11]。但金属钠性质活泼,反应剧烈,反应过程剧烈放热,因此钠还原2-苯乙醇十分危险。此后,研究人员不断探索工业化量产2-苯乙醇的化学合成方法,并取得了一定的研究成果。目前工业上主要采用苯-环氧乙烷合成法和氧化苯乙烯催化加氢法合成2-苯乙醇,两种方法的产量之比约为4:6[12]。
1.1.1 苯-环氧乙烷合成法苯-环氧乙烷合成法又称傅克反应法,在1925年由Schaarschmidt首先发现[13]。Mamedov[14]以苯和环氧乙烷为原料,使用无水氯化铝作为催化剂,在惰性气体的保护下催化水解生成2-苯乙醇。傅克反应法具有反应条件苛刻、保护气和催化剂使用量大、原料浪费严重、产物收率低、产品杂质较多且难以分离精制等缺点,导致产物香气差异较大且大多不能用作生产香料的原料,因此逐渐被市场淘汰[11]。
1.1.2 氧化苯乙烯加氢法目前主要采用氧化苯乙烯催化加氢法生产2-苯乙醇。首先氧化苯乙烯氧化生成环氧苯乙烷,然后环氧苯乙烷在催化剂的作用下催化加氢生成2-苯乙醇。氧化苯乙烯加氢法对氧化苯乙烯的纯度和反应设备要求很高,催化剂和助剂高度影响反应的选择性,进而影响反应产物的生成。但氧化苯乙烯加氢法使用的原料来源广泛,合成步骤简单,副产物少,收率高,且经一般分离精制即可得到香料级的2-苯乙醇,适宜进行工业化大规模生产[15]。
1.1.3 其他化学合成法苯乙烯氢卤化法由苯乙烯和卤化氢通过加成反应生成得到2-苯基卤乙烷,再使用弱碱水解得到2-苯乙醇,但未见报道投入工业化生产。甲苯法以甲苯为原料经多步反应最后生成2-苯乙醇,由于中间产物多,反应步骤复杂,且使用了剧毒物质氰化钾,目前已被市场淘汰。硼氢化反应法以苯乙烯为原料,使用过渡金属参与催化反应,使苯乙烯硼氢化生成2-苯乙醇,此法往往需要制备相应的催化反应体系,过渡金属价格昂贵,无法进行大规模工业化生产。
申屠有德等[16]以氯苯为原料,经格氏反应生成苯基氯化镁格氏试剂,再与环氧乙烷缩合水解得到2-苯乙醇。王朝阳等[17]在此基础上,对温度、溶剂和物料配比等因素进行优化,最终获得纯度99.8%的2-苯乙醇,收率为88%。虽然格氏试剂法在实验室内取得比较好的成果,但其使用的原料较为危险,反应条件苛刻,不易控制,反应步骤长,反应产物纯化步骤复杂,不适合工业化大规模生产。
1.2 植物合成2-苯乙醇的研究进展在自然界中,2-苯乙醇主要存在于玫瑰、番茄等花卉和植物组织中,但大部分植物与果实中2-苯乙醇的含量都很低,2-苯乙醇主要从玫瑰花中提取,一般每5 t玫瑰鲜花仅能萃取出1 kg 2-苯乙醇[15]。但玫瑰花瓣价格昂贵,并且2-苯乙醇在植物中浓度低,提取工艺复杂,萃取过程费时费力,难以大量生产,天然2-苯乙醇在市场上供不应求。为了探索高效合成2-苯乙醇的方法,明确2-苯乙醇对植物香气特征的影响,需要对植物中2-苯乙醇的合成路径进行研究。目前已有在番茄、玫瑰、葡萄和甜瓜等植物植株和果实中合成2-苯乙醇路径的研究报道。部分植物中2-苯乙醇合成途径见图 1。
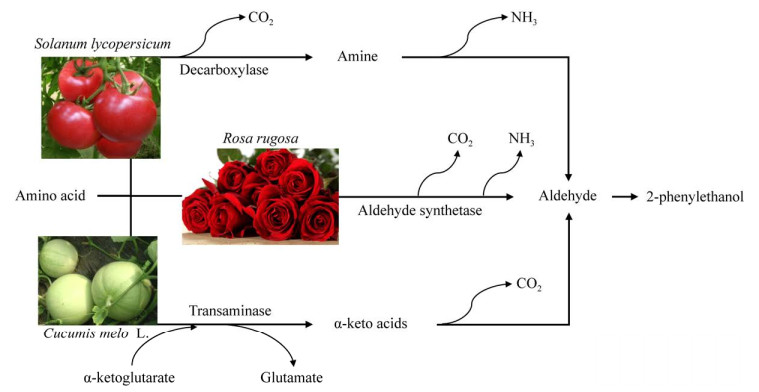
|
| 图 1 部分植物中2-苯乙醇合成路径 Fig. 1 Pathways of 2-PE synthesis in some plants. |
| |
早在2006年,Tieman等[18]就已开始进行番茄中挥发性香气物质合成代谢路径的研究。2-苯乙醇含有1个苯环,它可以由苯丙氨酸脱去羧基和氨基而得到。如果先脱去羧基,中间产物为苯乙胺,如果先脱去氨基,中间产物为苯丙酮酸。使用13C标记l-苯丙氨酸,采用同位素示踪法,确定了番茄中的2-苯乙醇代谢路径——苯乙胺途径:l-苯丙氨酸经芳香族氨基酸脱羧酶(aromatic amino acid decarboxylase, AADC)催化生成苯乙胺,苯乙胺经单胺氧化酶(monoamine oxidase, MAO)催化生成苯乙醛,最后经苯乙醛还原酶(phenylacetaldehyde reductase, PAR)催化生成2-苯乙醇。在番茄中建立了2-苯乙醇的代谢路径后,Tieman等[18]对番茄中2-苯乙醇合成路径第一步关键酶系编码基因AADC进行了研究,筛选得到2个具有芳香族氨基酸脱羧酶活性的编码基因LeAADC1A和LeAADC1B以及1个具有苯丙氨酸脱羧酶活性的编码基因LeAADC2,过表达这3种基因,发现任一基因过表达均能显著提高2-苯乙醇的产量。此后又发现了2种苯乙醛还原酶编码基因LePAR1和LePAR2,在矮牵牛花中异源表达2种基因的cDNA,发现改造后的矮牵牛花中2-苯乙醇含量明显提高。Tikunov等[19]以成熟番茄果实为研究对象,根据番茄全基因组注释,预测11个可能与挥发性成分差异积累有关的基因,其中,位于54.58 Mbp由Solyc04g063350编码的蛋白质显示出与具有脱羧酶活性的3-甲基-2氧代丁酸脱氢酶的高度相似性,将其命名为FLORAL4。利用CRISPR-Cas9基因编辑技术在FLORAL4基因中引入有害突变,对番茄初级代谢产物进行分析,发现芳香族挥发性化合物显著降低,证明FLORAL4基因是影响2-苯乙醇积累的关键基因。Li等[20]鉴定出1种番茄醛/酮还原酶编码基因Sl-AKR9,该基因与番茄中2-苯乙醇的含量变化有关。使用CRISPR-Cas9技术诱导Sl-AKR9产生有害突变,使其丧失原有功能,发现番茄果实中2-苯乙醛的积累显著增加,而2-苯乙醇的含量明显下降,证明Sl-AKR9基因能显著催化2-苯乙醛生成2-苯乙醇。
1.2.2 玫瑰中2-苯乙醇合成路径研究现状作为一种具有玫瑰香味的化合物,2-苯乙醇在玫瑰中的含量远远高于在其他植物中的含量,因此许多研究都选择以玫瑰为对象进行研究。Bugorskiĭ等[21]首次报道了玫瑰花瓣中的2-苯乙醇生物合成路径,在以l-苯丙氨酸为底物时,2-苯乙醇合成的中间产物为苯丙酮酸或苯乙醛。随后,Watanabe等[22]深入研究了玫瑰中2-苯乙醇的合成代谢途径,推测在玫瑰中可能存在2种竞争性的途径:艾氏途径和苯乙胺途径,其中艾氏途径是主要途径。Sakai等[23]发现,2-苯乙醇是由玫瑰中含有的依赖5-磷酸吡哆醛(pyridoxal 5-phosphate, PLP)的芳香族氨基酸脱羧酶和苯乙醛还原酶以l-苯丙氨酸为底物合成的,芳香族氨基酸脱羧酶和苯乙醛还原酶是此代谢路径中的关键酶,这与Tieman等[18]对于番茄果实的研究结果一致。研究发现,芳香族氨基酸脱羧酶催化l-苯丙氨酸合成苯乙醛的能力是催化d-苯丙氨酸合成苯乙醛能力的9倍,苯乙醛还原酶则对多种挥发性醛类物质均表现出催化特性。Hirata等[24]报道了“Yves Piaget”玫瑰中芳香族氨基酸转氨酶在玫瑰原生质体中由l-苯丙氨酸生成苯丙酮酸的过程。基于玫瑰EST数据库克隆了芳香族氨基酸转氨酶家族的3个全长cDNA (RyAAAT 1−3)。在大肠杆菌中异源表达RyAAATs并进行生化鉴定,与l-色氨酸、l-酪氨酸、d-苯丙氨酸、甘氨酸和l-丙氨酸相比,RyAAAT3对l-苯丙氨酸表现出最高的活性,并且以l-苯丙氨酸为底物的酶活比以苯丙酮酸为底物的酶活高9.7倍,表明RyAAAT3对2-苯乙醇合成路径具有促进作用。降低RyAAAT3的表达,发现2-苯乙醇产量减少,表明RyAAAT3参与了玫瑰中2-苯乙醇的生物合成。Chen等[3]对来自大马士革玫瑰(Rosa damascena)中的苯乙醛还原酶rose-PAR和通过cDNA在大肠杆菌中重组表达的苯乙醛还原酶PAR进行了研究,发现2种基因编码的氨基酸序列与番茄PAR1和PAR2的同源性分别为77%和75%。Rose-PAR和重组-PAR首选以NADPH为辅因子将苯乙醛还原为2-苯乙醇。但Rose-PAR对苯乙醛的催化活性比重组-PAR高10倍,推测由于在大肠杆菌中构建并表达后,缺乏翻译后的修饰作用,导致酶催化活性降低。由于Rose-PAR和重组-PAR对芳香醛和脂肪醛的还原酶活力高于对酮基的还原酶活力,因此优先将芳香醛之一的苯乙醛还原成2-苯乙醇。Sheng等[25]在红景天玫瑰(Rosa rugosa)中克隆了2个与2-苯乙醇合成有关的基因RrAAAT和RrPPDC1,建立RrAADC、RrAAAT和RrPPDC1的过表达载体并转入矮牵牛花中表达,结果表明,过表达RrAADC和RrAAAT提高了矮牵牛花中的2-苯乙醇含量。Roccia等[26]从一个二倍体品种的分离种群月季(Rosa hybrida)和光叶蔷薇(Rosa wichurana)中确定了1组与玫瑰中生成主要挥发性化合物有关的数量性状位点(quantitative trait locus, QTLs)。鉴定玫瑰中产2-苯乙醇的QTLs,发现有1种基因与2-苯乙醇生物合成途径的候选基因——苯乙醛合成酶基因RhPAAS共定位,该基因在玫瑰中高度表达,并决定玫瑰产2-苯乙醇的能力。Rasouli等[27]从分子水平研究了4个不同品种的大马士革玫瑰中2-苯乙醇的形成机理,发现其中有3个品种检测出2-苯乙醇,并且这3个品种中的苯乙醛合成酶基因RhPAR表达量相比对照植株提高了6倍。进一步研究发现,RhPAR基因表达量的提高可能与RhMYB1基因的促进作用有关,二者共同作用提高玫瑰花瓣的2-苯乙醇含量。
1.2.3 其他植物中2-苯乙醇合成路径研究现状李丽[28]探索了威代尔葡萄中2-苯乙醇的合成路径,初步确定在葡萄果实中由l-苯丙氨酸合成2-苯乙醇的途径是存在的。但Pan等[29]的研究指出,AADC介导的2-苯乙醇生物合成途径虽然存在于葡萄中,但它在葡萄后熟阶段对2-苯乙醇的大量积累可能贡献较小。Gonda等[30]研究了甜瓜中芳香族挥发性化合物的合成路径。在甜瓜果实中分离鉴定了2种基因CmArAT1和CmBCAT1,转入大肠杆菌中表达后,分别表现出芳香族氨基酸转氨酶和支链氨基酸转氨酶活性。与其他植物和果实不同的是,甜瓜果实组织首先通过转氨作用使氨基酸脱氨生成α-酮酸,然后分解代谢成芳香族挥发性化合物,而非在番茄或玫瑰中通过脱羧作用或直接醛合成。
1.3 微生物合成2-苯乙醇的代谢路径化学合成法合成原料中的化学物质在使用过程中具有致癌风险,反应条件大多为高温高压等苛刻环境,产物中常含有一些难以分离去除的副产物,这些因素大大增加了2-苯乙醇工业生产成本,降低了2-苯乙醇产物的产品质量,使2-苯乙醇的“天然性”级别大大降低,极大限制了2-苯乙醇的使用范围。与化学合成相比,生物合成反应条件温和,产物选择性也更高。微生物合成2-苯乙醇具有绿色环保、易于操作、成本低廉等优点。许多微生物都被鉴定为具有2-苯乙醇合成能力,其中大多数为真核生物[2]。在微生物中合成2-苯乙醇的合成路径已被研究得十分透彻,主要包括艾氏途径和莽草酸途径,代谢路径见图 2。
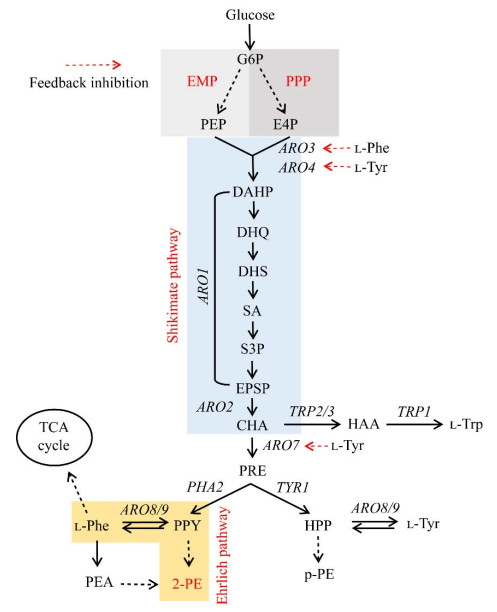
|
| 图 2 2-苯乙醇的生物合成途径 Fig. 2 Biosynthetic pathway of 2-PE. G6P: Glucose-6-phosphate; EMP: Glycolytic pathway; PPP: Pentose phosphate pathway; PEP: Phosphoenolpyruvate; E4P: d-erythrose-4-phosphate; DAHP: 3-deoxy-d-arabino-heptulosonate-7-phosphate; DHQ: 3-dehydroquinate; DHS: 3-dehydroshikimate; SA: Shikimate; S3P: Shikimate-3-phosphate; EPSP: 5-enolpyruvylshikimate-3-phosphate; CHA: Chorismate; PRE: Prephenate; PPY: Phenylpyruvate; l-Phe: l-phenylalanine; 2-PE: 2-phenylethanol; PEA: Phenylethylamine; HPP: 4-hydroxyphenylpyruvate; l-Tyr: l-tyrosine; p-PE: p-hydroxyphenylethanol; HAA: 3-hydroxyanthranilic acid; l-Trp: l-tryptophan. |
| |
艾氏途径全名埃里希途径(Ehrlich pathway),因在1907年首先由埃里希发现并阐述而用其姓名命名。艾氏途径广泛存在于各种微生物中,微生物通过艾氏途径将支链氨基酸、芳香族氨基酸和含硫氨基酸分解代谢成相应的杂酸或高级醇,是生物转化合成2-苯乙醇主要的代谢途径[31]。在艾氏途径中,l-苯丙氨酸经3步酶催化反应生成2-苯乙醇:首先l-苯丙氨酸被氨基酸转氨酶去氨基化为苯丙酮酸,然后被苯丙酮酸脱羧酶脱羧为苯乙醛,最后通过醇脱氢酶或甲醛脱氢酶还原为2-苯乙醇[32]。Wittmann等[33]的研究揭示了l-苯丙氨酸在马克斯克鲁维酵母(Kluyveromyces marxianus)内的代谢途径:73.3%转化为2-苯乙醇,22.4%通过肉桂酸途径进入TCA循环分解代谢,4.3%直接用于蛋白质的生物合成。此研究表明,在有多种氮源可供使用的情况下,部分l-苯丙氨酸将通过肉桂酸途径代谢,降低2-苯乙醇的转化率。在肉桂酸途径中,l-苯丙氨酸脱氨生成反式肉桂酸,肉桂酸经原儿茶酸生成3-酮己二酸,3-酮己二酸作为碳源进入TCA循环中。肉桂酸途径无法被完全抑制,因此在培养基中添加的前体物质l-苯丙氨酸无法完全转化为2-苯乙醇。以l-苯丙氨酸作为培养基中唯一的氮源,可以获得高浓度的2-苯乙醇[34]。
莽草酸途径是以葡萄糖为底物从头合成2-苯乙醇途径上的关键途径之一,是连接糖代谢和芳香族化合物合成的重要途径,也是微生物中最复杂的代谢途径之一[35],广泛存在于细菌、真菌、植物等生物内[36]。真核生物以葡萄糖为碳源,经糖酵解途径、磷酸戊糖途径和莽草酸途径等一系列复杂的合成途径生成苯丙酮酸,最终进入艾氏途径生成2-苯乙醇。在莽草酸途径中,赤藓糖-4-磷酸(d-erythrose-4-phosphate, E4P)为限速底物,在莽草酸途径的入口处,磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)的浓度会比E4P的浓度高出一个数量级[37],因此平衡PEP和E4P的流量是提高其下游产物产量的关键;除此之外,设法减弱莽草酸途径各分支路径中的反馈抑制也是提高2-苯乙醇产量的关键。尽管如此,Jiang等[36]指出,虽然重构莽草酸途径对解除前体物限制,提高2-苯乙醇产量具有重要作用,但过度表达外源关键酶基因或盲目删除竞争通路关键酶基因可能会对细胞造成过量的代谢负担,不利于细胞的生长代谢。
1.4 提高微生物合成2-苯乙醇的策略 1.4.1 生物合成路径的调控基因工程和代谢工程对于提高2-苯乙醇的产量至关重要,通过减轻反馈抑制、增强前体转运、增加关键酶活性和干扰副产物的形成,在增加目标产物代谢通量的同时减少代谢副产物,将廉价的碳源转化为高附加值的2-苯乙醇[38-39]。在2-苯乙醇的合成路径中,存在着多种关键酶基因和多种复杂的反馈抑制,在分子生物学水平对菌株进行基因改造,可以显著提高2-苯乙醇产量[40]。Rao等[41]开发了一种可精确调控基因表达的新型基因表达工具箱(gene expression toolbox, GET)用于高水平生产2-苯乙醇:首先建立了一种全新的启动子核心区镶嵌组合模型,对不同的核心区进行组合、表征和分析;通过鉴定启动子条带并正交设计,构建适应性强、效果好的GET,利用地衣芽孢杆菌(Bacillus licheniformis)和枯草芽孢杆菌(Bacillus subtilis)表达的不同蛋白验证GET的表达蛋白和物种通用性;最终代谢育种得到1株不含质粒的高产2-苯乙醇菌株,连续发酵培养后,2-苯乙醇产量为6.95 g/L,产率为0.15 g/g葡萄糖,是迄今为止报道的2-苯乙醇从头合成的最高产率。
1.4.2 发酵培养基和培养条件的优化2-苯乙醇主要在微生物生长的对数期产生,若微生物长时间停留在稳定期,2-苯乙醇则会参与微生物后续的代谢反应,导致2-苯乙醇产量降低。因此,选用合适的培养基和培养条件对2-苯乙醇的积累具有重要意义。Barbosa等[42]发现,通过添加少量无机氮源,如磷酸氢二铵,可显著减少乙醇和乙酸的形成,增加2-苯乙醇的产量,但其机制有待进一步阐明;Cui等[43]通过比较木糖、果糖、蔗糖、麦芽糖和糖蜜,发现葡萄糖是酿酒酵母(Saccharomyces cerevisiae) CWY132合成2-苯乙醇的最适碳源;微量元素和维生素均对2-苯乙醇产量具有很大影响,当MgSO4添加量达到0.4 g/L时,2-苯乙醇产量提高了1.65倍[11];在KH2PO4添加量处于2−6 g/L的范围内时,2-苯乙醇的产量随着KH2PO4含量的增加而逐渐增加,当KH2PO4添加量达到6 g/L时,2-苯乙醇的产量达到1.88 g/L[12]。
1.4.3 发酵液中2-苯乙醇含量的控制由于高浓度2-苯乙醇对大多数微生物均具有毒性,发酵液中2-苯乙醇的积累可能导致菌体活性降低甚至死亡,对菌株生长和产2-苯乙醇不利。因此,及时将发酵液中的产物2-苯乙醇分离,使其维持在低浓度水平,保障微生物正常生长,有利于2-苯乙醇产量的提升。Cordero-Soto等[44]偶联受控曝气搅拌生物反应器和膜基溶剂萃取(membrane-based solvent extraction, MBSE)技术培养马克斯克鲁维酵母(K. marxianus) ITD0090,连续回收发酵液中产生的2-苯乙醇,在发酵56 h后的2-苯乙醇产量达到3.2 g/L。Lukito等[45]首次报道了以2种酵母:马克斯克鲁维酵母(K. marxianus)和季也蒙毕赤酵母(Meyerozyma guilliermondii)共同培养,并在发酵液中加入聚合物Hytrel3548实现原位产品分离(in situ product recovery, ISPR)技术,将共同培养和ISPR技术结合,提高对2-苯乙醇的选择性和单位体积产率,最终2-苯乙醇单位体积产量达到27 mg/(L·h),与马克斯克鲁维酵母(K. marxianus)单相发酵相比提高了458%。在萃取时选取合适的溶剂能将2-苯乙醇更好地从发酵液中分离,de Brabander等[46]对比了不同的生物相容性混合溶剂对2-苯乙醇的萃取效率,发现25%磷酸三丁酯(tributyl phosphate, TBP)和油醇的混合溶剂对2-苯乙醇的萃取效率最高。
1.4.4 菌株对2-苯乙醇胁迫耐受性的提高2-苯乙醇浓度介于2.0−3.0 g/L时,会抑制多种细菌及真菌的生长[47],因此提高菌株对2-苯乙醇的耐受性是打破微生物中2-苯乙醇产量瓶颈、提高微生物产2-苯乙醇效率的关键。王航等[48]研究了酿酒酵母(S. cerevisiae) R-UV3在不同浓度2-苯乙醇条件下的生理生化特性规律,随着2-苯乙醇浓度从0增加到4.0 g/L,酵母细胞分解代谢能力、细胞膜渗透性及ARO10基因表达量逐渐降低。Xia等[49]通过适应性实验室进化(adaptive laboratory evolution, ALE)筛选出1株酿酒酵母菌株,能够耐受3.5 g/L 2-苯乙醇。在3.5 g/L 2-苯乙醇胁迫下,该菌株细胞形态保持规则、圆润,表面光滑,细胞膜破裂度降低了55%。对该菌株进行全基因组测序,发现PDR1C862R基因发生突变。Pdr1p可以直接结合酮康唑,进而激活靶基因的转录,推测Pdr1p通过直接结合2-苯乙醇来调控靶基因的表达,进而提高菌株对2-苯乙醇的耐受。此外,PDR1C862R突变不仅提高了菌株对2-苯乙醇的耐受,而且增加了2-苯乙醇的产量,检测发现突变菌株的2-苯乙醇浓度比亲本菌株提高了11%,2-苯乙醇最大浓度达到了3.34 g/L。Holyavkin等[50]通过连续补料分批培养,将培养基中的2-苯乙醇浓度从初始1.5 g/L提高至3.4 g/L,传代培养224代后筛选出1株能够耐受3.4 g/L 2-苯乙醇的酿酒酵母菌株,对2-苯乙醇的耐受度相比原始菌株提高了3倍;对该突变菌株进行基因组测序,发现编码高渗透压信号通路的丝裂原活化激酶HOG1、编码低亲和力cAMP磷酸二酯酶的PDE2和编码与细胞壁重塑有关的几丁质转糖基化酶的CRH1发生突变,除此之外,还发现NAD+依赖的乙醛脱氢酶基因ALD3和ALD4以及编码氧化还原酶的BDH2的表达量大幅上调。苯乙酸酯的毒性远低于2-苯乙醇,这表明2-苯乙醇在这些脱氢酶的介导下转化为苯乙酸酯,从而激活了酿酒酵母内的解毒机制。Yang等[51]探究了在黄酒发酵过程中,酿酒酵母HJ和酿酒酵母S288C中ARO9和ARO10基因与细胞对2-苯乙醇耐受性的关系,研究发现,Aro9p (HJ)和Aro10p (HJ)的突变可能有助于黄酒中2-苯乙醇浓度的增加。
Zhan等[52]使用多组学方法研究了地衣芽孢杆菌(B. licheniformis) DW2对2-苯乙醇胁迫的耐受机制。DW2对2-苯乙醇的最大耐受浓度为5 g/L,显著高于其他菌种。分别在外源2-苯乙醇添加与否的培养条件下,采用蛋白质组学定量,观察到377个差异表达蛋白(differentially expressed proteins, DEPs),包括149个上调蛋白和228个下调蛋白。为验证蛋白质组学的数据,进行RT-qPCR分析,结果表明,抗氧化和全局应激反应系统相关蛋白(msrA、trxA、trxB、tpx、yugJ、sodA、dhaS、sigB和groS)的基因表达上调,脂肪酸生物合成相关蛋白(fabD)、糖分解代谢相关蛋白(mdxF、sacB)和核糖体合成蛋白(rplL)的基因表达下调。为了适应高浓度2-苯乙醇,细胞激活多层抗氧化系统,重构中心碳代谢以产生更多的还原因子NADPH以应对氧化自由基的产生;增大细胞体积、改变膜转运蛋白的表达水平以抑制2-苯乙醇进入胞内;降低糖代谢和氨基酸代谢途径基因表达,作为节能策略满足耐受高浓度2-苯乙醇的能量需求。Wang等[53]阐述了产甘油假丝酵母(Candida glycerinogenes)的2-苯乙醇耐受机制。产甘油假丝酵母是一种耐盐菌,在高渗透压的条件下仍可正常生长。研究菌种在正常生长、外源添加2-苯乙醇和发酵产2-苯乙醇3种不同条件下对2-苯乙醇的耐受机制,发现在外源添加2-苯乙醇或发酵产2-苯乙醇时,细胞表现出2种完全不同的状态,这些不同的状态是由转录因子Hog1和Swi5介导的。在胞外2-苯乙醇的作用下,产甘油假丝酵母激活Hog1,抑制Swi5,上调erg5和erg4的表达,细胞膜硬度增加,细胞边缘变大,比表面积变小,从而抑制外源2-苯乙醇进入胞内。在发酵过程中,产甘油假丝酵母激活Hog1,抑制Swi5,上调2-苯乙醇转运蛋白编码基因cdr1和酰基辅酶A去饱和酶编码基因ole1表达,细胞体积变小,比表面积增大,增加胞内2-苯乙醇的排出,降低2-苯乙醇的毒性。这些结果为在细胞膜水平上研究2-苯乙醇的耐受机制提供了新的见解,并提出通过改造抗胁迫基因提高2-苯乙醇产量的新策略。
1.5 微生物合成2-苯乙醇的研究进展微生物因其生长周期短、发酵产物单一、利于分离纯化等优点逐渐成为研究热点[54]。虽然艾氏途径只需3步反应便可从l-苯丙氨酸合成2-苯乙醇,但l-苯丙氨酸成本高昂,因此以葡萄糖等廉价碳源合成2-苯乙醇成为重点研究的课题。近年来,在微生物中合成2-苯乙醇已取得一定进展,表 1列举了部分微生物合成2-苯乙醇的研究进展。
| Strain | Regulated genes | Substrate (g/L) | Titer (g/L) | References |
| S. cerevisiae CEN.PK | Deletion of ARO3 and ARO8; overexpression of ARO4, ARO7, 3ABP, TKL1, ARO10, PYK1D146N, ARO3K222L and aroL (in E. coli) | Glucose 20 | 1.59 | [37] |
| Escherichia coli BL21 | Overexpression of aroGfbr, pheAfbr, yjgB, kdc (in Pichiia pastoris) and ARO8 (in Sccharomyces cerevisiae) |
Glucose 20 | 1.02 | [55] |
| E. coli W3110 | Deletion of feaB, pykF and crr; overexpression of ARO10 (in S. cerevisiae) and yjgB | Glucose 60 | 2.15 | [56] |
| Bacillus licheniformis PE23 | Deletion of pyk, ptsG, dhaS, hisC and tyrA; overexpression of YugJ, AroK, AroD, pheAfbr, aroGfbr (in E. coli) and kivD (in Lactococcus lactis) | Glucose 70 | 6.24 | [57] |
| B. licheniformis PE24 | Overexpression of CscB (in E. coli) and SucP (in Bifdobacterium adolescentis) |
Pretreated molasses 50 Crude glycerol 15 Corn steep liquor powder 7 |
6.43 | [58] |
| S. cerevisiae CICC 31906 | Deletion of ARO9; overexpression of aroGD146N, pheAfbr, ydiB, aroL (in E. coli), TKL1 and ARO10 | Glucose 20 | 0.64 | [59] |
| P. pastoris SK004 | Overexpression of ARO10, ADH6, AroGfbr, PheAfbr and ARO8 | Glucose 20 | 1.17 | [60] |
| Yarrowia lipolytica JMY195 | Overexpression of ARO1, ARO2, ARO8 and ARO10, ARO4K229L, ARO3K222L, ARO7T226I (in S. cerevisiae) | Glucose 40/glycerol 40 | 0.14/ 0.48 |
[61] |
| Yarrowia lipolytica YL35 | Deletion of PYK; overexpression of PAR4 ARO10, ARO7, PHA2 and ARO7G141S (in S. cerevisiae) |
Glucose 40 | 2.42 | [62] |
| Corynebacterium glutamicum CGPE15 | Overexpression of ARO10 (in S. cerevisiae), aroGfbr, pheAfbr, aroA, ppsA and tkt | Corn stalk hydrolysate (contained glucose 41.3 and xylose 18.7) | 3.55 | [63] |
| S. cerevisiae BY4741 and Chlorella sp. GY-H4 | Overexpression of PAAS (in Petunia/Vanda/ Rosa) |
Glucose 40 | 2.19 | [64] |
Guo等[55]构建了1条在大肠杆菌BL21中由葡萄糖从头合成2-苯乙醇的生物合成途径,首先过表达来自大肠杆菌的酪氨酸敏感3-脱氧-d-阿拉伯-7-磷酸庚酮酸酯(3-deoxy-d-arabino-heptulosonate-7-phosphate, DAHP)合酶aroGfbr、pheAfbr和醛还原酶基因yjgB,随后异源表达来自巴斯德毕赤酵母(Pichia pastoris) GS115的苯丙酮酸脱羧酶基因kdc,2-苯乙醇产量达到578 mg/L,最后异源过表达酿酒酵母S288C中的转氨酶基因ARO8,以葡萄糖为原料,发酵得到2-苯乙醇1.02 g/L。Wang等[56]构建出1条在大肠杆菌W3110中的生物合成途径,首先敲除苯乙酸合成酶基因feaB,降低2-苯乙醛的消耗,然后敲除丙酮酸脱氢酶基因pykF和可以使葡萄糖特异性磷酸转移酶系统(phosphotransferase system, PTS)部分失活的crr基因,增加莽草酸途径前体物质磷酸烯醇式丙酮酸的供应,使2-苯乙醇产量提高35%,最后,在多个基因位点整合来自酿酒酵母S288C的苯丙酮酸脱羧酶基因ARO10并过表达醛还原酶基因yjgB,以葡萄糖为原料,在5 L发酵罐中发酵32 h后,2-苯乙醇产量达到2.15 g/L,是目前报道的大肠杆菌从头合成2-苯乙醇的最高产量。
1.5.2 地衣芽胞杆菌(Bacillus licheniformis)合成2-苯乙醇的进展Zhan等[57]过表达乙醇脱氢酶基因YugJ、莽草酸激酶基因AroK、莽草酸脱氢酶基因AroD,并引入大肠杆菌来源的抗反馈突变基因EcpheAfbr和EcaroGfbr,解除莽草酸途径的反馈抑制。敲除丙酮酸激酶编码基因pyk,下调ptsG的表达,增强磷酸烯醇式丙酮酸独立葡萄糖转运(GlcU)和磷酸化系统(GlcK)基因的表达,构建葡萄糖转运系统,解除了莽草酸途径关键底物磷酸烯醇式丙酮酸的底物限制。过表达乳酸乳球菌(Lactococcus lactis)来源的酮酸脱羧酶基因kivD,敲除醛脱氢酶编码基因dhaS,进一步增加2-苯乙醇的积累。最后敲除芳香族氨基酸合成关键酶基因hisC、预苯酸脱氢酶编码基因tyrA,减弱l-苯丙氨酸和l-酪氨酸的积累。最终,地衣芽胞杆菌(B. licheniformis) PE23的2-苯乙醇产量达到6.24 g/L,单位产量和生产率分别为0.14 g/g葡萄糖和0.13 g/(L·h)。Xu等[58]在上述研究的基础上,对地衣芽胞杆菌(B. licheniformis) PE24进行改造,开发了一种可持续产2-苯乙醇的生物合成平台。首先,引入来自大肠杆菌的CscB基因和青春双歧杆菌(Bifdobacterium adolescentis)的SucP基因,取代地衣芽胞杆菌(B. licheniformis)中的内源性蔗糖分解代谢途径。以蔗糖为原料的2-苯乙醇产量和产量分别提升至(6.52±0.20) g/L和0.16 g/g蔗糖,与PE23相比提升了16%。在优化发酵原料的预处理方法和培养基组分后,在5 L发酵罐中补料分批发酵,最终得到6.43 g/L的2-苯乙醇,是目前微生物发酵产2-苯乙醇的最高产量。
1.5.3 酿酒酵母(Saccharomyces cerevisiae)合成2-苯乙醇的进展Zhu等[59]以酿酒酵母CICC 31906为原始菌株,将大肠杆菌来源的DAHP合酶基因EcaroGD146N、分支酸变位酶基因EcpheAfbr、莽草酸脱氢酶基因EcydiB和莽草酸激酶基因EcaroL导入ARO9缺失菌株,过表达转酮醇酶基因TKL1和苯丙酮酸脱羧酶基因ARO10,构建了1株高产2-苯乙醇的工程菌株JM26,以葡萄糖为唯一碳源,该菌株2-苯乙醇产量为643 mg/L,是对照菌株的6.1倍。Hassing等[37]以酿酒酵母CEN.PK为原始菌株,过表达ARO4、ARO7、3ABP、TKL1、ARO10、PYK1D146N、EcaroL、ARO3K222L,敲除ARO3和ARO8,构建出1株高产2-苯乙醇的菌株,发酵得到2-苯乙醇1.59 g/L,是目前酿酒酵母以葡萄糖为原料合成2-苯乙醇的最高产量。值得一提的是,Xu等[65]分别以单倍体酿酒酵母菌株PK-2C和二倍体酿酒酵母菌株CWY-132为研究对象,使用CRISPR-Cas9技术分别敲除ATF1、ALD2和ALD3基因,发现敲除此3种基因可使单倍体菌株的2-苯乙醇产量提高,但使二倍体菌株2-苯乙醇产量降低。结果表明,相同的遗传操作策略可能对具有不同遗传背景的酿酒酵母菌株产生完全相反的效果。2017年,Machas等[66]对大肠杆菌中的苯乙烯合成途径进行研究,发现这种异源途径的热力学驱动力比艾氏途径高出近10倍。此后,Mo等[67]将非天然苯乙烯降解途径引入酿酒酵母中,首次证实苯乙烯衍生合成途径在酵母中的功能表达,摇瓶发酵得到2-苯乙醇的产量为680 mg/L。
1.5.4 其他微生物合成2-苯乙醇的进展Kong等[60]首次报道了以巴斯德毕赤酵母为底盘菌株,以葡萄糖为底物产2-苯乙醇的研究:利用强启动子GAP过表达苯丙酮酸脱羧酶基因ARO10、乙醇脱氢酶基因ADH6、反馈抗性突变DAHP合酶基因AroGfbr和分支酸变位酶/预苯酸脱水酶基因PheAfbr,过表达异源芳香族转氨酶基因ARO8,最终巴斯德毕赤酵母SK004的2-苯乙醇产量达到1 169 mg/L。Larroude等[61]以解脂耶氏酵母(Yarrowia lipolytica) JMY195为底盘菌株,过表达YlARO1、YlARO2、YlARO8和YlARO10,并过表达酿酒酵母来源的抗反馈突变基因ScARO4K229L、ScARO3K222L和ScARO7T226I,以葡萄糖为碳源发酵得到2-苯乙醇0.14 g/L,相比野生型菌株提高93倍。在使用甘油作为碳源时,产量进一步提升至0.48 g/L。Gu等[62]以解脂耶氏酵母(Y. lipolytica) YL35为原始菌株,过表达YlPAR4、YlARO10、YlARO7、YlPHA2、ScARO7G141S,敲除YlPYK,以葡萄糖为碳源,发酵得到2-苯乙醇2.42 g/L。Drężek等[68]从乳制品中分离得到2株马克斯克鲁维酵母(K. marxianus)和1株乳酸乳球菌(L. lactis),使用乳清渗透培养基连续培养,2-苯乙醇产量达到57.5 mg/(L·h),相比间歇培养产量提高60%。Lindsay等[69]以廉价的农业废料胡萝卜渣为发酵原料,以常用于啤酒发酵的布鲁氏酒香酵母(Brettanomyces bruxellensis)为发酵菌种,发酵产2-苯乙醇的得率为2.7 g/kg。
Zhou等[70]首次验证了1种芽孢杆菌(Starmerella bacillaris)产2-苯乙醇的能力。通过全基因组测序分析并与KEGG数据库比对,确定1株芽孢杆菌(S. bacillaris)菌株,命名为R5。对R5进行发酵检测,发现R5通过艾氏途径和莽草酸途径均可产2-苯乙醇,且前者效率高于后者;对R5进行RT-qPCR鉴定,发现在只含有l-苯丙氨酸的培养基中,YAT、GOT1、hisC、PDC、ADH5基因表达均有不同程度的上调,并且ADH5的表达水平高于PDC、hisC、GOT1和YAT,说明催化苯甲醛脱氢为2-苯乙醇的关键基因是ADH5。Usai等[71]在蓝藻细菌(Synechococcus elongatus) PCC 7942 P120中过表达苯乙醇生物合成途径酶P120和莽草酸激酶基因AroK,使2-苯乙醇产量达到285 mg/L,是目前报道的光合微生物产2-苯乙醇的最高产量。Zhu等[63]以谷氨酸棒状杆菌(Corynebacterium glutamicum)为底盘菌株,将异源艾氏途径引入其中,并联合表达ARO10基因,使底盘菌株具有产2-苯乙醇的能力,随后过表达参与苯丙酮酸合成途径的关键基因(aroGfbr、pheAfbr、aroA、ppsA和tkt),最后引入黄单胞菌(Xanthomonas Campestris)中的木糖同化途径和大肠杆菌中的木糖转运蛋白,使用玉米秸秆水解物为碳源发酵的2-苯乙醇产量达到3.55 g/L,相比以葡萄糖为底物的产量提高10%。Gao等[64]使用酿酒酵母BY4741和小球藻(Chlorella sp.) GY-H4构建出1种可持续生长和合成的人工光驱动微生物群落,在BY4741中引入好氧苯乙胺途径,并3D生物打印含有小球藻的活体材料,给予小球藻一定的生态空间位。在该群落中,光自养微生物将二氧化碳转化为氧气和有机碳,以供异养微生物的持续生长和产物合成。该体系中2-苯乙醇的最终产量达到了2.19 g/L。
目前利用微生物生产2-苯乙醇的研究大量集中在大肠杆菌、酿酒酵母等模式微生物上,以上研究为利用不常见微生物发酵产2-苯乙醇提供新的思路。通过发掘不同属种的微生物发酵产2-苯乙醇的能力,筛选得到高产2-苯乙醇的底盘菌株,可为未来高产2-苯乙醇菌株的构建打开新的局面。
2 展望作为一种被广泛使用的工业原料,2-苯乙醇在各行业的需求量都在不断提高,如何高产2-苯乙醇也成为了备受关注的课题。2-苯乙醇在玫瑰、番茄等植物中天然存在,但使用物理方法萃取植物中的2-苯乙醇产量低、成本高,无法满足工业化需求。目前工业上使用的2-苯乙醇主要由化学法合成,化学法产量高、市场价低,极大满足了2-苯乙醇的使用需求,但化学合成法原料具有致癌风险,产物杂质多、纯度低,反应过程存在污染,无法用于食品、化妆品等直接与人接触的产品中。随着绿色环保越来越受到关注和重视,对产品质量的要求变得更高,生物合成法逐渐取代化学合成法成为研究热点。生物合成法具有毒性小、易于操作、对环境污染小、合成产物单一等优点,已成为未来合成2-苯乙醇的热点方向。微生物生长周期短,生长不受天气环境影响,对其进行基因改造相对容易,适合作为量产2-苯乙醇的“微工厂”。通过基因改造重构2-苯乙醇合成路径,环境胁迫、诱变育种筛选高耐受2-苯乙醇的菌株,使用ISPR技术降低发酵过程中2-苯乙醇的浓度,抑制对菌株的毒性,探索更加有利的发酵条件提高2-苯乙醇产量等,都是可以深入探索的方向。以廉价工农业废料为原料产2-苯乙醇的可能性对回收废料、改善环境和降低生产成本也具有实际意义。生物转化是一种绿色、可持续、经济的过程,蓝藻等光合微生物可利用光作为能量来源为NADPH和ATP的合成提供动力[72],为化合物的可持续和绿色生产提供理论和实践基础。以光合微生物为底盘菌株进行改造,或结合不同种类微生物的特性构建高效合成2-苯乙醇的微生物群落为高产2-苯乙醇提供了一种新的思路。在实际的生产中,结合多种手段,不仅能够同时满足绿色生产和高产2-苯乙醇的要求,还能为践行绿色环保理念的同时高产其他化合物提供一定思路。
| [1] |
THOMPSON B, MACHAS M, NIELSEN DR. Creating pathways towards aromatic building blocks and fine chemicals[J]. Current Opinion in Biotechnology, 2015, 36: 1-7. DOI:10.1016/j.copbio.2015.07.004
|
| [2] |
杨晓, 陈芳, 李景明. 植物中2-苯乙醇的合成研究进展[J]. 园艺学报, 2010, 37(10): 1690-1694. YANG X, CHEN F, LI JM. Research progress on 2-phenylethanol biosynthesis in plants[J]. Acta Horticulturae Sinica, 2010, 37(10): 1690-1694 (in Chinese). |
| [3] |
CHEN XM, KOBAYASHI H, SAKAI MW, HIRATA H, ASAI T, OHNISHI T, BALDERMANN S, WATANABE N. Functional characterization of rose phenylacetaldehyde reductase (PAR), an enzyme involved in the biosynthesis of the scent compound 2-phenylethanol[J]. Journal of Plant Physiology, 2011, 168(2): 88-95. DOI:10.1016/j.jplph.2010.06.011
|
| [4] |
QIAN XJ, YAN W, ZHANG WM, DONG WL, MA JF, OCHSENREITHER K, JIANG M, XIN FX. Current status and perspectives of 2-phenylethanol production through biological processes[J]. Critical Reviews in Biotechnology, 2019, 39(2): 235-248. DOI:10.1080/07388551.2018.1530634
|
| [5] |
CAO MF, GAO MR, SUÁSTEGUI M, MEI YZ, SHAO ZY. Building microbial factories for the production of aromatic amino acid pathway derivatives: from commodity chemicals to plant-sourced natural products[J]. Metabolic Engineering, 2020, 58: 94-132. DOI:10.1016/j.ymben.2019.08.008
|
| [6] |
SUN SF, TANG NW, HAN K, WANG QQ, XU Q. Effects of 2-phenylethanol on controlling the development of Fusarium graminearum in wheat[J]. Microorganisms, 2023, 11(12): 2954. DOI:10.3390/microorganisms11122954
|
| [7] |
ZOU XR, WEI YY, ZHU JH, SUN JC, SHAO XF. Volatile organic compounds of Scheffersomyces spartinae W9 have antifungal effect against Botrytis cinerea on strawberry fruit[J]. Foods, 2023, 12(19): 3619. DOI:10.3390/foods12193619
|
| [8] |
LU J, LI J, LI L, QI LL, WANG YX, YANG S, XU GY, DOU DL, LIU J, WANG XD. Natural product 2-phenylethanol inhibits ATP synthesis of P. infestans by blocking the oxidative phosphorylation pathway to prevent potato late blight[J]. Postharvest Biology and Technology, 2023, 199: 112310. DOI:10.1016/j.postharvbio.2023.112310
|
| [9] |
陈先锐, 王肇悦, 何秀萍. 酵母菌合成2-苯乙醇的研究进展[J]. 生物工程学报, 2016, 32(9): 1151-1163. CHEN XR, WANG ZY, HE XP. Advances in biosynthesis of 2-phenylethanol by yeasts[J]. Chinese Journal of Biotechnology, 2016, 32(9): 1151-1163 (in Chinese). |
| [10] |
朱灵桓. 代谢工程改造酿酒酵母生产β-苯乙醇[D]. 无锡: 江南大学博士学位论文, 2021. ZHU LH. Metabolic engineering of Saccharomyces cerevisiae for β-phenylethanol production[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2021 (in Chinese). |
| [11] |
杜松山. 香料β-苯乙醇合成工艺研究[D]. 西安: 西北大学硕士学位论文, 2008. DU SS. The study on the synthetic technology of spices β-phenylethanol[D]. Xi'an: Master's Thesis of Northwest University, 2008 (in Chinese). |
| [12] |
严伟, 高豪, 蒋羽佳, 钱秀娟, 周杰, 董维亮, 章文明, 信丰学, 姜岷. 2-苯乙醇生物合成的研究进展[J]. 合成生物学, 2021, 2(6): 1030-1045. YAN W, GAO H, JIANG YJ, QIAN XJ, ZHOU J, DONG WL, ZHANG WM, XIN FX, JIANG M. Research progress in 2-phenylethanol production through biological processes[J]. Synthetic Biology Journal, 2021, 2(6): 1030-1045 (in Chinese). |
| [13] |
ETSCHMANN MMW, BLUEMKE W, SELL D, SCHRADER J. Biotechnological production of 2-phenylethanol[J]. Applied Microbiology and Biotechnology, 2002, 59(1): 1-8. DOI:10.1007/s00253-002-0992-x
|
| [14] |
MAMEDOV MK. Synthesis of aromatic alcohols and their alkanoic acid esters[J]. Russian Journal of Applied Chemistry, 2006, 79(3): 408-410. DOI:10.1134/S1070427206030141
|
| [15] |
张奥文. β-苯乙醇制备工艺研究[D]. 郑州: 郑州大学硕士学位论文, 2021. ZHANG AW. Study on the preparation process of β-phenylethanol[D]. Zhengzhou: Master's Thesis of Zhengzhou University, 2021 (in Chinese). |
| [16] |
申屠有德, 金毅强, 姚跃良, 毛海舫. β-苯乙醇连续流合成工艺研究[J]. 香料香精化妆品, 2022(4): 79-81, 99. SHENTU YD, JIN YQ, YAO YL, MAO HF. Continuous flow synthesis of β-phenylethanol[J]. Flavour Fragrance Cosmetics, 2022(4): 79-81, 99 (in Chinese). DOI:10.3969/j.issn.1000-4475.2022.04.016 |
| [17] |
王朝阳, 姚跃良, 李恩帅, 王浩, 章平毅, 孙揭阳, 毛海舫. β-苯乙醇的合成[J]. 香料香精化妆品, 2017(2): 12-14. WANG CY, YAO YL, LI ES, WANG H, ZHANG PY, SUN JY, MAO HF. Synthesis of β-phenylethanol[J]. Flavour Fragrance Cosmetics, 2017(2): 12-14 (in Chinese). |
| [18] |
TIEMAN D, TAYLOR M, SCHAUER N, FERNIE AR, HANSON AD, KLEE HJ. Tomato aromatic amino acid decarboxylases participate in synthesis of the flavor volatiles 2-phenylethanol and 2-phenylacetaldehyde[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(21): 8287-8292.
|
| [19] |
TIKUNOV YM, ROOHANITAZIANI R, MEIJER-DEKENS F, MOLTHOFF J, PAULO J, FINKERS R, CAPEL I, CARVAJAL MORENO F, MALIEPAARD C, NIJENHUIS-DE VRIES M, LABRIE CW, VERKERKE W, van HEUSDEN AW, van EEUWIJK F, VISSER RGF, BOVY AG. The genetic and functional analysis of flavor in commercial tomato: the FLORAL4 gene underlies a QTL for floral aroma volatiles in tomato fruit[J]. The Plant Journal: for Cell and Molecular Biology, 2020, 103(3): 1189-1204. DOI:10.1111/tpj.14795
|
| [20] |
LI X, TIEMAN D, ALSEEKH S, FERNIE AR, KLEE HJ. Natural variations in the Sl-AKR9 aldo/keto reductase gene impact fruit flavor volatile and sugar contents[J]. The Plant Journal: for Cell and Molecular Biology, 2023, 115(4): 1134-1150. DOI:10.1111/tpj.16310
|
| [21] |
BUGORSKIĬ PS, ZAPROMETOV MN. Biosynthesis of beta-phenylethanol in rose petals[J]. Biokhimiia, 1978, 43(11): 2038-2042.
|
| [22] |
WATANABE S, HAYASHI K, YAGI K, ASAI T, MacTAVISH H, PICONE J, TURNBULL C, WATANABE N. Biogenesis of 2-phenylethanol in rose flowers: incorporation of [2H8]l-phenylalanine into 2-phenylethanol and its beta-d-glucopyranoside during the flower opening of Rosa 'Hoh-Jun' and Rosa damascena Mill[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(5): 943-947. DOI:10.1271/bbb.66.943
|
| [23] |
SAKAI M, HIRATA H, SAYAMA H, SEKIGUCHI K, ITANO H, ASAI T, DOHRA H, HARA M, WATANABE N. Production of 2-phenylethanol in roses as the dominant floral scent compound from l-phenylalanine by two key enzymes, a PLP-dependent decarboxylase and a phenylacetaldehyde reductase[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(10): 2408-2419. DOI:10.1271/bbb.70090
|
| [24] |
HIRATA H, OHNISHI T, ISHIDA H, TOMIDA K, SAKAI MW, HARA M, WATANABE N. Functional characterization of aromatic amino acid aminotransferase involved in 2-phenylethanol biosynthesis in isolated rose petal protoplasts[J]. Journal of Plant Physiology, 2012, 169(5): 444-451. DOI:10.1016/j.jplph.2011.12.005
|
| [25] |
SHENG LX, ZENG YQ, WEI TT, ZHU M, FANG XM, YUAN XY, LUO YJ, FENG LG. Cloning and functional verification of genes related to 2-phenylethanol biosynthesis in Rosa rugosa[J]. Genes, 2018, 9(12): 576. DOI:10.3390/genes9120576
|
| [26] |
ROCCIA A, HIBRAND-SAINT OYANT L, CAVEL E, CAISSARD JC, MACHENAUD J, THOUROUDE T, JEAUFFRE J, BONY A, DUBOIS A, VERGNE P, SZÉCSI J, FOUCHER F, BENDAHMANE M, BAUDINO S. Biosynthesis of 2-phenylethanol in rose petals is linked to the expression of one allele of RhPAAS[J]. Plant Physiology, 2019, 179(3): 1064-1079. DOI:10.1104/pp.18.01468
|
| [27] |
RASOULI O, AHMADI N, RASHIDI MONFARED S. Molecular characterization and expression pattern of RhPAR, RhMYB1 and RhANS genes involving in scent and color production in Rosa damascena[J]. Scientia Horticulturae, 2020, 272: 109399. DOI:10.1016/j.scienta.2020.109399
|
| [28] |
李丽. 威代尔葡萄成熟和后熟过程中特征香气-2-苯乙醇形成的研究: 侧重于芳香族氨基酸脱羧酶表达特性的研究[D]. 北京: 北京林业大学硕士学位论文, 2009. LI L. Study on the synthesis of characteristic aroma-2-phenylethanol in vidal grape at ripping and after-ripping[D]. Beijing: Master's Thesis of Beijing Forestry University, 2009 (in Chinese). |
| [29] |
PAN QH, CHEN F, ZHU BQ, MA LY, LI L, LI JM. Molecular cloning and expression of gene encoding aromatic amino acid decarboxylase in 'Vidal Blanc' grape berries[J]. Molecular Biology Reports, 2012, 39(4): 4319-4325. DOI:10.1007/s11033-011-1219-y
|
| [30] |
GONDA I, BAR E, PORTNOY V, LEV S, BURGER J, SCHAFFER AA, TADMOR Y, GEPSTEIN S, GIOVANNONI JJ, KATZIR N, LEWINSOHN E. Branched-chain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L. fruit[J]. Journal of Experimental Botany, 2010, 61(4): 1111-1123. DOI:10.1093/jxb/erp390
|
| [31] |
杨霄, 崔志峰. 酵母生物转化生产2-苯乙醇的研究进展[J]. 应用与环境生物学报, 2006, 12(1): 140-144. YANG X, CUI ZF. Progress in 2-phenylethanol production by biotransformation with yeast[J]. Chinese Journal of Applied & Environmental Biology, 2006, 12(1): 140-144 (in Chinese). |
| [32] |
DICKINSON JR, SALGADO LE, HEWLINS MJE. The catabolism of amino acids to long chain and complex alcohols in Saccharomyces cerevisiae[J]. The Journal of Biological Chemistry, 2003, 278(10): 8028-8034. DOI:10.1074/jbc.M211914200
|
| [33] |
WITTMANN C, HANS M, BLUEMKE W. Metabolic physiology of aroma-producing Kluyveromyces marxianus[J]. Yeast, 2002, 19(15): 1351-1363. DOI:10.1002/yea.920
|
| [34] |
MITRI S, KOUBAA M, MAROUN RG, ROSSIGNOL T, NICAUD JM, LOUKA N. Bioproduction of 2-phenylethanol through yeast fermentation on synthetic media and on agro-industrial waste and by-products: a review[J]. Foods, 2022, 11(1): 109. DOI:10.3390/foods11010109
|
| [35] |
冉艳朋, 徐沙, 李由然, 蒋玮, 顾正华, 丁重阳, 张梁, 石贵阳. 代谢工程改造酿酒酵母促进l-苯丙氨酸的合成[J]. 食品与发酵工业, 2020, 46(9): 1-9. RAN YP, XU S, LI YR, JIANG W, GU ZH, DING ZY, ZHANG L, SHI GY. Metabolically engineered Saccharomyces cerevisiae for l-phenylalanine synthesis[J]. Food and Fermentation Industries, 2020, 46(9): 1-9 (in Chinese). |
| [36] |
JIANG M, ZHANG HR. Engineering the shikimate pathway for biosynthesis of molecules with pharmaceutical activities in E. coli[J]. Current Opinion in Biotechnology, 2016, 42: 1-6. DOI:10.1016/j.copbio.2016.01.016
|
| [37] |
HASSING EJ, de GROOT PA, MARQUENIE VR, PRONK JT, DARAN JM G. Connecting central carbon and aromatic amino acid metabolisms to improve de novo 2-phenylethanol production in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2019, 56: 165-180. DOI:10.1016/j.ymben.2019.09.011
|
| [38] |
卞一凡, 刘姝晗, 张贝萌, 张玉龙, 李辛桐, 王鹏超. 微生物合成2-苯乙醇研究进展[J]. 中国生物工程杂志, 2022, 42(8): 128-136. BIAN YF, LIU SH, ZHANG BM, ZHANG YL, LI XT, WANG PC. Advances in microbial synthesis of 2-phenylethanol[J]. China Biotechnology, 2022, 42(8): 128-136 (in Chinese). |
| [39] |
WANG YQ, ZHANG H, LU XY, ZONG H, ZHUGE B. Advances in 2-phenylethanol production from engineered microorganisms[J]. Biotechnology Advances, 2019, 37(3): 403-409. DOI:10.1016/j.biotechadv.2019.02.005
|
| [40] |
WU FL, CAO P, SONG GT, CHEN WJ, WANG QH. Expanding the repertoire of aromatic chemicals by microbial production[J]. Journal of Chemical Technology & Biotechnology, 2018, 93(10): 2804-2816.
|
| [41] |
RAO Y, WANG JQ, YANG XY, XIE XX, ZHAN YY, MA X, CAI DB, CHEN SW. A novel toolbox for precise regulation of gene expression and metabolic engineering in Bacillus licheniformis[J]. Metabolic Engineering, 2023, 78: 159-170. DOI:10.1016/j.ymben.2023.06.004
|
| [42] |
BARBOSA C, FALCO V, MENDES-FAIA A, MENDES-FERREIRA A. Nitrogen addition influences formation of aroma compounds, volatile acidity and ethanol in nitrogen deficient media fermented by Saccharomyces cerevisiae wine strains[J]. Journal of Bioscience and Bioengineering, 2009, 108(2): 99-104. DOI:10.1016/j.jbiosc.2009.02.017
|
| [43] |
CUI ZF, YANG X, SHEN QJ, WANG K, ZHU TH. Optimisation of biotransformation conditions for production of 2-phenylethanol by a Saccharomyces cerevisiae CWY132 mutant[J]. Natural Product Research, 2011, 25(7): 754-759. DOI:10.1080/14786419.2010.529441
|
| [44] |
CORDERO-SOTO IN, METROPOLITANA-IZTAPALAPA UA, CASTILLO-ARAIZA CO, RUTIAGA-QUIÑONES OM, MOUSSA M, BÉAL C, GALLEGOS-INFANTE A, SOTO-CRUZ NO, OCHOA-MARTÍNEZ LA, HUERTA-OCHOA S. Intensification of 2-phenylethanol production using an aerated system assisted by a membrane-based solvent extraction technique[J]. Revista Mexicana de Ingeniería Química, 2021, 20(2): 739-750. DOI:10.24275/rmiq/Bio2060
|
| [45] |
LUKITO BR, BASRI N, THONG A, HERMANSEN C, WEINGARTEN M, PETERSON EC. Co-culture of Kluyveromyces marxianus and Meyerozyma guilliermondii with in situ product recovery of 2-phenylethanol[J]. Journal of Agricultural and Food Chemistry, 2023, 71(23): 8991-8997.
|
| [46] |
de BRABANDER P, UITTERHAEGEN E, VERHOEVEN E, VANDER CRUYSSEN C, de WINTER K, SOETAERT W. In situ product recovery of bio-based industrial platform chemicals: a guideline to solvent selection[J]. Fermentation, 2021, 7(1): 26.
|
| [47] |
黄友和, 杨尚彤, 周志强, 熊娟, 陈洪, 刘玉姮, 姜兴涛. 植物和微生物合成2-苯乙醇的研究进展[J]. 食品科学技术学报, 2014, 32(4): 41-44. HUANG YH, YANG ST, ZHOU ZQ, XIONG J, CHEN H, LIU YH, JIANG XT. Study on synthesis of 2-phenylethanol by microbes and plants[J]. Journal of Food Science and Technology, 2014, 32(4): 41-44 (in Chinese). |
| [48] |
王航, 孟春, 石贤爱, 郭养浩. 2-苯乙醇对酿酒酵母生理生化特性影响[J]. 微生物学通报, 2012, 39(6): 749-755. WANG H, MENG C, SHI XA, GUO YH. Effects of 2-phenylethanol on physiological and biochemical characteristics of Saccharomyces cerevisiae[J]. Microbiology China, 2012, 39(6): 749-755 (in Chinese). |
| [49] |
XIA HL, KANG Y, MA ZL, HU CY, YANG Q, ZHANG XL, YANG SH, DAI J, CHEN X. Evolutionary and reverse engineering in Saccharomyces cerevisiae reveals a Pdr1p mutation-dependent mechanism for 2-phenylethanol tolerance[J]. Microbial Cell Factories, 2022, 21(1): 269.
|
| [50] |
HOLYAVKIN C, TURANLı-YıLDıZ B, YıLMAZ Ü, ALKıM C, ARSLAN M, TOPALOĞLU A, KıSAKESEN Hİ, de BILLERBECK G, FRANÇOIS JM, ÇAKAR ZP. Genomic, transcriptomic, and metabolic characterization of 2-phenylethanol-resistant Saccharomyces cerevisiae obtained by evolutionary engineering[J]. Frontiers in Microbiology, 2023, 14: 1148065.
|
| [51] |
YANG QL, LIU SP, ZHAO YZ, HAN X, CHANG R, MAO J. Enzymatic properties and inhibition tolerance analysis of key enzymes in β-phenylethanol anabolic pathway of Saccharomyces cerevisiae HJ[J]. Synthetic and Systems Biotechnology, 2023, 8(4): 772-783.
|
| [52] |
ZHAN YY, XU HX, TAN HT, HO YS, YANG DX, CHEN SW, OW DSW, LV X, WEI F, BI XZ, CHEN SW. Systematic adaptation of Bacillus licheniformis to 2-phenylethanol stress[J]. Applied and Environmental Microbiology, 2023, 89(2): e0156822.
|
| [53] |
WANG YQ, LIU F, LU XY, ZONG H, ZHUGE B. Regulatory mechanisms and cell membrane properties of Candida glycerinogenes differ under 2-phenylethanol addition or fermentation conditions[J]. Biotechnology Journal, 2024, 19(1): e2300181.
|
| [54] |
SHEN YP, NIU FX, YAN ZB, FONG LS, HUANG YB, LIU JZ. Recent advances in metabolically engineered microorganisms for the production of aromatic chemicals derived from aromatic amino acids[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 407.
|
| [55] |
GUO DY, ZHANG LH, KONG SJ, LIU ZJ, LI X, PAN H. Metabolic engineering of Escherichia coli for production of 2-phenylethanol and 2-phenylethyl acetate from glucose[J]. Journal of Agricultural and Food Chemistry, 2018, 66(23): 5886-5891.
|
| [56] |
WANG GL, WANG MY, YANG JC, LI Q, ZHU NQ, LIU LX, HU XM, YANG XP. De novo synthesis of 2-phenylethanol from glucose by metabolically engineered Escherichia coli[J]. Journal of Industrial Microbiology and Biotechnology, 2023, 49(6): kuac026.
|
| [57] |
ZHAN YY, SHI J, XIAO Y, ZHOU F, WANG H, XU HX, LI Z, YANG SH, CAI DB, CHEN SW. Multilevel metabolic engineering of Bacillus licheniformis for de novo biosynthesis of 2-phenylethanol[J]. Metabolic Engineering, 2022, 70: 43-54.
|
| [58] |
XU H, LI Z, LI LY, XIE XM, CAI DB, WANG Z, ZHAN YY, CHEN SW. Sustainable production of 2-phenylethanol from agro-industrial wastes by metabolically engineered Bacillus licheniformis[J]. LWT, 2023, 173: 114414.
|
| [59] |
ZHU LH, WANG JH, XU S, SHI GY. Improved aromatic alcohol production by strengthening the shikimate pathway in Saccharomyces cerevisiae[J]. Process Biochemistry, 2021, 103: 18-30.
|
| [60] |
KONG SJ, PAN H, LIU XY, LI X, GUO DY. De novo biosynthesis of 2-phenylethanol in engineered Pichia pastoris[J]. Enzyme and Microbial Technology, 2020, 133: 109459.
|
| [61] |
LARROUDE M, NICAUD JM, ROSSIGNOL T. Yarrowia lipolytica chassis strains engineered to produce aromatic amino acids via the shikimate pathway[J]. Microbial Biotechnology, 2021, 14(6): 2420-2434.
|
| [62] |
GU Y, MA JB, ZHU YL, DING XY, XU P. Engineering Yarrowia lipolytica as a chassis for de novo synthesis of five aromatic-derived natural products and chemicals[J]. ACS Synthetic Biology, 2020, 9(8): 2096-2106.
|
| [63] |
ZHU NQ, XIA WJ, WANG GL, SONG YH, GAO XX, LIANG JL, WANG Y. Engineering Corynebacterium glutamicum for de novo production of 2-phenylethanol from lignocellulosic biomass hydrolysate[J]. Biotechnology for Biofuels and Bioproducts, 2023, 16(1): 75.
|
| [64] |
GAO H, WANG HX, ZHANG YQ, WANG YJ, LIU GN, ZHAO QY, YU ZY, XIN FX, ZHANG WM. Design and optimization of artificial light-driven microbial consortia for the sustainable growth and biosynthesis of 2-phenylethanol[J]. Chemical Engineering Journal, 2023, 466: 143050.
|
| [65] |
XU ZW, LIN LC, CHEN Z, WANG K, SUN J, ZHU TH. The same genetic regulation strategy produces inconsistent effects in different Saccharomyces cerevisiae strains for 2-phenylethanol production[J]. Applied Microbiology and Biotechnology, 2022, 106(11): 4041-4052.
|
| [66] |
MACHAS MS, McKENNA R, NIELSEN DR. Expanding upon styrene biosynthesis to engineer a novel route to 2-phenylethanol[J]. Biotechnology Journal, 2017, 12(10): 10.1002/biot. 201700310.
|
| [67] |
MO QW, CHEN HY, FAN C, ZHANG DL, LIU LR, FU BX, YUAN JF. Utilization of a styrene-derived pathway for 2-phenylethanol production in budding yeast[J]. Applied Microbiology and Biotechnology, 2021, 105(6): 2333-2340.
|
| [68] |
DRĘŻEK K, KOZŁOWSKA J, DETMAN A, MIERZEJEWSKA J. Development of a continuous system for 2-phenylethanol bioproduction by yeast on whey permeate-based medium[J]. Molecules, 2021, 26(23): 7388.
|
| [69] |
LINDSAY MA, GRANUCCI N, GREENWOOD DR, VILLAS-BOAS SG. Fermentative production of volatile metabolites using Brettanomyces bruxellensis from fruit and vegetable by-products[J]. Fermentation, 2022, 8(9): 457.
|
| [70] |
ZHOU R, SONG QY, XIA HL, SONG N, YANG Q, ZHANG XL, YAO L, YANG SH, DAI J, CHEN X. Isolation and identification of non-Saccharomyces yeast producing 2-phenylethanol and study of the Ehrlich pathway and shikimate pathway[J]. Journal of Fungi, 2023, 9(9): 878.
|
| [71] |
USAI G, CORDARA A, RE A, POLLI MF, MANNINO G, BERTEA CM, FINO D, PIRRI CF, MENIN B. Combining metabolite doping and metabolic engineering to improve 2-phenylethanol production by engineered cyanobacteria[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10: 1005960.
|
| [72] |
CHENG J, ZHANG CB, ZHANG KD, LI JS, HOU YY, XIN JC, SUN Y, XU CS, XU W. Cyanobacteria-mediated light-driven biotransformation: the current status and perspectives[J]. ACS Omega, 2023, 8(45): 42062-42071.
|
 2024, Vol. 40
2024, Vol. 40