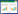中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张敏, 杨舒雅, 高大宽
- ZHANG Min, YANG Shuya, GAO Dakuan
- 稀有糖D-阿洛糖的生理功能研究进展
- Research progress in physiological function of the rare sugar D-allose
- 生物工程学报, 2024, 40(7): 2010-2021
- Chinese Journal of Biotechnology, 2024, 40(7): 2010-2021
- 10.13345/j.cjb.230544
-
文章历史
- Received: August 3, 2023
- Accepted: March 13, 2024
- Published: March 28, 2024
2. 空军军医大学基础医学院免疫教研室, 陕西 西安 710032
2. Department of Immunology, School of Basic Medical Sciences, Air Force Medical University, Xi'an 710032, Shaanxi, China
国际稀有糖协会(International Society of Rare Sugars, ISRS)对稀有糖的定义为,在自然界中存在但含量极少的一类单糖及其衍生物。稀有糖的味道与蔗糖类似,但具有热量低、稳定性高、低甜度等优点,可以弥补传统甜味剂的不足,对改善特殊人群的饮食起到重要作用,在食品、保健、医药等领域都具有较为广泛的应用。目前,科学家在自然界中已经发现了50多种稀有糖,包括D-阿洛酮糖(D-psicose)、D-塔格糖(D-tagatose)、D-甘露糖(D-mannose)、海藻糖(trehalose)、L-阿拉伯糖(L-arabinose)等。D-阿洛酮糖可通过多种途径调节机体的脂代谢及血糖代谢,具有控制肥胖和糖尿病的功效[1]。D-塔格糖可保护植物免受霜霉病的侵害,具有被开发为农用杀菌剂的潜力[2]。而D-阿洛糖因其独特的抗氧化、抗炎特性,成为近年来稀有糖研究的热点(表 1)。
| Rare sugar | Physiological functions | References |
| D-allose | Anti-inflammatory; anti-oxidation; anti-cancer; immunosuppression | [3-5] |
| D-psicose | Anti-inflammatory; anti-oxidation; anti-obesity; anti-diabetes | [1] |
| D-tagatose | Caries prevention; prebiotic function; anti-obesity; anti-diabetes | [6] |
| D-mannose | Skin care; prevent and relieve urinary tract infections; anti-cancer; immunoregulation | [7] |
D-阿洛糖来源于非洲灌木叶子,属稀有糖,是一种天然己醛糖。D-阿洛糖具有类似于D-葡萄糖和D-阿洛酮糖的化学结构(图 1),常存在于一些天然植物的提取物和细菌代谢物中。
|
| 图 1 不同化合物的化学结构式 Fig. 1 Chemical structures of different compounds. |
| |
D-阿洛糖是一种白色无味的晶体,分子式为C6H12O6,分子量为180.16,熔点为128 ℃,在水中有较高的溶解度,不溶于甲醛、无热量,是一种低卡路里甜味剂。Iga等[8]研究了D-阿洛糖对大鼠的急性和亚慢性毒性,动物实验结果显示,急性毒性实验中,半数致死量(lethal dose 50%, LD50)为20.5 g/kg;亚慢性毒性实验中,持续喂食6个月后,大多数血清化学和血液学指标无明显变化,表明D-阿洛糖对大鼠没有毒性。
1.2 D-阿洛糖的合成由于D-阿洛糖在自然界中含量极少,仅从自然界中提取满足不了人们的需求,因此,需要实现D-阿洛糖的大规模生产。目前,合成D-阿洛糖的方法主要有化学合成法和生物转化法。相较于化学合成法,生物转化法具有产生副产物少、对环境污染小、生产率高、选择性好、步骤简便等诸多优点,因此,常用生物转化法生产D-阿洛糖。
最初的生物转化法是利用D-阿洛酮糖为底物,以L-鼠李糖异构酶(L-rhamnose isomerase, L-RI)或者含有L-RI的微生物、D-核糖-5-磷酸异构酶、D-半乳糖-6-磷酸异构酶异构化生成D-阿洛糖。但由于D-阿洛酮糖本身也是稀有糖,价格相对比较昂贵,因此,将D-阿洛酮糖作为底物,生产成本过高,不能满足大规模生产的需要[9]。经过长期探索,2006年Izumoring策略[10]揭示了果糖也可以作为底物生产D-阿洛糖。D-阿洛酮糖是D-果糖的C-3差向异构体,以D-果糖为原料,利用两种新型异构酶:D-阿洛酮糖-3-差相异构酶(D-psicose-3-epimerase, DPE)和L-RI依次转化获得D-阿洛酮糖和D-阿洛糖,转化效率分别为27.34%和34.64%。这种方法能够降低D-阿洛糖的生产成本,已成为现阶段实验室生产D-阿洛糖的主要方式[11]。后续郭元亨等[12]利用重组大肠杆菌,以D-阿洛酮糖为底物进行生物转化获得D-阿洛糖,将反应混合液中25%的D-阿洛酮糖转化成了D-阿洛糖。前期生产D-阿洛糖的方法大多为体外酶催化的Izumoring差向异构化,而郑灵洁[13]在最新研究中构建了一个从D-葡萄糖到D-阿洛糖的体内Izumoring途径,在最佳发酵条件下,大肠杆菌细胞合成工厂能够产生约19.01 mg/L的D-阿洛糖。基于CRISPR/Cas9技术改造酿酒酵母合成D-阿洛糖的产量为1.69 g/L[14]。因此,采用微生物发酵的方式合成D-阿洛糖或将进一步推动稀有糖的绿色生产。
1.3 D-阿洛糖的体内代谢在大肠杆菌中,D-阿洛糖先与D-阿洛糖结合蛋白结合,后续通过ABC转运蛋白以及转运组分这两种蛋白形成的转运系统,即ABC转运体,从细胞膜进入细胞质。细胞质中的D-阿洛糖激酶、D-阿洛糖-6-磷酸异构酶和D-阿洛酮糖-6-磷酸-3-差向异构酶在糖酵解途径中通过两种中间体D-阿洛糖-6-磷酸(D-allose-6-phosphate, A6P)和D-阿洛酮糖-6-磷酸的顺序酶反应将D-阿洛糖转化为D-果糖-6-磷酸[15]。
在大鼠体内,摄入的D-阿洛糖主要通过小肠中的钠依赖性葡萄糖共转运蛋白1 (sodium-dependent glucose cotransporter 1, SGLT1)吸收,然后转运到尿液中。同时,SGLT1介导肠道中D-葡萄糖的转运。D-阿洛糖可能通过SGLT1与葡萄糖竞争肠道吸收,从而调节餐后血糖水平[16]。大部分摄入的D-阿洛糖在小肠中被吸收,未吸收的D-阿洛糖流入大肠,可能会通过作用于肠道微生物组来发挥生理作用。Shintani等[17]分析了老年小鼠的肠道微生物组,结果表明长期摄入D-阿洛糖改变了与代谢紊乱及肠道健康相关的肠道微生物菌群。
2 D-阿洛糖的生理功能 2.1 抗氧化性能早期已有研究表明,D-阿洛糖可以抑制高盐诱导高血压的发展,减少主动脉中超氧化物的生成[18]。同时,Hirooka等[19]通过将大鼠眼压升高至130 mm Hg并维持45 min构建视网膜缺血再灌注损伤模型,缺血前腹腔注射D-阿洛糖能够减少血氧分压的水平,通过抑制谷氨酸的增加和过氧化氢的产生,对视网膜缺血再灌注损伤发挥保护作用。随后,Nakamura等[4]在戊巴比妥钠麻醉下,插入线栓对大鼠进行短暂性大脑中动脉闭塞诱导局灶性脑缺血,1 h后取出线栓实现再灌注,给脑缺血再灌注损伤后的大鼠静脉注射D-阿洛糖,发现氧化损伤标志物脱嘌呤/嘧啶位点的数量显著减少,8-羟基脱氧鸟苷的水平显著降低,提示D-阿洛糖具有抗氧化作用。该课题组进一步研究发现,D-阿洛糖可通过抑制谷氨酸和乳酸的释放以及氧化应激发挥神经保护作用,减少神经元死亡,减轻功能缺陷[20]。随着D-阿洛糖抗氧化性能相关研究的逐渐深入,有学者探索了D-阿洛糖在该方面应用的可能性。D-阿洛糖可以作为添加剂在哺乳动物细胞的冻存过程中提供保护,同时Muneuchi等[21]的研究结果显示对照组髓过氧化物酶(myeloperoxidase, MPO)活性为0.72 mU/mg,D-阿洛糖组为0.40 mU/mg,D-阿洛糖通过抑制中性粒细胞活性来减少大鼠皮瓣缺血再灌注后的损伤,由于其安全性高,D-阿洛糖有望开发成一种用于皮瓣手术的抗氧化剂。Kashiwagi等[22]检测了D-阿洛糖培养对大鼠胰腺中分离出的胰岛的影响,研究提示D-阿洛糖可以通过其抗氧化活性改善受损胰岛的功能。Ozaki等[23]最新研究提示用D-阿洛糖部分代替D-葡萄糖可以改善大鼠腹膜透析液诱导的腹膜损伤和高血糖,减少氧化应激。
有学者对D-阿洛糖抗氧化性能的机制进行了初步探索。研究发现[24],只有当体内外存在氧化应激环境时,D-阿洛糖才表现出抗氧化能力进而清除活性氧(reactive oxygen species, ROS)。Mooradian等[25]体外培养人冠状动脉内皮细胞,用D-阿洛糖处理后,发现超氧化物生成减少;在使用H2O2产生过氧化物(superoxide, SO)的无细胞系统中,D-阿洛糖对超氧化物、羟基自由基和过氧化基的清除能力均高于D-葡萄糖;同时D-阿洛糖可以减少内质网应激。有学者进一步深入研究了D-阿洛糖抗氧化活性的机制,结果表明,D-阿洛糖并不通过直接清除ROS或影响抗氧化物酶的活性来发挥抗氧化作用,而是通过竞争性地抑制D-葡萄糖诱导的ROS产生和ATP合成从而降低细胞内的ROS水平[26]。D-阿洛糖与其他类型抗氧化剂的比较见表 2。
| Mechanism | Clinical application | Adverse reaction | References | |
| D-allose | Reduce cellular oxidative stress levels; reduce endoplasmic reticulum stress | None | None | [25, 27] |
| Coenzyme Q10 (CoQ10) | Reduce cellular oxidative stress levels; improve mitochondrial function; antiapoptotic effect; involved in gene regulation; anti-inflammatory effect; synergistic effect | Heart failure; parkinsonism; diabetes; idiopathic oligoasthenospermia; female infertility | Epigastric discomfort, nausea, loss of appetite and diarrhea | [28] |
| Glutathione (GSH) | Reduce cellular oxidative stress levels; antiapoptotic effect; involved in cytokine transcription and signaling pathway regulation | Liver injury; kidney injury; cardiovascular disease | Eruption; pale face; blood pressure drop; abnormal pulse | [29] |
| Lipoic acid (LA) | Reduce cellular oxidative stress levels; chelating metal ions; regenerate other endogenous antioxidants | Diabetes; ischemia-reperfusion injury; antitumor; atherosclerosis | Lip numbness; anaphylactic shock | [30] |
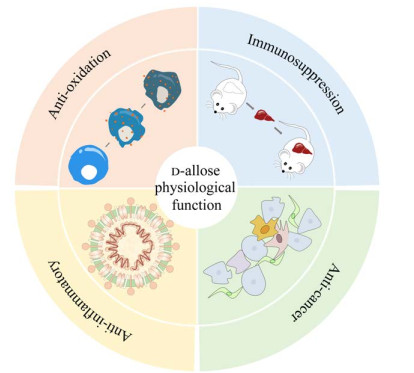
脑缺血再灌注损伤涉及多种独立的致死机制,由活化的白细胞介导的炎症反应在其中起着重要作用。而D-阿洛糖已被证明对肝、肾和视网膜中活化的白细胞有抑制作用,包括免疫抑制作用、抗炎作用和抗氧自由基作用。因此本课题组前期推测,D-阿洛糖可能通过抑制炎症反应来减轻脑缺血再灌注损伤,可能通过改善血流动力学、保护血脑屏障、减少活性自由基以及抑制活化的白细胞进而发挥神经保护作用[31]。后续,本课题组研究了D-阿洛糖的潜在抗炎作用,结果表明,D-阿洛糖对急性脑缺血再灌注损伤有明显的保护作用。白细胞浸润到脑缺血再灌注损伤区域产生MPO,环氧化酶-2 (cyclooxygenase, COX-2)通过炎症和氧化应激参与各种病理生理过程。经D-阿洛糖处理后皮层MPO阳性细胞数量由293个/mm2显著下降至214个/mm2,COX-2阳性细胞数量由727个/mm2显著下降至519个/mm2;利用D-阿洛糖进行处理,可显著减小脑梗死体积,MPO活性也受到显著抑制,这表明D-阿洛糖处理能够减少中性粒细胞对缺血组织的浸润,同时减少了COX-2阳性细胞的数量和小胶质细胞的活化[3]。本课题组首次证明了D-阿洛糖在脑缺血再灌注损伤中的抗炎作用。D-阿洛糖可能为急性缺血性卒中的治疗提供新的策略和思路[3]。由于抗炎作用涉及的相关机制尚不明确,我们对其进行了初步探索。进一步研究结果显示,D-阿洛糖处理能够抑制脑缺血再灌注损伤中的早期细胞凋亡、减弱血脑屏障通透性、抑制多种炎症因子及炎症相关分子的表达。同时抗炎作用的潜在机制涉及到PPARγ的依赖性激活。PPARγ是调节白细胞浸润脑缺血再灌注损伤区域引起的炎症反应的重要信号转导途径的一部分。D-阿洛糖处理能够诱导PPARγ上调,肿瘤坏死因子(tumor necrosis factor-α, TNF-α)和核因子κB (nuclear factor kappa-B, NF-κB)下调,加入PPARγ抑制剂GW9662后,PPARγ表达下调,TNF-α和NF-κB表达上调,提示D-阿洛糖可能通过PPARγ依赖性调节NF-κB来减轻炎症反应,从而对缺血再灌注后的血脑屏障发挥保护作用[32]。最新研究表明,D⁃阿洛糖处理对神经元细胞损伤有保护作用,D-阿洛糖通过下调缺血性卒中后的半乳糖凝集素-3 (galectin-3, Gal-3)抑制TLR4/PI3K/AKT信号传导来减轻神经炎症和神经元凋亡,同时Gal-3与多种炎症性疾病紧密相关,提示Gal-3可作为D-阿洛糖的潜在治疗靶分子[33-35]。顺铂是一种有效的抗肿瘤药物,但在治疗过程中有剂量依赖的肾毒性,当其与D-阿洛糖联合使用时,抗肿瘤效果更佳,D-阿洛糖可能通过抑制肾脏炎症来减轻顺铂诱导的肾毒性[36]。有研究发现 [37],D-阿洛糖通过抑制炎性细胞因子TNF-α、白细胞介素-6 (interleukin-6, IL-6)和IL-1β的表达来减少缺血再灌注造成的脑损伤。Ju等[27]最新研究显示,D-阿洛糖可能是通过下调MKP-1表达,进一步激活ERK1/2信号通路来抑制缺血再灌注损伤后产生的氧化应激和炎症。D-阿洛糖的生理功能见图 2。
|
| 图 2 D-阿洛糖的生理功能 Fig. 2 Physiological function of D-allose. |
| |
D-阿洛糖已被证明能够以剂量依赖的方式对多种恶性肿瘤细胞起到生长抑制作用,如人卵巢癌细胞系(human ovarian carcinoma cells, OVCAR-3)、人肝癌细胞系(hepatocellular carcinoma cells, HuH-7)、人激素难治性前列腺癌细胞系(hormone refractory prostate cancer cells, HRPC)、人口腔癌细胞系(tongue carcinoma, HSC-3)、白血病细胞系(T-cell lymphoblastic leukemia, MOLT-4F)、人乳腺癌细胞(caucasian breast adenocarcinoma, MDA-MB-231)、人神经母细胞瘤细胞(neuroblastoma, SH-SY5Y)、非小细胞肺癌细胞(non-small cell lung cancer cells, NSCLC)、路易斯肺癌细胞(Lewis lung carcinoma cell, LLC)、膀胱癌细胞(bladder cancer, BC)等[38-39]。进一步研究发现,D-阿洛糖不仅在体外能抑制肝癌、口腔癌、非小细胞肺癌细胞系的生长,还能在动物体内抑制肿瘤发展、减小肿瘤体积[40]。
D-阿洛糖对癌细胞增殖具有显著的抑制作用,但确切的机制尚不清楚。有研究显示[15],D-阿洛糖在体外能够诱导细胞凋亡及G2/M期停滞。而另一位学者的研究表明[41],D-阿洛糖处理诱导了HRPC程序性细胞死亡及G1期停滞,细胞凋亡可能是由于线粒体介导的内在凋亡途径的调节。有学者研究了D-阿洛糖对HuH-7、BC两种癌细胞增殖作用的潜在分子机制,结果表明[39],D-阿洛糖可能通过诱导细胞周期抑制剂p27kip1蛋白和硫氧还蛋白相互作用蛋白(thioredoxin interacting protein, TXNIP)上调,进而上调ROS发挥抗癌作用,与之前研究不同的是,D-阿洛糖诱导G1期停滞,不诱导细胞凋亡。Ishiyama等[42]研究发现,D-阿洛糖通过转化为A6P在MOLT-4F细胞内发挥抗增殖作用。为了更好地利用D-阿洛糖的活性,合成了A6P衍生物1。与D-阿洛糖相比,A6P衍生物1诱导细胞死亡而不是细胞周期停滞;同时,A6P衍生物1显著减少了TXNIP表达,提示A6P衍生物1可能与TXNIP产生了未知机制的协同作用,有待进一步探索。最新研究结果表明,D-阿洛糖通过诱导自噬增强对肺癌细胞生长的抑制作用[43]。Noguchi等[38]研究表明,D-阿洛糖能够以剂量依赖的方式抑制葡萄糖转运蛋白1 (glucose transporter 1, GLUT1)表达,同时降低了癌症细胞对葡萄糖的摄取。推测D-阿洛糖可能通过下调GLUT1表达和葡萄糖摄取进而影响HuH-7、MDA-MB-231、SH-SY5Y这3种癌细胞生长(表 3)。
| Cancer type | Cell/Animal model | Mechanism | References |
| Ovarian cancer | OVCAR-3 | G2/M cell cycle arrest, apoptosis | [15] |
| Liver cancer | HuH-7, F344 rat | G1 cell cycle arrest, no apoptosis, TXNIP, p27kip1, GLUT1 | [38] |
| Prostatic cancer | HRPC | G1 cell cycle arrest, apoptosis | [41] |
| Head and neck cancer | HSC-3, BALB/c nu/nu mice | TXNIP, ROS, apoptosis, G2/M cell cycle arrest | [44] |
| Leukemia | MOLT-4F | TXNIP | [42] |
| Breast cancer | MDA-MB-231 | TXNIP, GLUT1 | [38] |
| Neuroblastoma | SH-SY5Y | TXNIP, GLUT1 | [38] |
| Lung cancer | NSCLC, LLC, BALB/c-nu mice, C57BL/6J mice | TXNIP; G2/M cell cycle arrest, LC3-Ⅱ | [43] |
| Bladder cancer | BC | TXNIP, ROS | [39] |
Arnold等[5]在体内实验中发现,D-阿洛糖以剂量依赖的方式显著抑制分叶核中性粒细胞的产生并降低血小板计数且没有明显副作用,提示D-阿洛糖可作为免疫抑制剂在组织、器官移植过程中发挥作用。有研究发现D-阿洛糖有免疫抑制作用[45],在大鼠同种异体原位肝移植6个月后,测得D-阿洛糖组大鼠存活率为61.54%;FK506 (一种强效免疫抑制剂)组存活率为46.15%;D-阿洛糖与FK506联合治疗组为69.23%。与单独给药相比,当D-阿洛糖与FK506联合治疗时,大鼠同种异体原位肝脏移植效果更好,不仅如此,D-阿洛糖还能够显著降低FK506治疗后的肾毒性。该研究证明了D-阿洛糖在肝移植大鼠中的免疫抑制作用,但具体机制还有待深入研究。该课题组进一步研究发现[46],D-阿洛糖预处理降低了MPO活性,减少了血液中中性粒细胞的数量,提高了组织中ATP的含量,最终显著减轻了肝组织的损伤,提示D-阿洛糖主要通过抑制活化的中性粒细胞对缺血再灌注所导致的肝损伤发挥保护作用。Tanaka等[47]检测了D-阿洛糖对树突状细胞(dendritic cells, DCs)内吞活性及随后对T细胞刺激的影响,实验结果表明,D-阿洛糖处理后,DCs内吞作用显著降低,同时诱导T细胞凋亡。随后有学者对D-阿洛糖的免疫反应进行了深入探索,研究了其对鼠树突状细胞因子产生的影响,结果显示,D-阿洛糖对浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC)产生的细胞因子具有选择性抑制作用,并且推测D-阿洛糖可能通过减弱丝裂原活化蛋白激酶(mitosolysis activates protein kinase, MAPK)家族的磷酸化来抑制pDC细胞因子的产生[48]。Chen等[49]采用气相色谱-质谱技术分析COVID-19患者血清代谢组的变化,发现与对照组相比,患者血清中的D-阿洛糖含量增加,推测D-阿洛糖的升高可能引起细胞免疫功能下降。D-阿洛糖与其他类型免疫抑制剂的比较见表 4。
| Mechanism | Clinical application | Adverse reaction | References | |
| D-allose | Inhibit the activation of neutrophils; induce T cell apoptosis; selective inhibition of cytokines produced by pDC | None | None | [46] |
| Cyclophosphamide (CTX) | G1/S cell cycle arrest; induced apoptosis; regulate Th1, Th2 cytokines | Nephrotic syndrome; antitumor | Gastrointestinal adverse reactions; liver function injury; leukopenia; reproductive toxicity; hemorrhagic cystitis; alopecia | [50] |
| Cyclosporine A (CsA) | Inhibition of T lymphocyte activation and proliferation; G0/G1 cell cycle arrest; inhibit the transcriptional activation of genes encoding inflammatory factors such as IL-2 and IL-4 | Organ transplantation; leukaemia; nephrotic syndrome | Gastrointestinal adverse reactions; liver and kidney damage; leukopenia; neurotoxicity; hyperkalemia; hairy, gingival hyperplasia with bleeding and pain | [51] |
| Tacrolimus (FK506) | Inhibition of T lymphocyte activation; inhibition of cytokine transcription; affect production and expression of IL-2, IL-3 and other cytokines | Organ transplantation; dermatosis; nephrotic syndrome | Gastrointestinal adverse reactions; liver and kidney damage; leukocytosis; neurotoxicity; hyperkalemia and hypomagnesia; hypertension | [51-52] |
全球肥胖患病率的迅速增加部分归因于添加糖的过度食用。蔗糖作为传统的甜味剂,在食品加工中有着非常重要的地位,但蔗糖具有高热量、高甜度、易导致肥胖等诸多缺点。目前,人造甜味剂因低热量、升血糖慢等特点被广泛应用于食品生产过程,许多食品加工厂使用无热量的人造甜味剂来替代高热量的蔗糖,但常用的无热量人造甜味剂可能对健康产生不利影响[53]。天然稀有糖同时具有低卡路里的特点和食用糖口感,可被用作安全低热量的甜味剂。D-阿洛糖热量低、稳定性高,目前的动物实验表明,大剂量、长期应用D-阿洛糖没有已知的毒副作用[8]。同时,D-阿洛糖具有食用糖80%的甜度,还可以发生美拉德反应,从而改变食物的香气和色泽,因此,成为替代食用糖的理想候选者[54]。D-阿洛糖也可被用在保健品中。口服D-阿洛糖可以提高老年小鼠中有利肠道菌群的比例,改善老年雄性小鼠的肠道环境[17]。因此,D-阿洛糖在食品领域具有非常广泛的应用前景。
3.2 在临床治疗中的应用由于D-阿洛糖具有较为广泛的生理功能,因此,可被用作药物制剂在临床治疗中发挥作用。D-阿洛糖已被证明具有抗氧化、抗炎、抗癌及抗肿瘤、免疫抑制和冷冻保护作用,目前,多位学者还在探索其在抗肿瘤应用方面的可能性[38-42]。D-阿洛糖没有已知的副作用,且用该糖与抗肿瘤药物、自噬抑制剂、免疫抑制剂等诸多专项药物联合治疗时,在增强药物作用的基础上,降低了药物治疗带来的毒副作用。5-氟尿嘧啶为常用的抗肿瘤药物,当其与D-阿洛糖联合使用时,抗肿瘤作用及TXNIP蛋白表达显著增强[36]。羟氯喹(一种自噬抑制剂)与D-阿洛糖共同处理小鼠后,小鼠肿瘤体积减小[43]。同时,D-阿洛糖也可以增强癌症放疗疗效,减少放疗带来的不良生理反应。D-阿洛糖可以增强头颈部癌细胞的放疗效果;能够增强多西他赛的抗癌作用,同时降低多西他赛治疗造成的毒副作用。最新的研究证明,D-阿洛糖、多西他赛和放疗联合治疗,可以在体内头颈部癌症模型中使抗肿瘤功效发挥到最大,同时,D-阿洛糖给药可以减少放疗后的不良生理病理反应[44]。因此,D-阿洛糖和其他特异性药物组合可能更有利于疾病的治疗。综上所述,D-阿洛糖作为一种药物制剂在临床治疗中具有巨大的应用潜力。
4 总结与展望D-阿洛糖作为一种稀有糖,在自然界中含量极少,化学合成和生物转化法常用于合成D-阿洛糖。化学合成法具有选择专一性差、副产物多、污染大等诸多缺点;生物转化法的研究还停留在实验室阶段,尚无大规模生产的报道,主要有以下3个方面的原因:(1) 以D-阿洛酮糖为底物生产D-阿洛糖的成本过高,难以满足大规模生产的需要。(2) 以D-果糖为底物生产D-阿洛糖时可以利用的异构酶包括D-塔格糖-3-差相异构酶(D-tagatose-3-epimerase, DTE)、DPE和L-RI。其中,DTE的最适底物是D-塔格糖,DPE的最适底物是D-阿洛酮糖,L-RI的最佳底物是鼠李糖,对D-阿洛酮糖的催化活性较低,均不适合进行工业化生产。(3) 与酶法合成类似,微生物发酵合成D-阿洛糖的产量也很低,并且其中涉及的3个可逆异构化反应可能严重影响到D-阿洛糖的产率。这导致了D-阿洛糖价格昂贵,限制了相关的功能开发,迫切需要更多研究探索D-阿洛糖的工业化扩大生产。酶法合成与微生物发酵合成联合使用或将提高生产D-阿洛糖的效率和效益。
D-阿洛糖热量低、稳定性高、没有明显副作用且具有抗炎抗氧化等多种生理功能。本课题组长期以来从事D-阿洛糖对缺血性脑损伤的神经保护作用研究,首次证明了D-阿洛糖可能通过其抗炎作用对脑缺血再灌注损伤发挥保护作用,并对其机制进行了初步探讨。本课题组最新研究结果显示[55],D-阿洛糖通过抑制内质网应激来缓解脑缺血再灌注损伤。此外,D-阿洛糖的抗癌效果逐渐显现,有望将其开发为新型抗癌剂。但截至目前,抗癌作用的机制仅进行了初步研究,还有待进一步探索。D-阿洛糖在食品、临床治疗等领域都具有较为广泛的应用前景。D-阿洛糖是食品工业中蔗糖的潜在替代品,也是未来医疗保健产品的有效添加剂。尽管已经有了D-阿洛糖毒性相关的动物实验研究,但为了进行广泛应用,还需要对D-阿洛糖的安全性、毒理学以及在人体内的代谢途径等方面做进一步的系统性研究。相信随着D-阿洛糖相关研究的逐渐深入,D-阿洛糖会在食品、临床治疗、医疗保健等领域得到广泛应用。
| [1] |
XIA Y, CHENG QQ, MU WM, HU XY, SUN Z, QIU YY, LIU XM, WANG ZP. Research advances of D-allulose: an overview of physiological functions, enzymatic biotransformation technologies, and production processes[J]. Foods, 2021, 10(9): 2186. DOI:10.3390/foods10092186
|
| [2] |
MOCHIZUKI S, FUKUMOTO T, OHARA T, OHTANI K, YOSHIHARA A, SHIGEMATSU Y, TANAKA K, EBIHARA K, TAJIMA S, GOMI K, ICHIMURA K, IZUMORI K, AKIMITSU K. The rare sugar D-tagatose protects plants from downy mildews and is a safe fungicidal agrochemical[J]. Communications Biology, 2020, 3(1): 423. DOI:10.1038/s42003-020-01133-7
|
| [3] |
GAO DK, KAWAI N, NAKAMURA T, LU F, FEI Z, TAMIYA T. Anti-inflammatory effect of D-allose in cerebral ischemia/reperfusion injury in rats[J]. Neurologia Medico-Chirurgica, 2013, 53(6): 365-374. DOI:10.2176/nmc.53.365
|
| [4] |
NAKAMURA T, TANAKA S, HIROOKA K, TOYOSHIMA T, KAWAI N, TAMIYA T, SHIRAGA F, TOKUDA M, KEEP RF, ITANO T, MIYAMOTO O. Anti-oxidative effects of D-allose, a rare sugar, on ischemia-reperfusion damage following focal cerebral ischemia in rat[J]. Neuroscience Letters, 2011, 487(1): 103-106. DOI:10.1016/j.neulet.2010.10.004
|
| [5] |
ARNOLD EC, SILADY PJ. Use of D-allose as an immunosuppressive agent: US5620960[P]. 1997-04-15.
|
| [6] |
代艺伟. 多酶催化体系转化麦芽糊精合成D-塔格糖的研究[D]. 无锡: 江南大学博士学位论文, 2021. DAI YW. Biosynthesis of D-tagatose from maltodextrin by multi-enzyme catalytic system[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2021 (in Chinese). |
| [7] |
倪娓娓, 胡超群, 白福来, 季文娜, 张茜. D-甘露糖生产工艺及生理功能研究进展[J]. 食品工业科技, 2022, 43(17): 458-465. NI WW, HU CQ, BAI FL, JI WN, ZHANG Q. Research progress on the production technology and physiological function of D-mannose[J]. Science and Technology of Food Industry, 2022, 43(17): 458-465 (in Chinese). |
| [8] |
IGA Y, NAKAMICHI K, SHIRAI Y, MATSUO T. Acute and sub-chronic toxicity of D-allose in rats[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(7): 1476-1478. DOI:10.1271/bbb.100121
|
| [9] |
段爽爽. L-鼠李糖异构酶转化D-阿洛酮糖产D-阿洛糖的研究[D]. 济南: 齐鲁工业大学硕士学位论文, 2023. DUAN SS. Conversion of D-psicose by L-rhamnose isomerase to produce D-allose[D]. Jinan: Master's Thesis of Qilu University of Technology, 2023 (in Chinese). |
| [10] |
IZUMORI K. Izumoring: a strategy for bioproduction of all hexoses[J]. Journal of Biotechnology, 2006, 124(4): 717-22. DOI:10.1016/j.jbiotec.2006.04.016
|
| [11] |
刘梦璐, 袁卫涛, 李宁, 杨艳宇, 曹建帮, 高学秀. 功能性甜味剂D-阿洛酮糖研究进展[J]. 中国食品添加剂, 2022, 33: 21-25. LIU ML, YUAN WT, LI N, YANG YY, CAO JB, GAO XX. Research progress on functional sweetener D-allulose[J]. China Food Additives, 2022, 33: 21-25 (in Chinese). |
| [12] |
郭元亨, 王靖, 王小艳, 陶进, 陈博, 李义, 佟毅. 我国生物合成D-阿洛酮糖的研究及产业化进展[J]. 现代食品, 2020, 34-40. Guo YH, Wang J, Wang XY, TAO J, CHEN B, LI Y, TONG Y. Research and industrialization progress of D-psicose in China[J]. Modern Food, 2020, 34-40 (in Chinese). |
| [13] |
郑灵洁. 大肠杆菌合成D-阿洛糖的途径设计与发酵优化[D]. 北京: 北京化工大学硕士学位论文, 2021. ZHENG LJ. Metabolic engineering of Escherichia coli for D-allose synthesis and its fermentation optimization[D]. Beijing: Master's Thesis of Beijing University of Chemical Technology, 2021 (in Chinese) |
| [14] |
陈红. 基于CRISPR/Cas9技术改造酿酒酵母合成D-阿洛糖的研究[D]. 广州: 华南理工大学硕士学位论文, 2020. CHEN H. Research on the synthesis of D-allose with engineered Saccharomyces cerevisiae via CRISPR/Cas9[D]. Guangzhou: Master's Thesis of South China University of Technology, 2020 (in Chinese). |
| [15] |
CHOI MN, SHIN KC, KIM DW, KIM BJ, PARK CS, YEOM SJ, KIM YS. Production of D-allose from D-allulose using commercial immobilized glucose isomerase[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 681253. DOI:10.3389/fbioe.2021.681253
|
| [16] |
KISHIDA K, IIDA T, YAMADA T, TOYODA Y. D-allose is absorbed via sodium-dependent glucose cotransporter 1 (SGLT1) in the rat small intestine[J]. Metabolism Open, 2021, 11: 100112. DOI:10.1016/j.metop.2021.100112
|
| [17] |
SHINTANI T, YANAI SC, KANASAKI A, TANAKA M, IIDA T, OZAWA G, KUNIHIRO T, ENDO S. Long-term D-allose administration favorably alters the intestinal environment in aged male mice[J]. Journal of Applied Glycoscience, 2022, 69(4): 97-102. DOI:10.5458/jag.jag.JAG-2022_0005
|
| [18] |
JIANG SW, XIAO W, ZHU XX, YANG PZ, ZHENG Z, LU SH, JIANG ST, ZHANG GC, LIU JJ. Review on D-allulose: in vivo metabolism, catalytic mechanism, engineering strain construction, bio-production technology[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 26. DOI:10.3389/fbioe.2020.00026
|
| [19] |
HIROOKA K, KIUCHI Y. The retinal renin-angiotensin-aldosterone system: implications for glaucoma[J]. Antioxidants, 2022, 11(4): 610. DOI:10.3390/antiox11040610
|
| [20] |
LIU YN, NAKAMURA T, TOYOSHIMA T, SHINOMIYA A, TAMIYA T, TOKUDA M, KEEP RF, ITANO T. The effects of D-allose on transient ischemic neuronal death and analysis of its mechanism[J]. Brain Research Bulletin, 2014, 109: 127-131. DOI:10.1016/j.brainresbull.2014.10.005
|
| [21] |
MUNEUCHI G, HOSSAIN A, YAMAGUCHI F, UENO M, TANAKA Y, SUZUKI S, TOKUDA M. The rare sugar D-allose has a reducing effect against ischemia-reperfusion injury on the rat abdominal skin island flap model[J]. Journal of Surgical Research, 2013, 183(2): 976-981. DOI:10.1016/j.jss.2013.03.006
|
| [22] |
KASHIWAGI H, ASANO E, NOGUCHI C, SUI L, HOSSAIN A, AKAMOTO S, OKANO K, TOKUDA M, SUZUKI Y. Beneficial effect of D-allose for isolated islet culture prior to islet transplantation[J]. Journal of Hepato-Biliary-Pancreatic Sciences, 2016, 23(1): 37-42. DOI:10.1002/jhbp.298
|
| [23] |
OZAKI T, FU HY, ONISHI K, YOKOYAMA S, FUJITA T, TOBIUME A, SOFUE T, AKIMITSU K, MINAMINO T. Partial replacement of D-glucose with D-allose ameliorates peritoneal injury and hyperglycaemia induced by peritoneal dialysis fluid in rats[J]. Peritoneal Dialysis International, 2023, 8968608231184354.
|
| [24] |
ZHENG LJ, GUO Q, ZHANG YX, LIU CY, FAN LH, ZHENG HD. Engineering of Escherichia coli for D-allose fermentative synthesis from D-glucose through izumoring cascade epimerization[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10: 1050808. DOI:10.3389/fbioe.2022.1050808
|
| [25] |
MOORADIAN AD, HAAS MJ, ONSTEAD-HAAS L, TANI YM, IIDA T, TOKUDA M. Naturally occurring rare sugars are free radical scavengers and can ameliorate endoplasmic reticulum stress[J]. International Journal for Vitamin and Nutrition Research, 2020, 90(3/4): 210-220.
|
| [26] |
SHINTANI T, SAKOGUCHI H, YOSHIHARA A, IZUMORI K, SATO M. D-allose, a stereoisomer of D-glucose, extends the lifespan of Caenorhabditis elegans via sirtuin and insulin signaling[J]. Journal of Applied Glycoscience, 2019, 66(4): 139-142. DOI:10.5458/jag.jag.JAG-2019_0010
|
| [27] |
JU JH, HOU RX, ZHANG P. D-allose alleviates ischemia/reperfusion (I/R) injury in skin flap via MKP-1[J]. Molecular Medicine, 2020, 26(1): 21. DOI:10.1186/s10020-020-0138-6
|
| [28] |
郑锐哲, 毛旻韬, 杨西涛, 刘玉梅. 辅酶Q10通过抑制炎症损伤及细胞凋亡保护创伤性颅脑损伤[J]. 实用医学杂志, 2021, 37: 446-450. Zheng RZ, Mao MT, Yang XT, LIU YM. Protective effects of coenzyme Q10 on traumatic brain injury by inhibiting inflammatory injury and cell apoptosis[J]. The Journal of Practical Medicine, 2021, 37: 446-450 (in Chinese). DOI:10.3969/j.issn.1006-5725.2021.04.006 |
| [29] |
王小巍, 张红艳, 刘锐, 王东凯. 谷胱甘肽的研究进展[J]. 中国药剂学杂志(网络版), 2019, 17(4): 141-148. WANG XW, ZHANG HY, LIU R, WANG DK. Progress in research of glutathione[J]. Chinese Journal of Pharmaceutics (Online Edition), 2019, 17(4): 141-148 (in Chinese). |
| [30] |
贺奇凯, 黄丽娜. 硫辛酸的抗氧化临床应用最新研究进展[J]. 世界最新医学信息文摘, 2019, 19(16): 104, 106. HE QK, HUANG LN. The latest research progress of clinical application of lipoic acid in antioxidation[J]. World Latest Medicine Information, 2019, 19(16): 104, 106 (in Chinese). |
| [31] |
GAO DK, KAWAI N, TAMIYA T. The anti-inflammatory effects of D-allose contribute to attenuation of cerebral ischemia-reperfusion injury[J]. Medical Hypotheses, 2011, 76(6): 911-913. DOI:10.1016/j.mehy.2011.03.007
|
| [32] |
HUANG T, GAO DK, HEI Y, ZHANG X, CHEN XY, FEI Z. D-allose protects the blood brain barrier through PPARγ-mediated anti-inflammatory pathway in the mice model of ischemia reperfusion injury[J]. Brain Research, 2016, 1642: 478-486.
|
| [33] |
罗耀文, 程俊凯, 张敏, 苟茂荣, 李娟, 张磊, 高大宽. D-阿洛糖下调半乳糖凝集素-3抑制AMPK/mTOR通路减轻脑缺血再灌注损伤[J]. 安徽医科大学学报, 2023, 58: 1467-1473. LUO YW, CHENG JK, ZHANG M, GOU MR, LI J, ZHANG L, GAO DK. D-allose alleviate cerebral ischemia-reperfusion injury by down-regulating galectin-3 inhibition of the AMPK/mTOR pathway[J]. Acta Universitatis Medicinalis Anhui, 2023, 58: 1467-1473 (in Chinese). |
| [34] |
张敏, 费晓炜, 罗耀文, 付奕豪, 张磊, 高大宽. D-阿洛糖对OGD/R诱导的HT22细胞损伤及Gal-3表达的影响[J]. 中华神经创伤外科电子杂志, 2023, 9: 135-141. Zhang M, Fei XW, Luo YW, FU YH, ZHANG L, GAO DK. Effects of D-allose on OGD/R-induced HT22 cell damage and Gal-3 expression[J]. Chinese Journal of Neurotraumatic Surgery: Electronic Edition, 2023, 9: 135-141 (in Chinese). |
| [35] |
LUO YW, CHENG JK, FU YH, ZHANG M, GOU MR, LI J, LI XB, BAI J, ZHOU YF, ZHANG L, GAO DK. D-allose inhibits TLR4/PI3K/AKT signaling to attenuate neuroinflammation and neuronal apoptosis by inhibiting gal-3 following ischemic stroke[J]. Biological Procedures Online, 2023, 25(1): 30. DOI:10.1186/s12575-023-00224-z
|
| [36] |
ISKANDER A, YAN LJ. Cisplatin-induced kidney toxicity: potential roles of major NAD+-dependent enzymes and plant-derived natural products[J]. Biomolecules, 2022, 12(8): 1078. DOI:10.3390/biom12081078
|
| [37] |
HE J, ZHOU D, YAN B. Eriocitrin alleviates oxidative stress and inflammatory response in cerebral ischemia reperfusion rats by regulating phosphorylation levels of Nrf2/NQO-1/HO-1/NF-κB p65 proteins[J]. Annals of Translational Medicine, 2020, 8(12): 757. DOI:10.21037/atm-20-4258
|
| [38] |
NOGUCHI C, KAMITORI K, HOSSAIN A, HOSHIKAWA H, KATAGI A, DONG YY, SUI L, TOKUDA M, YAMAGUCHI F. D-allose inhibits cancer cell growth by reducing GLUT1 expression[J]. The Tohoku Journal of Experimental Medicine, 2016, 238(2): 131-141. DOI:10.1620/tjem.238.131
|
| [39] |
TOHI Y, TAOKA R, ZHANG X, MATSUOKA Y, YOSHIHARA A, IBUKI E, HABA R, AKIMITSU K, IZUMORI K, KAKEHI Y, SUGIMOTO M. Antitumor effects of orally administered rare sugar D-allose in bladder cancer[J]. International Journal of Molecular Sciences, 2022, 23(12): 6771. DOI:10.3390/ijms23126771
|
| [40] |
KHAJEH S, GANJAVI M, PANAHI G, ZARE M, ZARE M, TAHAMI SM, RAZBAN V. D-allose: molecular pathways and therapeutic capacity in cancer[J]. Current Molecular Pharmacology, 2023, 16(8): 801-810.
|
| [41] |
JEONG RU, LIM S, KIM MO, MOON MH. Effect of D-allose on prostate cancer cell lines: phospholipid profiling by nanoflow liquid chromatography-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2011, 401(2): 689-698. DOI:10.1007/s00216-011-5113-1
|
| [42] |
ISHIYAMA H, YANAGITA RC, TAKEMOTO K, KOBASHI K, SUGIYAMA Y, KAWANAMI Y. Development of a D-allose-6-phosphate derivative with anti-proliferative activity against a human leukemia MOLT-4F cell line[J]. Carbohydrate Research, 2020, 487: 107859. DOI:10.1016/j.carres.2019.107859
|
| [43] |
PENG X, ZHANG SL, JIAO WH, ZHONG ZX, YANG YQ, CLARET FX, ELKABETS M, WANG F, WANG R, ZHONG YX, CHEN ZS, KONG DX. Hydroxychloroquine synergizes with the PI3K inhibitor BKM120 to exhibit antitumor efficacy independent of autophagy[J]. Journal of Experimental & Clinical Cancer Research, 2021, 40(1): 374.
|
| [44] |
DENG JH, PAN T, LIU ZQ, McCARTHY C, VICENCIO JM, CAO LL, ALFANO G, SUWAIDAN AA, YIN MZ, BEATSON R, NG T. The role of TXNIP in cancer: a fine balance between redox, metabolic, and immunological tumor control[J]. British Journal of Cancer, 2023, 129(12): 1877-1892. DOI:10.1038/s41416-023-02442-4
|
| [45] |
FUKUNAGA K, YOSHIMURA T, IMACHI H, KOBAYASHI T, SAHEKI T, SATO S, SAHEKI N, JIANG WY, MURAO K. A pilot study on the efficacy of a diabetic diet containing the rare sugar D-allulose in patients with type 2 diabetes mellitus: a prospective, randomized, single-blind, crossover study[J]. Nutrients, 2023, 15(12): 2802. DOI:10.3390/nu15122802
|
| [46] |
HOSSAIN MA, IZUISHI K, MAETA H. Protective effects of D-allose against ischemia reperfusion injury of the rat liver[J]. J Hepatobiliary Pancreat Surg, 2003, 10(3): 218-25. DOI:10.1007/s00534-002-0785-8
|
| [47] |
TANAKA S, SAKAMOTO H. Effects of D-allose on the endocytic activity of dendritic cells and the subsequent stimulation of T cells[J]. Cellular Immunology, 2011, 271(1): 141-146. DOI:10.1016/j.cellimm.2011.06.015
|
| [48] |
WU J, LI S, LI TT, LV XP, ZHANG MY, ZANG GX, QI C, LIU YJ, XU L, CHEN JT. pDC activation by TLR7/8 ligand CL097 compared to TLR7 ligand IMQ or TLR9 ligand CpG[J]. Journal of Immunology Research, 2019, 2019: 1749803.
|
| [49] |
CHEN XW, GU XJ, YANG J, JIANG ZF, DENG JJ. Gas chromatography-mass spectrometry technology: application in the study of inflammatory mechanism in COVID-19 patients[J]. Chromatographia, 2023, 86(2): 175-183. DOI:10.1007/s10337-022-04222-3
|
| [50] |
伍维高, 钟金凤. 环磷酰胺构建动物免疫抑制模型的研究进展[J]. 中国兽医杂志, 2019, 55(2): 87-89. WU WG, ZHONG JF. Research progress in constructing animal immunosuppressive model with cyclophosphamide[J]. Chinese Journal of Veterinary Medicine, 2019, 55(2): 87-89 (in Chinese). |
| [51] |
田普训, 敖建华, 李宁, 石炳毅. 器官移植免疫抑制剂临床应用技术规范(2019版)[J]. 器官移植, 2019, 10(3): 213-226. TIAN PX, AO JH, LI N, SHI BY. Technical specification for clinical application of immunosuppressants in organ transplantation (2019 edition)[J]. Organ Transplantation, 2019, 10(3): 213-226 (in Chinese). |
| [52] |
李玲, 郭宏丽, 胡雅慧, 李运曼, 方伟蓉, 赵非, 许静, 陈峰. 他克莫司在儿童肾病综合征群体中的治疗药物监测[J]. 中国药学杂志, 2021, 56(23): 1880-1886. LI L, GUO HL, HU YH, LI YM, FANG WR, ZHAO F, XU J, CHEN F. Therapeutic drug monitoring of tacrolimus in children with nephrotic syndrome[J]. Chinese Pharmaceutical Journal, 2021, 56(23): 1880-1886 (in Chinese). DOI:10.11669/cpj.2021.23.003 |
| [53] |
IIZUKA K. Is the use of artificial sweeteners beneficial for patients with diabetes mellitus? The advantages and disadvantages of artificial sweeteners[J]. Nutrients, 2022, 14(21): 4446. DOI:10.3390/nu14214446
|
| [54] |
SOMJAI C, SIRIWOHARN T, KULPRACHAKARN K, CHAIPOOT S, PHONGPHISUTTHINANT R, WIRIYACHAREE P. Utilization of Maillard reaction in moist-dry-heating system to enhance physicochemical and antioxidative properties of dried whole Longan fruit[J]. Heliyon, 2021, 7(5): e07094. DOI:10.1016/j.heliyon.2021.e07094
|
| [55] |
ZHANG M, FU YH, LUO YW, GOU MR, ZHANG L, FEI Z, GAO DK. D-allose protects brain microvascular endothelial cells from hypoxic/reoxygenated injury by inhibiting endoplasmic reticulum stress[J]. Neuroscience Letters, 2023, 793: 137000. DOI:10.1016/j.neulet.2022.137000
|
 2024, Vol. 40
2024, Vol. 40