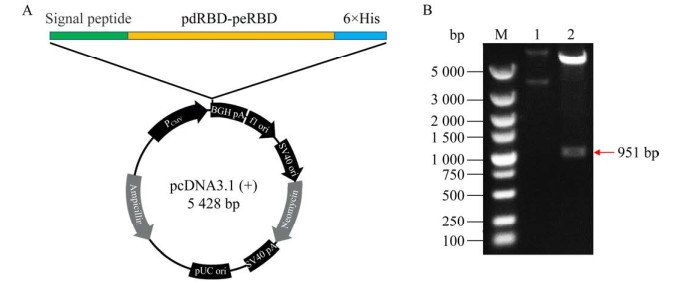
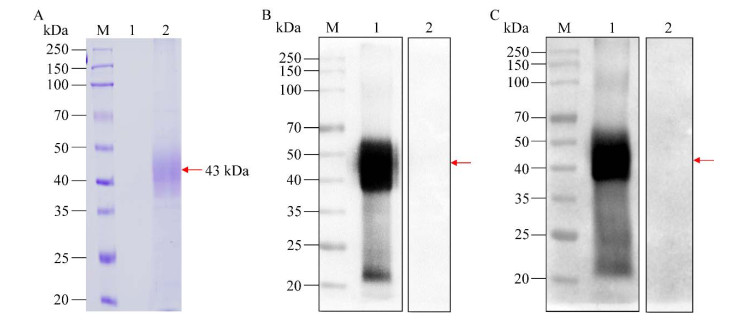
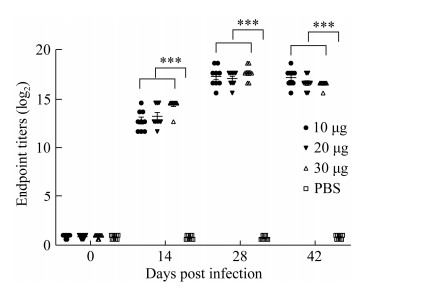
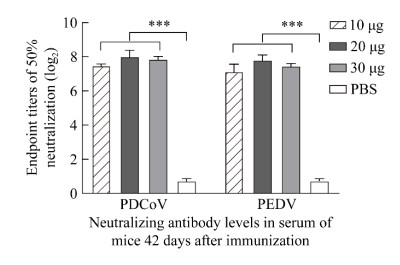
| [1] |
TANG P, CUI EH, SONG YH, YAN RQ, WANG JY. Porcine deltacoronavirus and its prevalence in China: a review of epidemiology, evolution, and vaccine development[J]. Archives of Virology, 2021, 166(11): 2975-2988. DOI:10.1007/s00705-021-05226-4
|
|
| [2] |
SHU XL, HAN FF, HU YT, HAO CL, LI ZY, WEI ZY, ZHANG HL. Co-infection of porcine deltacoronavirus and porcine epidemic diarrhoea virus alters gut microbiota diversity and composition in the colon of piglets[J]. Virus Research, 2022, 322: 198954. DOI:10.1016/j.virusres.2022.198954
|
|
| [3] |
ZHANG HL, HAN FF, SHU XL, LI QQ, DING QW, HAO CL, YAN XG, XU ML, HU H. Co-infection of porcine epidemic diarrhoea virus and porcine deltacoronavirus enhances the disease severity in piglets[J]. Transboundary and Emerging Diseases, 2022, 69(4): 1715-1726. DOI:10.1111/tbed.14144
|
|
| [4] |
WOO PCY, LAU SKP, LAM CSF, LAU CCY, TSANG AKL, LAU JHN, BAI R, TENG JLL, TSANG CCC, WANG M, ZHENG BJ, CHAN KH, YUEN KY. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus[J]. Journal of Virology, 2012, 86(7): 3995-4008. DOI:10.1128/JVI.06540-11
|
|
| [5] |
WANG LY, BYRUM B, ZHANG Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerging Infectious Diseases, 2014, 20(7): 1227-1230.
|
|
| [6] |
DONG N, FANG LR, ZENG SL, SUN QQ, CHEN HC, XIAO SB. Porcine deltacoronavirus in China's mainland[J]. Emerging Infectious Diseases, 2015, 21(12): 2254-2255. DOI:10.3201/eid2112.150283
|
|
| [7] |
HU H, JUNG K, VLASOVA AN, CHEPNGENO J, LU ZY, WANG QH, SAIF LJ. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States[J]. Journal of Clinical Microbiology, 2015, 53(5): 1537-1548. DOI:10.1128/JCM.00031-15
|
|
| [8] |
LEE JH, CHUNG HC, NGUYEN VG, MOON HJ, KIM HK, PARK SJ, LEE CH, LEE GE, PARK BK. Detection and phylogenetic analysis of porcine deltacoronavirus in Korean swine farms, 2015[J]. Transboundary and Emerging Diseases, 2016, 63(3): 248-252. DOI:10.1111/tbed.12490
|
|
| [9] |
AJAYI T, DARA R, MISENER M, PASMA T, MOSER L, POLJAK Z. Herd-level prevalence and incidence of porcine epidemic diarrhoea virus (PEDV) and porcine deltacoronavirus (PDCoV) in swine herds in Ontario, Canada[J]. Transboundary and Emerging Diseases, 2018, 65(5): 1197-1207. DOI:10.1111/tbed.12858
|
|
| [10] |
SONG D, PARK B. Porcine epidemic diarrhoea virus: a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1
|
|
| [11] |
LEE C. Porcine epidemic diarrhea virus: an emerging and re-emerging epizootic swine virus[J]. Virology Journal, 2015, 12: 193. DOI:10.1186/s12985-015-0421-2
|
|
| [12] | |
|
| [13] |
JUNG K, SAIF LJ, WANG QH. Porcine epidemic diarrhea virus (PEDV): an update on etiology, transmission, pathogenesis, and prevention and control[J]. Virus Research, 2020, 286: 198045. DOI:10.1016/j.virusres.2020.198045
|
|
| [14] |
LI ZW, MA ZQ, LI Y, GAO S, XIAO SQ. Porcine epidemic diarrhea virus: molecular mechanisms of attenuation and vaccines[J]. Microbial Pathogenesis, 2020, 149: 104553. DOI:10.1016/j.micpath.2020.104553
|
|
| [15] |
SONG D, ZHOU X, PENG Q, CHEN Y, ZHANG F, HUANG T, ZHANG T, LI A, HUANG D, WU Q, HE H, TANG Y. Newly emerged porcine deltacoronavirus associated with diarrhoea in swine in China: identification, prevalence and full-length genome sequence analysis[J]. Transboundary and Emerging Diseases, 2015, 62(6): 575-580. DOI:10.1111/tbed.12399
|
|
| [16] |
SUN DB, WANG XY, WEI S, CHEN JF, FENG L. Epidemiology and vaccine of porcine epidemic diarrhea virus in China: a mini-review[J]. The Journal of Veterinary Medical Science, 2016, 78(3): 355-363. DOI:10.1292/jvms.15-0446
|
|
| [17] |
LEE S, LEE C. Complete genome characterization of Korean porcine deltacoronavirus strain KOR/KNU14- 04/2014[J]. Genome Announcements, 2014, 2(6): e01191-14.
|
|
| [18] |
BOSCH BJ, van der ZEE R, de HAAN CAM, ROTTIER PJM. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex[J]. Journal of Virology, 2003, 77(16): 8801-8811. DOI:10.1128/JVI.77.16.8801-8811.2003
|
|
| [19] |
MA XC, ZOU F, YU F, LI R, YUAN YC, ZHANG YW, ZHANG XT, DENG JY, CHEN T, SONG Z, QIAO YD, ZHAN YK, LIU J, ZHANG JS, ZHANG X, PENG ZL, LI YZ, LIN YT, LIANG LT, WANG GW, et al. Nanoparticle vaccines based on the receptor binding domain (RBD) and heptad repeat (HR) of SARS-CoV-2 elicit robust protective immune responses[J]. Immunity, 2020, 53(6): 1315-1330.e9. DOI:10.1016/j.immuni.2020.11.015
|
|
| [20] |
CHEN R, FU JY, HU JF, LI C, ZHAO YJ, QU H, WEN XT, CAO SJ, WEN YP, WU R, ZHAO Q, YAN QG, HUANG Y, MA XP, HAN XF, HUANG XB. Identification of the immunodominant neutralizing regions in the spike glycoprotein of porcine deltacoronavirus[J]. Virus Research, 2020, 276: 197834. DOI:10.1016/j.virusres.2019.197834
|
|
| [21] |
LI CH, LI WT, LUCIO de ESESARTE E, GUO HB, van den ELZEN P, AARTS E, van den BORN E, ROTTIER PJM, BOSCH BJ. Cell attachment domains of the porcine epidemic diarrhea virus spike protein are key targets of neutralizing antibodies[J]. Journal of Virology, 2017, 91(12): e00273-17.
|
|
| [22] |
DU LY, KOU ZH, MA CQ, TAO XR, WANG LL, ZHAO GY, CHEN YQ, YU F, TSENG CT K, ZHOU YS, JIANG SB. A truncated receptor-binding domain of MERS-CoV spike protein potently inhibits MERS-CoV infection and induces strong neutralizing antibody responses: implication for developing therapeutics and vaccines[J]. PLoS One, 2013, 8(12): e81587. DOI:10.1371/journal.pone.0081587
|
|
| [23] |
HE YX, ZHOU YS, LIU SW, KOU ZH, LI WH, FARZAN M, JIANG SB. Receptor-binding domain of SARS-CoV spike protein induces highly potent neutralizing antibodies: implication for developing subunit vaccine[J]. Biochemical and Biophysical Research Communications, 2004, 324(2): 773-781. DOI:10.1016/j.bbrc.2004.09.106
|
|
| [24] |
ZHANG HL, LIANG QQ, LI BX, CUI X, WEI XL, DING QW, WANG YB, HU H. Prevalence, phylogenetic and evolutionary analysis of porcine deltacoronavirus in Henan Province, China[J]. Preventive Veterinary Medicine, 2019, 166: 8-15. DOI:10.1016/j.prevetmed.2019.02.017
|
|
| [25] | |
|
| [26] |
LIN CN, CHAN KR, OOI EE, CHIOU MT, HOANG M, HSUEH PR, OOI PT. Animal coronavirus diseases: parallels with COVID-19 in humans[J]. Viruses, 2021, 13(8): 1507. DOI:10.3390/v13081507
|
|
| [27] |
DAI LP, ZHENG TY, XU K, HAN YX, XU LL, HUANG EQ, AN YL, CHENG YJ, LI SH, LIU M, YANG M, LI Y, CHENG HJ, YUAN Y, ZHANG W, KE CW, WONG G, QI JX, QIN C, YAN JH, et al. A universal design of betacoronavirus vaccines against COVID-19, MERS, and SARS[J]. Cell, 2020, 182(3): 722-733.e11. DOI:10.1016/j.cell.2020.06.035
|
|
| [28] | |
|
| [29] |
JIN LR, LI ZP, ZHANG XY, LI JX, ZHU FC. CoronaVac: a review of efficacy, safety, and immunogenicity of the inactivated vaccine against SARS-CoV-2[J]. Human Vaccines & Immunotherapeutics, 2022, 18(6): 2096970.
|
|
| [30] |
LIU C, MENDONÇA L, YANG Y, GAO YZ, SHEN CG, LIU JW, NI T, JU B, LIU CC, TANG X, WEI JL, MA XM, ZHU YN, LIU WL, XU SM, LIU YX, YUAN J, WU J, LIU Z, ZHANG Z, et al. The architecture of inactivated SARS-CoV-2 with postfusion spikes revealed by cryo-EM and cryo-ET[J]. Structure, 2020, 28(11): 1218-1224.e4. DOI:10.1016/j.str.2020.10.001
|
|
| [31] |
FRANCIS MJ. Recent advances in vaccine technologies[J]. Veterinary Clinics of North America: Small Animal Practice, 2018, 48(2): 231-241. DOI:10.1016/j.cvsm.2017.10.002
|
|
| [32] |
TAN M, JIANG X. Recent advancements in combination subunit vaccine development[J]. Human Vaccines & Immunotherapeutics, 2017, 13(1): 180-185.
|
|
| [33] |
LIANG JX, LI Y, YAN ZS, JIAO Z, PENG DP, ZHANG WP. Study of the effect of intestinal immunity in neonatal piglets coinfected with porcine deltacoronavirus and porcine epidemic diarrhea virus[J]. Archives of Virology, 2022, 167(8): 1649-1657. DOI:10.1007/s00705-022-05461-3
|
|
| [34] |
LIU XS, ZHANG LP, ZHANG QL, ZHOU P, FANG YZ, ZHAO DH, FENG JX, LI WY, ZHANG YG, WANG YL. Evaluation and comparison of immunogenicity and cross-protective efficacy of two inactivated cell culture-derived GIIa- and GIIb-genotype porcine epidemic diarrhea virus vaccines in suckling piglets[J]. Veterinary Microbiology, 2019, 230: 278-282. DOI:10.1016/j.vetmic.2019.02.018
|
|
| [35] |
XU K, GAO P, LIU S, LU SY, LEI WW, ZHENG TY, LIU XY, XIE YF, ZHAO ZN, GUO SX, TANG C, YANG Y, YU WH, WANG JB, ZHOU YN, HUANG Q, LIU CY, AN YL, ZHANG R, HAN YX, et al. Protective prototype-beta and delta-omicron chimeric RBD-dimer vaccines against SARS-CoV-2[J]. Cell, 2022, 185(13): 2265-2278.e14. DOI:10.1016/j.cell.2022.04.029
|
|
| [36] |
WANG NX, WANG Z, MA MY, JIA XH, LIU H, QIAN MW, LU SJ, XIANG YQ, WEI ZY, ZHENG LL. Expression of codon-optimized PDCoV-RBD protein in baculovirus expression system and immunogenicity evaluation in mice[J]. International Journal of Biological Macromolecules, 2023, 252: 126113. DOI:10.1016/j.ijbiomac.2023.126113
|
|
| [37] |
LI JZ, ZHAO SQ, ZHANG BT, HUANG J, PENG Q, XIAO L, YUAN XS, GUO RL, ZHOU JZ, FAN BC, XUE T, ZHU XJ, LIU CM, ZHU X, LI B. A novel recombinant S-based subunit vaccine induces protective immunity against porcine deltacoronavirus challenge in piglets[J]. Journal of Virology, 2023, 97(11): e0095823. DOI:10.1128/jvi.00958-23
|
|
| [38] |
伊立超, 郝嘉翼, 邹万成, 李乐天, 姜宇航, 张爽, 娄安钢, 李昌, 金宁一. 猪流行性腹泻病毒纤突蛋白受体结合区(PEDV-RBD)重组蛋白的免疫原性[J]. 中国兽医学报, 2023, 43(4): 643-647. YI LC, HAO JY, ZOU WC, LI LT, JIANG YH, ZHANG S, LOU AG, LI C, JIN NY. Immunogenicity analysis of PEDV-RBD subunit vaccine[J]. Chinese Journal of Veterinary Science, 2023, 43(4): 643-647 (in Chinese).
|
|
 2024, Vol. 40
2024, Vol. 40