尸胺,也被称为1, 5-戊二胺,是一种普遍存在于原核生物和真核生物中的生物胺[1]。它可用于开发多种高附加值产品,并在农业、医学和工业等领域有着广泛的应用[2]。在农业领域中,尸胺参与植物的生长调节、信号传递、抗逆反应和昆虫防御机制[3]。医学领域中,尸胺被用来合成具有生物活性的药物成分[4],具有治疗诸如乳腺癌[5]和痢疾[6]等疾病的潜力。在工业领域,尸胺作为合成高分子材料如聚酰胺和聚氨酯的基本单元,尤其在合成新型尼龙5X等高性能聚合物方面发挥着重要作用[7]。
利用微生物生产尸胺提供了一种环保且可持续的传统石化工艺替代方法。目前,尸胺的生物合成主要通过生物转化和发酵两种方法实现。在生物转化法中,研究者们通常将L-赖氨酸作为底物,赖氨酸脱羧酶(lysine decarboxylase, LDC) (诱导型CadA或组成型LdcC)作为生物催化剂,通过单步酶促反应直接合成尸胺[8]。例如,研究人员通过理性工程改造开发了一种pH稳定的EcCadAV12C/D41C突变体,所构建的M3菌株实现了418 g/L的尸胺生产[9],这是迄今为止报道的生物转化的最高产量。然而,这种方法面临的主要挑战包括生物催化剂稳定性不佳以及催化活性不足[10]。在微生物发酵法中,研究者们通常采用系统代谢工程策略对大肠杆菌(Escherichia coli)或谷氨酸棒杆菌(Corynebacterium glutamicum)进行改造,以实现利用低成本的碳源例如葡萄糖、甘油和纤维素合成尸胺,这些策略包括:关键酶LDC的过表达以及性能的优化[11]、强化前体供应[12]、阻断产物降解[13]、转运体工程[9]和细胞毒性耐受工程[1]等。基于以上策略改造的大肠杆菌E. coli NT1005/CadA-lysA-dapA-cadB通过分批补料发酵可以产生58.7 g/L的尸胺,得率为0.396 g/g,是迄今为止E. coli中报道的最高水平[1]。此外,C. glutamicum在工业上已广泛应用于氨基酸生产,特别是作为L-赖氨酸的高效生产菌株,而L-赖氨酸正是尸胺的直接前体。基于此,该菌株也被视为尸胺生产的理想宿主[8]。例如,通过将蜂房哈夫尼亚菌(Hafnia alvei)的LDC基因整合到高产L-赖氨酸PKC菌株的lysE位点,构建了重组菌株GH30HaLDC,并且该菌株在分批补料发酵条件下实现了高达125.0 g/L的尸胺产量,彰显了其在生物工程领域的巨大应用价值[14]。尽管如此,生物转化法需要外源添加辅酶5ʹ-磷酸吡哆醛(pyridoxal 5′-phosphate, PLP),而发酵法则通常需要使用价格较高的复杂培养基,这两个因素都限制了尸胺的工业化生产。
PLP,作为维生素B6 (vitamin B6, VB6)的活性形式,在关键代谢途径如氨基酸代谢、生物胺合成以及糖酵解中至关重要[15]。近期研究揭示了PLP的胞内浓度直接影响尸胺的生产效率[16]。微生物中合成PLP的路径包括:1-脱氧-D-木酮糖-5-磷酸(deoxyxylulose-5-phosphate, DXP)依赖途径、DXP非依赖途径以及挽救途径。其中,DXP非依赖途径,始于赤藓糖-4-磷酸,主要存在于VB6自养生物中,是自然界主导的PLP合成途径。DXP依赖途径仅存在于少数细菌如E. coli中。挽救途径普遍存在于VB6自养生物中,能够实现VB6不同形态间的相互转换。为了提高PLP依赖性酶的催化效率,研究者们已经开发出数种方法提升细胞内PLP的水平,例如在外源提供吡哆醛(pyridoxal, PL)和再生腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)的条件下,在E. coli中过表达挽救途径酶PdxY合成PLP,使得工程菌株在6 h内完全转化1 mol/L赖氨酸[17];或者在C. glutamicum中共表达DXP非依赖性途径基因pdxS/pdxT,使得胞内PLP含量以及尸胺产量分别提高了2.4倍和2.9倍[18]。
为了实现尸胺的发酵生产,本研究首先在一株产赖氨酸的工程E. coli中引入LDC实现尸胺的合成;其次,通过体外以及体内实验评估了尸胺的生产瓶颈步骤;接着开发了一种双路径协同优化的辅酶合成系统,提高辅酶PLP的供应,进而提高LDC催化赖氨酸合成尸胺的能力;随后在5 L发酵罐中分别从诱导起始时间、pH和接种量这3个方面对发酵工艺进行优化。最终,重组菌株L11在5 L发酵罐中,经48 h分批补料发酵,尸胺产量、得率、生产强度分别为54.43 g/L、0.22 g/g、1.13 g/(L·h)。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物 详细的菌株、质粒及引物信息请参见表 1−3。
表 1 本研究所使用的菌株
Table 1 Strains used in this study
| Strains |
Relevant characteristics |
Sources |
| Escherichia coli JM109 |
Cloning host |
TaKaRa Bio |
| E. coli BL21(DE3) |
Expression host |
Novagen |
| LY-4 |
E. coli CCTCC M2019435 hns: FRT, AGU-arcA |
[19] |
| L01 |
LY-4 carrying pEM-01 |
This study |
| L02 |
LY-4 carrying pEM-02 |
This study |
| L03 |
LY-4 carrying pEM-03 |
This study |
| L04 |
LY-4 carrying pEM-04 |
This study |
| L05 |
LY-4 carrying pEM-05 |
This study |
| L06 |
LY-4 carrying pEM-06 |
This study |
| L07 |
LY-4 carrying pEM-07 |
This study |
| L08 |
LY-4 carrying pEM-08 |
This study |
| L09 |
LY-4 carrying pEM-09 |
This study |
| L10 |
LY-4 carrying pEM-10 |
This study |
| L11 |
LY-4 carrying pEM-11 |
This study |
表 2 本研究所使用的质粒
Table 2 Plasmids used in this study
| Plasmids |
Sequences (5′→3′) |
Sources |
| pEM |
lac operator, lacI, AmpR, Trc promoter |
Laboratory storage |
| pET28a |
F1 ori, KanR, Plac-lacI, PT7-lac operator, 6×His |
Laboratory storage |
| pET28a-AsC |
pMB1 ori, KanR, PT7-AscadA |
This study |
| pET28a-ScL |
pMB1 ori, KanR, PT7-ScldcC |
This study |
| pET28a-KqC |
pMB1 ori, KanR, PT7-Kqcad1A |
This study |
| pET28a-KqL |
pMB1 ori, KanR, PT7-Kqldc1C |
This study |
| pET28a-SmC |
pMB1 ori, KanR, PT7-SmcadA |
This study |
| pET28a-VuL |
pMB1 ori, KanR, PT7-VuldcC |
This study |
| pET28a-GbT |
pMB1 ori, KanR, PT7-GbpdxT |
This study |
| pET28a-MtbT |
pMB1 ori, KanR, PT7-MtbpdxT |
This study |
| pET28a-BsT |
pMB1 ori, KanR, PT7-BspdxT |
This study |
| pET28a-PfT |
pMB1 ori, KanR, PT7-PfpdxT |
This study |
| pET28a-BsS |
pMB1 ori, KanR, PT7-BspdxS |
This study |
| pET28a-GbS |
pMB1 ori, KanR, PT7-GbpdxS |
This study |
| pET28a-MtbS |
pMB1 ori, KanR, PT7-MtbpdxS |
This study |
| pET28a-PfS |
pMB1 ori, KanR, PT7-PfpdxS |
This study |
| pEM-01 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA |
This study |
| pEM-02 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PTac-Epd |
This study |
| pEM-03 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PTac-Dxs |
This study |
| pEM-04 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PTac-PdxH |
This study |
| pEM-05 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PTac-PdxJ |
This study |
| pEM-06 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PTac-PdxA |
This study |
| pEM-07 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PT5-GbPdxS/BsPdxT |
This study |
| pEM-08 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PT5-GbPdxS/MyPdxT |
This study |
| pEM-09 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PT5-BsPdxS/BsPdxT |
This study |
| pEM-10 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PT5-BsPdxS/MyPdxT |
This study |
| pEM-11 |
lac operator, lacI, AmpR, pEM-PT5-AsCadA-PT5-PdxA-PT5-BsPdxS/MyPdxT |
This study |
表 3 本研究所使用的引物
Table 3 Primers used in this study
| Primers |
Sequences (5′→3′) |
| 28a-SmcadA-F |
agcaaatgggtcgcggatccatgaacgttatcgccatcat |
| 28a-SmcadA-R |
tggtggtggtggtgctcgagttatttcgccttcagcactttcac |
| 28a-BsT-F |
actggtggacagcaaatgggtcgcggatccatgttaacaataggtgtactaggact |
| 28a-BsT-R |
tcagtggtggtggtggtggtgctcgagttatacaagtgccttttgcttatatt |
| 28a-BsS-F |
gtggacagcaaatgggtcgcggatccatggctcaaacaggtactgaac |
| 28a-BsS-R |
tcagtggtggtggtggtggtgctcgagttaccagccgcgttcttg |
| tac-pdxJ-F |
tttcacacaggaaacagaattcatggctgaattactgttaggc |
| tac-pdxJ-R |
ctcagccatatgggtggcagcagttagccacgcgcttcc |
| tac-dxs-F |
tcacacaggaaacagaattcatgagttttgatattgccaaataccc |
| tac-dxs-R |
tgctcagcggtaccggtggcagcagttatgccagccaggcctt |
| tac-epd-F |
ttcacacaggaaacagaattcatgaccgtacgcgtagc |
| tac-epd-R |
tcagcggtaccggtggcagcagttacctgaaagcaacagtagcca |
| tac-pdxH-F |
taaaagaagattaactcgagtctggtagatctggatccttgacaattaatcatcggctcgtataatgtgtggaattgtgagcggataacaatttcacacaggaaacagaattcatgtctgataacgacgaattgc |
| tac-pdxH-R |
ctcagccatatgggtggcagcagtcagggtgcaagacgatcaa |
| tac-pdxA-F |
ttcacacaggaaacagaattcatggttaaaacccaacgtg |
| tac-pdxA-R |
tgattaattgtcaaggatcccatatgggtggcagcag |
| pEM-F |
ctgctgccaccggtac |
| pEM-R-2 |
gaattctgtttcctgtgtgaaat |
| pEM-R-1 |
ggatccgtgatggtgatgg |
| pEM-AsC-F |
atcaccatcaccatcacggatccatgaatatttttgctatcctaaaccact |
| pEM-AsC-R |
gatccagatctaccagactcgagttaatcttcttttaatactttcactgtgt |
| pEM-T5-BsPdxS-F |
tgaaagtattaaaagaagattaactcgagtctggtagatctggatcctcataaaaaatttatttgctttgtgagcggataacaattataatatgtggaattgtgagcggataacaatttcacacaggaaacagaattcatggctcaaacaggtactga |
| pEM-BsPdxS-R |
agccatatgggtggcagcagccagccgcgttcttg |
| pEM-BsPdxT-F |
ggtagcggtagcggtagcatgttaacaataggtgtactaggact |
| pEM-BsPdxT-R |
agccatatgggtggcagcagttatacaagtgccttttgcttatattcc |
| pEM-BsPdxS/T-R |
atgctaccgctaccgctaccccagccgcgttcttg |
| pEM-BsPdxS/MyPdxT-F |
ggtagcggtagcggtagcgtgagcgttccacggg |
| pEM-BsPdxS/MyPdxT-R |
agccatatgggtggcagcagtcacgccgcggagg |
| pEM-GbPdxS/MyPdxT-F |
tcacacaggaaacagaattcttagctctaactggaacagatagg |
| pEM-GbPdxS/MyPdxT-R |
gctaccgctaccgctaccttaccaaccacgttcttgca |
| T5-pdxA-F |
aaagtattaaaagaagattaactcgagtctggtagatctggatcctcataaaaaatttatttgctttgtgagcggataacaattataatatgtggaattgtgagcggataacaatttcacacaggaaacagaattcatggttaaaacccaacgtgttg |
| T5-pdxA-R |
caaagcaaataaattttttatgaggatcctcattgggtgttaacaatcattttg |
| pEM-AST-F |
aaaatgattgttaacacccaatgaggatcctcataaaaaatttatttgctttg |
1.1.2 试剂 供本研究所用试剂盒和酶制剂购自生工生物工程(上海)股份有限公司,尸胺(标准品)购自Sigma-Aldrich公司,其他试剂均购自阿拉丁(上海)生化科技股份有限公司。
1.1.3 培养基 LB培养基(g/L):酵母粉5.0,蛋白胨10.0,NaCl 10.0。
斜面培养基(g/L):胰蛋白胨(Oxoid) 10.0,氯化钠10.0,丙酮酸钠0.4,酵母抽提物(Oxoid) 5.0,琼脂粉20.0。
一级种子培养基(g/L):胰蛋白胨(Oxoid) 7.0,蔗糖3.0,酵母抽提物(Oxoid) 5.0,(NH4)2SO4 2.5,K2HPO4 1.0,pH 7.5。
二级种子培养基(g/L):葡萄糖15.00,(NH4)2SO4 14.40,玉米浆蛋白干粉4.50,KH2PO4 1.44,pH 7.5。
发酵培养基(g/L):玉米浆干粉10.00,(NH4)2SO4 10.40,葡萄糖30.00,KH2PO4 2.50,CuSO4 0.02。
发酵罐补料培养基(g/L):葡萄糖900.0,硫酸铵500.0。
1.2 方法
1.2.1 培养条件 种子培养:将菌液以Z字形方式接种于斜面固体培养基,37 ℃恒温培养24 h。培养完成后,用10 mL无菌水轻柔冲洗斜面以收集菌苔,取2.5 mL的菌悬液转移到装有100 mL一级种子培养基的摇瓶中,于37 ℃在复式摇床上以190 r/min的频率培养8 h。接着,将5 mL的一级种子液接种至含有42 mL二级种子培养基的摇瓶中,在相同的条件下继续培养8−9 h。
发酵培养:将活化的种子液以15%−16% (体积比)接种至5 L发酵罐中。发酵条件设定为:温度37 ℃,pH 6.6−6.7,氨氮含量控制在0.05%−0.08%,残糖控制在10 g/L左右。pH值通过纯氨水来调节。发酵起始3 h时,加入0.1 mmol/L异丙基-β-D-硫代半乳糖苷(isopropyl- beta-D-thiogalactopyranoside, IPTG)诱导酶的表达。
1.2.2 酶活以及动力学参数测定 LDC酶活测定方法:反应体系由5 mmol/L L-赖氨酸、0.1 mmol/L PLP、0.1 mol/L Na2HPO4-柠檬酸钠缓冲液(pH 6.0)及20 g/L LDC全细胞湿菌体(或0.5 mg/L纯酶)组成。在37 ℃下反应15 min后,100 ℃沸水浴3 min终止反应。随后,12 000 r/min离心10 min,取上清液,根据1.2.3节中所述高效液相色谱(high performance liquid chromatography, HPLC)方法检测L-赖氨酸和尸胺含量。酶活定义:在37 ℃条件下,每min催化生成1 μmol尸胺所需的酶量为1个酶活力单位(U)。
谷氨酰胺酶(glutaminase, PdxT)酶活测定方法为偶联酶法:通过与谷氨酸脱氢酶的偶联反应测定PdxT活性。反应在37 ℃、50 mmol/L Tris-HCl缓冲液(pH 8.0)中进行,体系中包含0.5 mmol/L 3-乙酰吡啶腺嘌呤二核苷酸(3-acetylpyridine adenine dinucleotide, APAD)、7 U谷氨酸脱氢酶以及10 mmol/L谷氨酰胺。动力学参数的测定中PdxT和PdxS浓度控制在4 μmol/L。使用SpectraMax M3酶标仪(上海)在363 nm处测定吸光度。
PLP合酶(PLP synthase, PdxS)酶活测定方法:通过紫外-可见分光光度法监测PdxS在50 mmol/L Tris-HCl缓冲液(pH 8.0)中的活性来测定,反应温度为37 ℃,反应体系包含40 μmol/L PdxS和0.5 mmol/L底物核糖-5-磷酸(ribose 5-phosphate, R5P)及1 mmol/L DL-甘油醛3-磷酸(DL-glyceraldehyde 3-phosphate, G3P),并加入10 mmol/L硫酸铵作为氮源。动力学参数的测定中PdxS浓度控制在4 μmol/L。使用SpectraMax M3酶标仪在414 nm处测定吸光度[20]。
1.2.3 HPLC检测方法 L-赖氨酸和尸胺测定方法:首先采用乙氧基亚甲基丙二酸二乙酯(diethyl ethoxymethylene malonate, DEEMM)对样品进行衍生处理[21]。衍生化后,12 000 r/min离心5 min,并用0.22 μm滤膜过滤。利用配备安捷伦SB-C18色谱柱的HPLC-20A (岛津公司)进行分析。色谱柱温度控制在35 ℃,流动相由纯乙腈(A)和25 mmol/L乙酸钠溶液(pH 4.8) (B)构成,流速设置为1.0 mL/min。梯度洗脱程序设置为:0−2 min,20%−25% A;2−20 min,25%−60% A;20−25 min,60%−20% A。
胞内外PLP测定方法:细胞浓度调整至生物量(OD600)为20后,重悬于0.9% NaCl溶液中至终体积为1.5 mL,并采用超声破碎法进行细胞破碎。随后加入10% (体积分数)的100%三氯乙酸进行蛋白沉淀,样品在冰上孵育15 min后,12 ℃、12 000 r/min离心10 min。使用安捷伦SB-C18色谱柱进行HPLC分析。流动相为0.1 mol/L KH₂PO₄ (pH 6.6),洗脱时间为0−15 min,流速为1.0 mL/min。色谱柱温度维持在35 ℃[22]。
2 结果与分析
2.1 尸胺生物合成路径的构建与评估 在尸胺的合成中,L-赖氨酸的脱羧反应是最后一步。因此,选择适当的LDC至关重要。以酶活和Km、kcat等酶动力学参数为指标,确定来源于克雷伯氏菌(KqLdc1C、KqCad1A)[23]、天蓝色链霉菌(ScLdcC)[14]、粘质沙雷氏菌(SmCadA)[24]、创伤弧菌(VuLdcC)[24]、鲑鱼弧菌(AsCadA)[25]等6种候选LDCs。然后,将上述酶进行异源表达和纯化,以酶活、转化率为指标进行体外测评,结果如表 4所示,AsCadA具有最高的比酶活(637.46 U/mg),摩尔转化率达到93.58%,因此作为最优LDC进行后续研究。
表 4 不同生物来源的LDCs酶活参数
Table 4 Parameters of LDCs from different microorganisms
| Enzyme |
Specific activity (U/mg) |
Conversion rate (%) |
| AsCadA |
637.46±1.47 |
93.58±0.47 |
| ScLdcC |
71.43±0.36 |
10.49±0.84 |
| KqCad1A |
588.82±2.94 |
86.44±6.92 |
| KqLdc1C |
14.28±0.07 |
2.10±0.17 |
| SmCadA |
485.10±1.90 |
71.20±0.21 |
| VuLdcC |
6.10±0.03 |
0.90±0.04 |
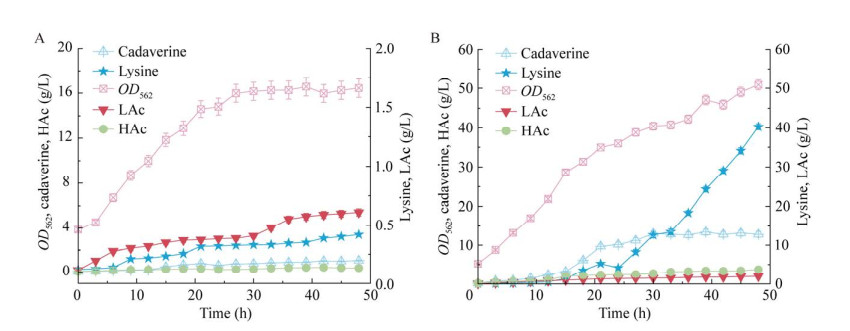
为了在体内构建尸胺的合成路径,考虑到赖氨酸是尸胺合成的直接前体,所以选择本研究室保藏的赖氨酸生产菌株LY-4为底盘菌株,将AscadA基因以质粒pEM-PT5-AscadA的形式导入菌株LY-4,获得重组菌株L01。为了验证尸胺合成路径的可行性,通过摇瓶发酵的初步实验表明,菌株L01在48 h的发酵后,其尸胺产量、生产强度和得率分别为1.07 g/L、0.02 g/(L·h)和0.03 g/g (图 1A)。随后,为了测试重组菌株L01的工业化应用潜力,在5 L发酵罐中进行了放大实验,通过补料分批发酵48 h,菌株L01的尸胺产量、生产强度以及得率分别提高到13.39 g/L、0.28 g/(L·h)和0.08 g/g (图 1B)。综上所述,重组菌株L01可以利用葡萄糖为底物直接合成尸胺。
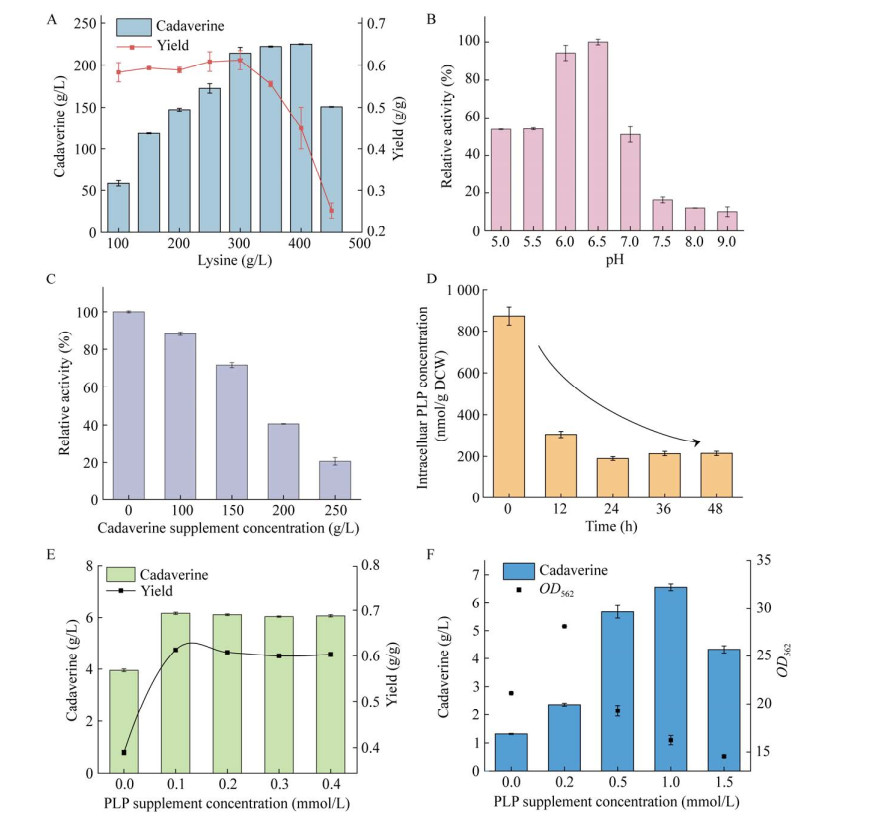
2.2 尸胺合成路径限速瓶颈的鉴定 图 1B的结果显示,菌株L01虽然能够利用葡萄糖生产尸胺,但同时在发酵终点积累了40.23 g/L的前体L-赖氨酸。针对前体大量积累的问题,通过文献分析得出两个可能的原因:(1) 酶活性低;(2) 辅酶(PLP)供应不足。在发酵过程中对AsCadA的评估显示,酶活性并未受到极端条件的影响,如L-赖氨酸的前体抑制超过400 g/L、极端的pH值以及尸胺的产物抑制超过100 g/L (图 2A−2C)。然而,如图 2D所示,在发酵12 h后,胞内PLP含量急剧下降至0 h的35.03%,并在发酵结束时持续下降至24.62%,这表明PLP的持续短缺是限制尸胺生产的一个因素。
为了验证这一假设,进行了体外和体内两部分实验。首先,以L-赖氨酸为底物,在体外纯酶反应条件下,添加不同浓度的PLP (0−0.4 mmol/L),结果如图 2E所示,添加0.1 mmol/L PLP相较于对照组(0 mmol/L) AsCadA的活性提高了1.56倍;其次,在摇瓶发酵中研究了一次性补加PLP对菌株L01合成尸胺的影响,结果如图 2F所示,额外添加PLP的实验组在合成尸胺方面均优于不添加PLP的对照组,当PLP添加量为1.0 mmol/L时,其尸胺产量、生产强度和产率达到最大,分别为6.56 g/L、0.14 g/(L·h)和0.22 g/g,相较于对照组分别提高了513.08%、513.08%和647.06%;值得注意的是,随着PLP添加量从0 mmol/L增加至0.2 mmol/L再增加至1.5 mmol/L,菌体生长最大OD562先提高33.1%随后降低31.09% (图 2F),这说明适量供应PLP有利于尸胺的生产和菌体生长,但是过量PLP对细胞存在明显的毒害作用。综上所述,胞内PLP的短缺是限制尸胺高效生产的关键,并且PLP需要适量供应。
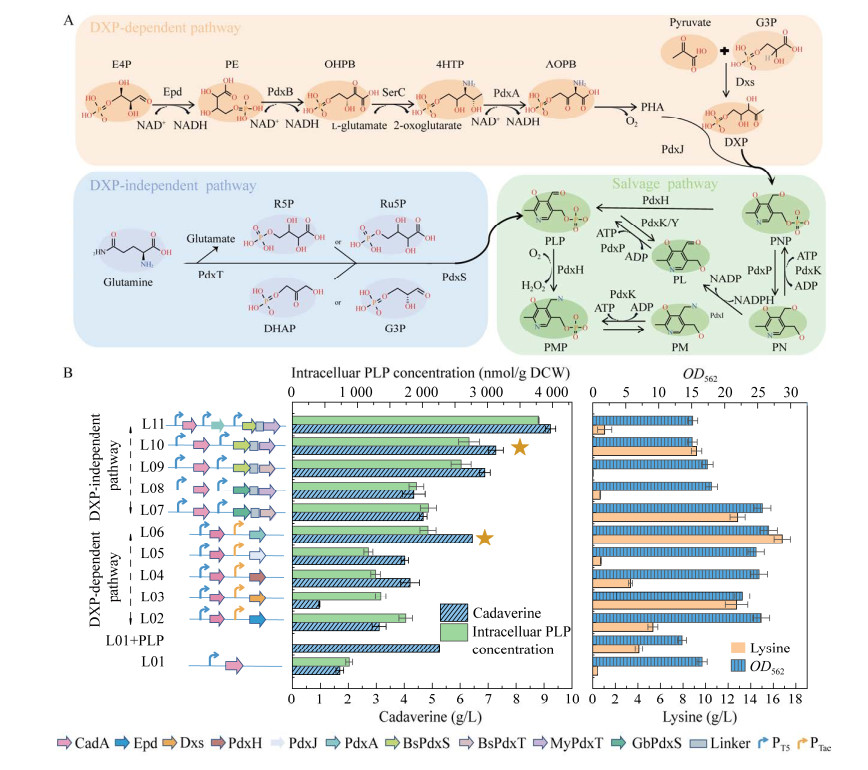
2.3 辅酶PLP供给模块的构建与评估 微生物中存在3种合成PLP的天然路径(图 3A),包括两条从头合成途径:DXP依赖性途径(DXP-dependent pathway)和DXP非依赖性途径(DXP-independent pathway),以及一条挽救途径(salvage pathway)。这两条从头合成途径作为细胞内PLP合成的主要来源,避免了对昂贵外源底物的需求,并且考虑到DXP非依赖性途径不需要还原力或ATP,具有更短的合成路径。基于此,菌株L01实施了双途径策略,即同时加强内源DXP依赖性途径和引入外源DXP非依赖性途径。
在DXP依赖途径中,根据文献[26-27],以酶活为指标,初步筛选出DXP依赖途径中5个潜在限速酶:Epd、Dxs、PdxH、PdxJ和PdxA。将上述酶分别在菌株LY-4中过表达,获得菌株L02−L06。经摇瓶发酵48 h,结果如图 3B所示,最优菌株L06胞内PLP含量达到2 085.36 nmol/g细胞干重(dry cell weight, DCW),比对照菌株L01提高了138.67%,尸胺产量、得率和最大OD562分别为6.44 g/L、0.22 g/g和26.66,较对照菌株L01分别提高6.02倍、6.47倍和1.64倍。以上结果表明,PdxA是DXP依赖途径中的限速酶,增加PLP的胞内供应有利于代谢流流入尸胺的生产,并促进菌体的生长。
DXP非依赖性途径包括两个步骤:(1) 由谷氨酰胺酶亚基(PdxT)将谷氨酰胺转化为谷氨酸和铵;(2) 由PdxS将氨与核酮糖-5-磷酸(ribulose 5-phosphate, Ru5P)或R5P以及G3P或磷酸二羟丙酮转化为PLP。为了确定DXP非依赖性途径中最佳的酶,通过搜索UniProtKB和BRANDA数据库,以酶活为指标,初步筛选出4个PdxT和4个PdxS候选酶。首先,将上述酶基因分别在E. coli BL21(DE3)菌株中过表达,并进行分离纯化,通过体外纯酶反应,以比酶活和酶动力学参数为依据进行复筛,其中来自枯草芽孢杆菌(Bacillus subtilis)和结核分枝杆菌(Mycobacterium tuberculosis)的PdxT最优,比酶活分别为63.68 U/mg和65.06 U/mg (表 5);来自B. subtilis和地热芽孢杆菌(Geobacillus)的PdxS最优,比酶活分别为978.82 U/mg和971.46 U/mg (表 6),因此将上述PdxT和PdxS作为构建完整DXP非依赖性途径的候选酶。
表 5 不同生物来源的PdxT的动力学参数
Table 5 Kinetic parameters of PdxT from different microorganisms
| Microorganisms |
Specific activity (U/mg) |
Km (mmol/L) |
kcat (s−1) |
kcat/Km (L/(mmol·s)) |
| Bacillus subtilis |
63.68 |
5.60 |
0.110 |
0.019 |
| Geobacillus |
32.09 |
1.84 |
0.034 |
0.019 |
| Mycobacterium tuberculosis |
65.06 |
9.68 |
0.160 |
0.016 |
| Plasmodium falciparum |
8.42 |
1.31 |
0.022 |
0.017 |
表 6 不同生物来源的PdxS的动力学参数
Table 6 Kinetic parameters of PdxS from different microorganisms
| Microorganisms |
Specific activity (U/mg) |
DL-glyceraldehyde 3-phosphate |
| Km (mmol/L) |
kcat (s−1) |
kcat/Km (L/(mmol·s)) |
| Bacillus subtilis |
978.83 |
0.38 |
2.60 |
6.84 |
| Geobacillus |
971.46 |
0.28 |
0.36 |
1.29 |
| Mycobacterium tuberculosis |
161.47 |
0.29 |
0.41 |
1.41 |
| Plasmodium falciparum |
276.68 |
0.33 |
0.77 |
2.33 |
将筛选得到的异源合成模块两步候选酶在pEM-PT5-AsCadA质粒上进行组合表达,构建得到4种组合质粒,导入菌株LY-4中获得菌株L07-L10。通过摇瓶发酵48 h,最优组合菌株L10的胞内PLP含量最高,达到2716.94 nmol/g DCW,相较于对照组菌株L01增加了3.09倍,其尸胺产量、生产强度和得率分别达到7.27 g/L、0.15 g/(L·h)和0.16 g/g,较对照菌株L01分别提高6.79倍、6.79倍和4.71倍(图 3B)。综上所述,BspdxS/MypdxT的组合表达模块是PLP异源合成最优模块。
以上结果表明尸胺产量随着PLP的增加而增加,所以本研究尝试将PLP的本源与异源供应路径以及AsCadA,同时在质粒pEM上进行组合表达,构建菌株L11 (图 3B)。通过摇瓶发酵48 h,菌株L11胞内的PLP含量、尸胺产量以及产率分别达到3 786.52 nmol/g DCW、9.23 g/L和0.21 g/g,相较于对照菌株L01分别增加了4.33倍、8.63倍和6.18倍(图 3B)。为评估菌株的鲁棒性菌株L11在5 L发酵罐中通过分批补料发酵48 h,尸胺的产量达到36.32 g/L,生产强度分别为0.76 g/(L·h),产率为0.14 g/g。
2.4 尸胺的发酵工艺优化 为探究工程菌株L11在5 L发酵罐水平生产尸胺的最优条件,本研究分别从诱导时间、pH和初始接种量3个方面对发酵工艺进行优化,以提高尸胺产量。
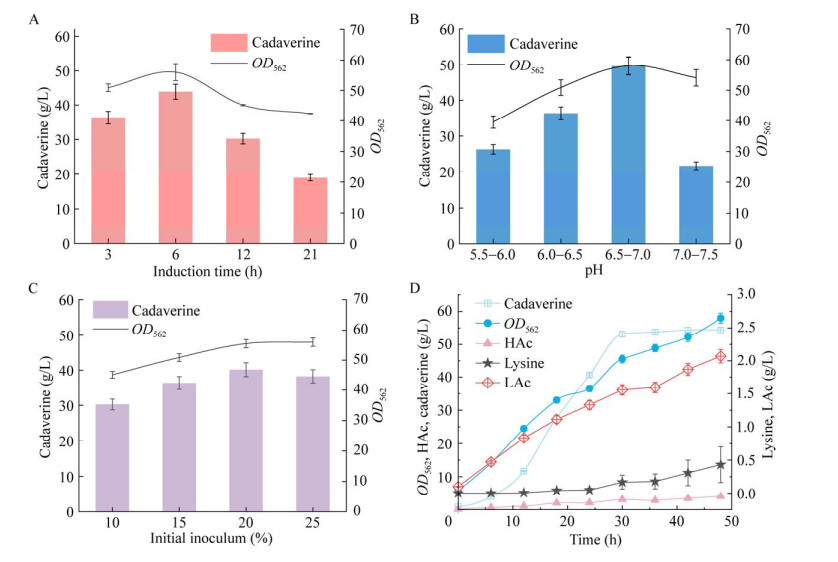
首先,研究了不同诱导时间(3、6、12、21 h)对尸胺发酵生产的影响。如图 4A所示,在细胞生长方面,随着诱导时间增加,细胞最大OD562呈现出先增加后下降的趋势,分别为50.88、56.01、45.14和42.34;在尸胺合成方面,当诱导时间为6 h时,尸胺的产量最高,达到43.90 g/L。
其次,研究了不同pH区间(5.5−6.0、6.0−6.5、6.5−7.0、7.0−7.5)对尸胺生产的影响。如图 4B所示,在细胞生长方面,随着pH的升高,细胞最大OD562先增加后下降,分别为39.5、50.88、58.1和54.1;在尸胺合成方面,当pH在6.5−7.0范围内时,尸胺产量达到49.67 g/L,相比于优化前提高了36.76%。然而,当pH高于7.0时,尸胺的产量下降至21.69 g/L,较优化前降低了40.28%。
另外,还研究了不同初始接种量[10%、15%、20%、25% (体积分数)]对尸胺生产的影响。如图 4C所示,在细胞生长方面,随着接种量的提高,细胞最大OD562逐渐增加,分别为45.10、50.88、55.5和56.01;在尸胺合成方面,当初始接种量为20%时,尸胺产量最高,达到40.12 g/L,相比于优化前提高10.46%。然而,当接种量继续提高至25%时,尸胺的产量下降至38.20 g/L。
综上所述,最佳的尸胺发酵工艺条件为:诱导时间6 h、pH 6.5−7.0、初始接种量20%。最后,基于以上最优发酵条件,重组菌株L11在5 L发酵罐中分批补料发酵48 h,尸胺的产量、得率和最大OD562分别达到54.43 g/L、0.22 g/g和58.0,比未优化前分别提高了1.50倍、1.57倍和1.14倍(图 4D)。
3 讨论与结论 本研究首先将新筛选到的LDC引入实验室前期开发的赖氨酸生产工程E. coli中,实现了尸胺的从头合成。随后,通过一系列体外及体内实验,确定了尸胺生产的限制因素为辅酶PLP持续短缺。在此基础上,开发了一种双途径策略,以增强PLP的胞内供应,得到重组菌株L11。进一步地,在5 L发酵罐中,从诱导起始时间、pH值和接种量3个方面对发酵工艺进行了优化。最终,通过48 h的分批补料发酵,菌株L11在5 L发酵罐中尸胺产量、得率和生产强度分别达到54.43 g/L、0.22 g/g和1.13 g/(L·h)。尽管目前报道的E. coli发酵法合成尸胺的最高产量为58.70 g/L[1],但其生产强度仅为本研究的79.65%。在工业化生产领域,生产强度是衡量发酵系统单位时间产出效率的重要指标。因此,实现较高的生产强度对于工业化规模的生产至关重要。
通过组合不同PLP合成途径,可以有效强化PLP生物合成效率。PLP的充足供应对于尸胺的合成是至关重要的[28]。但是外源补充PLP会导致生产成本较高,利用生物合成的方式更具经济性。目前,共开发出4种利用微生物合成PLP的方法:(1) 引入挽救途径。例如,通过过表达挽救途径的关键酶pdxY,使得5-氨基乙酰丙酸产量提高了4.33倍[29]。(2) 强化和/或引入单个或多个从头合成途径,包括DXP依赖性途径和DXP非依赖性途径[27]。(3) 开发新路径。例如通过实验室进化和酶的混杂性,挖掘出一条截短非天然DXP依赖途径[30]。(4) 多维度强化路径。例如通过增加前体供应/增强NADH再生,进而促进PLP合成[31]。本研究对PLP生物合成的DXP依赖和DXP非依赖途径进行了工程化改造。采用协同强化DXP依赖途径以及引入DXP非依赖途径的双途径策略,成功将细胞内PLP浓度提高了4.33倍。最终,最优生产菌株L11在摇瓶水平的尸胺产量达到9.23 g/L,较优化前提高8.63倍。其中,DXP非依赖途径中的BspdxS/MypdxT组合,结合了来自不同生物的pdxS和pdxT,相较于BspdxS/BspdxT这样的原生组合,尸胺生产效率更高,为解决尸胺合成中辅酶短缺的问题提供了新的思路。
尽管取得了一些进展,但是目前工程菌株的尸胺生产指标与行业领先菌株及工业生产标准相比,仍存在显著差异,导致这一结果可能的原因有4个:(1) PLP可用性。PLP作为LDC的辅酶,其浓度不足或过量都可能影响酶活性,甚至影响细胞生长,进而成为影响尸胺生产的瓶颈。(2) 菌株上游路径的改造。已报道最高产量的工程菌株对上游路径进行了改造,进一步强化了前体供应,减少了碳代谢流的损失。目前重组菌株L11并未对上游路径进行改造,可能导致尸胺生产效率受限。(3) 尸胺胞外转运效率低。已报道的工程菌株过表达了赖氨酸-尸胺逆转运蛋白CadB,以促进赖氨酸的胞内运输以及尸胺的胞外转运。(4) 尸胺耐受性低。已报道最高产量的工程菌株采用尸胺耐受菌株E. coli NT1005为底盘菌株,与之相比,本研究采用的E. coli LY-4仅作为赖氨酸的生产菌,未进行耐受实验,致使尸胺合成路径与底盘菌株的适配性降低。
为了进一步提高重组菌株L11的尸胺的产量,在后续的研究中可以从以下4个方面进行探索:(1) 提高PLP的合成。可以进一步运用优化表达系统、调控代谢流分布、蛋白质改造等策略,增加PLP的合成效率。(2) 强化尸胺的合成路径。为了进一步提高路径的合成效率,通过强化路径中关键酶表达可使尸胺的产量得以提高。(3) 强化尸胺的外运能力。通过转录组学分析技术可以筛选出新的尸胺的外运蛋白,将有助于提高尸胺的产量。(4) 提高底盘耐受性。耐受性强的底盘可以更好地抵抗环境压力,从而提高生产过程的效率和产物的产量,可以通过适应性进化、代谢工程、细胞膜工程等策略开发耐受菌株,从而改善工厂菌株的尸胺生产性能。
 2024, Vol. 40
2024, Vol. 40