乙醇酸高产菌株的筛选及发酵
鲍青青
,
杨光
,
陈菲菲
,
李国辉
,
邓禹
生物工程学报  2024, Vol. 40 2024, Vol. 40 Issue (8): 2418-2431 Issue (8): 2418-2431 |

乙醇酸,又称果酸、羟基乙酸,是一种最简单的α-羟基酸,广泛应用于化妆品[1]、纺织品[2]、清洁剂及材料包装[3]等各个领域,是一种重要的有机合成中间体和化学品。预计到2028年,全球乙醇酸市场消费量将达16万t,截至2022年,国内70%乙醇酸水溶液的价格为20 000元/t,晶体级的乙醇酸则价格更高[4]。目前工业上主要是通过氯乙酸水解[5]或草酸二甲酯水解加氢[6]生产乙醇酸,这些方法在生产过程中需要高温高压,危险性较强,同时还存在废气污染、资源不可再生等问题。
近年来,微生物法生产乙醇酸受到了广泛关注,其合成方式主要包括微生物发酵和全细胞催化两种。已有多种微生物被用于发酵法产乙醇酸,包括乳酸克鲁维酵母[7]、莱茵衣藻[8]、大肠杆菌及谷氨酸棒杆菌[9]等。在这些微生物中,大肠杆菌因其易于遗传改造、繁殖快的优点成为生产乙醇酸的主要研究对象。Yu等[10]在大肠杆菌中构建了以乙酸和葡萄糖为双碳源生产乙醇酸的通路,最终工程菌株NZ-Gly303的乙醇酸产量达73.3 g/L,这是目前报道的大肠杆菌最高产量。然而,大肠杆菌的遗传稳定性较差,菌体破碎及菌种衰退成为发酵过程中的主要问题。相较于微生物发酵,全细胞催化具有转化率高、工艺简单、生产速率快的优点[11]。目前,乙醇酸的全细胞催化大多以乙二醇为底物,经过氧化还原将一侧羟基氧化为羧基生成乙醇酸(图 1),大肠杆菌、酵母菌[12-13]、氧化葡萄糖酸杆菌都可催化乙二醇合成乙醇酸。Pandit等[14]在大肠杆菌中表达了丙二醇氧化还原酶突变体fucO (I7L, L8V)及乙醇醛脱氢酶aldA,成功构建了以乙二醇为底物的乙醇酸合成途径,基于通量平衡分析模型优化了乙醇酸的发酵条件,经两阶段培养发酵后乙醇酸产量达10.4 g/L。Zhang等[15]通过在氧化葡萄糖酸杆菌(Gluconobacter oxydans)中过表达膜结合型乙醇脱氢酶,有效提高了菌体的氧气摄入率及耐酸性,经补料分批发酵后工程菌株adhABS积累了113.8 g/L乙醇酸。值得注意的是,目前市售的葡萄糖和乙二醇价格约为4 000元/t,山梨醇价格约为7 000元/t,该菌株虽然在全细胞催化生产乙醇酸时表现出极强的生产能力,但其培养过程需要添加价格相对昂贵的山梨醇作为碳源,大大提高了培养基的成本,不利于工业化生产。综上所述,寻求一株可以利用廉价碳源且遗传稳定的催化乙二醇生产乙醇酸的菌株显得尤为重要。
|
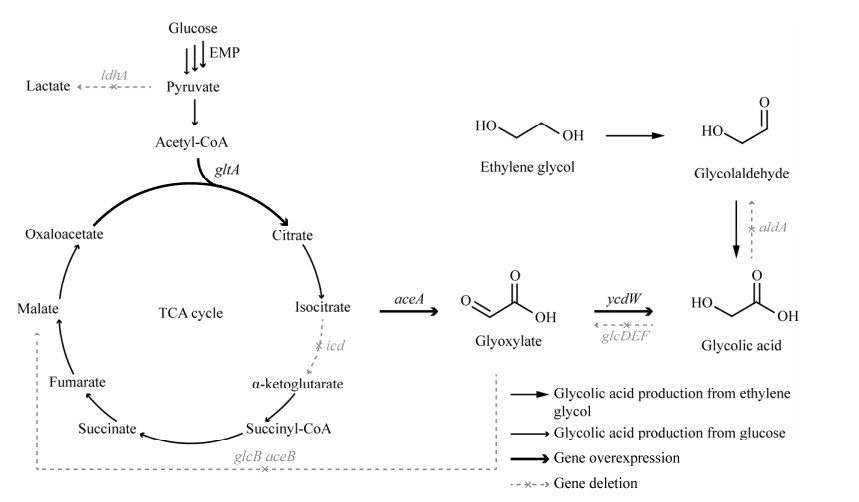
| 图 1 乙醇酸合成途径 Fig. 1 Synthetic pathway of glycolic acid. EMP: Glycolysis pathway; gltA: Citrate synthase; aceA: Isocitrate lyase; ycdW: Glyoxylate reductase; aldA: Aldehyde dehydrogenase; glcDEF: Glycolate oxidase; icd: Isocitrate dehydrogenase; glcB, aceB: Malate synthases; ldhA: D-lactate dehydrogenase. EMP:糖酵解途径;gltA:柠檬酸合酶;aceA:异柠檬酸裂合酶;ycdW:乙醛酸还原酶;aldA:醛脱氢酶;glcDEF:乙醇酸氧化酶;icd:异柠檬酸脱氢酶;glcB、aceB:苹果酸合酶;ldhA:D-乳酸脱氢酶 |
| |
本实验室前期已在大肠杆菌中成功构建了从葡萄糖到乙醇酸的代谢通路(图 1)[16],为便于筛选高产菌株,乙醇酸生物传感器被应用于高通量筛选并取得一定成效[17]。基于此,本研究首先对实验室已有菌株进行筛选,获得了一株可以催化乙二醇产乙醇酸的红酵母。然后通过紫外诱变对菌株进行随机突变,经高通量筛选获得了正突变菌株RMGly-20,发酵优化后该菌株乙醇酸产量得到了进一步提高,为乙醇酸生产菌株的筛选及改造提供了有益借鉴,也为其工业化生产奠定了基础。
1 材料与方法 1.1 实验材料 1.1.1 菌株本研究所用的菌株见表 1。
| Strains | Properties | Sources |
| Rhodotorula sp. | Wild type, for glycolic acid production and UV mutagenesis (CICIM Y7142) | Lab preserved |
| Gluconobacter oxydans | Wild type, for glycolic acid production (CGMCC 1.565) | Lab preserved |
| Gluconobacter thailandicus | Wild type, for glycolic acid production (CGMCC 1.637) | Lab preserved |
| MglyC-GP6 | MG1655(DE3) ΔglcC carrying pGBS-Pffs-sfgfp, for high-throughput screening of glycolic acid producing strains | [18] |
| RMGly-20 | Rhodotorula sp. UV mutagenic strain, for glycolic acid production (CICIM Y7143) | This study |
LB培养基(g/L):NaCl 10,胰蛋白胨10,酵母粉5,用于大肠杆菌的培养及发酵。
YPD培养基(g/L):葡萄糖20,胰蛋白胨20,酵母粉10,用于酵母菌的培养及发酵。
山梨醇培养基(g/L):山梨醇73,酵母粉18.4,(NH4)2SO4 1.5,KH2PO4 1.52,MgSO4 0.47,用于葡萄糖酸杆菌的培养及发酵。
M9培养基(g/L):Na2HPO4 6.78,KH2PO4 3,NH4Cl 1,NaCl 0.5,MgSO4 0.24,CaCl2 0.011 5,灭菌后加入终浓度为8 g/L的葡萄糖,用于筛选乙醇酸高产菌株。
如需制备上述培养基的固体培养基,则向液体培养基中加入2%的琼脂。
1.2 菌株活化及筛选菌株活化:将保存于–80 ℃的菌种取出,于对应的固体平板上划线,大肠杆菌置于37 ℃,酵母菌和葡萄糖酸杆菌置于30 ℃恒温培养至长出单菌落。
菌株筛选:挑取活化好的单菌落接种于对应的液体培养基中,大肠杆菌置于37 ℃,酵母菌和葡萄糖酸杆菌置于30 ℃、250 r/min的摇床中培养48 h后加入20 g/L乙二醇继续培养,每隔24 h取样冻存于–20 ℃,最后通过高效液相色谱(high performance liquid chromatography, HPLC)检测乙醇酸的产量。
1.3 紫外诱变选育乙醇酸高产菌株 1.3.1 紫外诱变将红酵母在30 ℃下培养至OD600为0.6的菌悬液用于紫外诱变。取10 μL菌悬液涂布于金属载片,将载片置于无菌培养皿中,于暗室利用紫外灯照射金属载片进行诱变,分别照射不同时间(30–300 s),以未照射紫外的菌悬液作为对照。待诱变结束后将载片移至990 μL无菌生理盐水中,振荡10 min后稀释涂布于YPD平板,30 ℃培养48 h测定菌落数,计算紫外诱变致死率,公式如下:

|
利用M9培养基将MglyC-GP6菌株于37 ℃、250 r/min的摇床培养至OD600为0.6–0.8,随后以200 μL/孔的装液量将其分装至96孔板备用。向孔板中分别加入20 μL乙二醇溶液使其终浓度为0、2、4、6、8、10 g/L,20 μL乙醇酸溶液使其终浓度达到0、2、4、6、8、10、12、14、16、18、20 g/L,20 μL含有终浓度为10 g/L乙二醇的乙醇酸溶液使孔板中乙醇酸的终浓度分别为0、2、4、6、8、10、12、14、16、18、20 g/L以诱导荧光蛋白表达(注:所有乙二醇及乙醇酸溶液均采用YPD培养基配制而成),随后将孔板转移至30 ℃、250 r/min的摇床培养,每隔2 h取样用酶标仪测定荧光及OD600。
1.3.3 高通量筛选红酵母诱变菌株孔板发酵:利用48孔板对诱变后的菌株进行发酵初筛。挑取平板上诱变后的红酵母单菌落接种于含有1 mL YPD培养基的48孔板中,30 ℃、250 r/min培养48 h后加入20 μL乙二醇,继续发酵48 h。
菌种初筛:利用MglyC-GP6菌株筛选乙醇酸高产菌株。首先,按1.3.2的方法将MglyC-GP6菌株培养至OD600为0.6–0.8,随后以200 μL/孔的装液量将其分装至96孔板;然后,将48孔板发酵的菌液4 000 r/min离心5 min,取20 μL上清液加入96孔板中诱导荧光蛋白表达;最后,将96孔板在30 ℃、250 r/min培养8 h测定孔板中混合液的荧光及OD600。
摇瓶复筛:利用250 mL摇瓶进行菌种复筛,将初筛获得的菌株接种于50 mL YPD培养基中,30 ℃、250 r/min培养48 h,4 000 r/min离心10 min后用磷酸盐缓冲液重悬菌体,加入1 mL乙二醇,继续发酵72 h后对发酵液进行HPLC检测,筛选乙醇酸高产菌株。
1.4 乙醇酸高产菌株发酵优化及乙醇酸耐受性评估 1.4.1 温度优化将乙醇酸高产菌株的单菌落接种于含有50 mL YPD培养基的250 mL摇瓶中,在不同温度下(25、28、30、33、37 ℃),250 r/min培养48 h后按1.3.3摇瓶复筛的方式继续发酵72 h,每隔24 h取样冻存于–20 ℃,最后通过HPLC检测乙醇酸的产量。
1.4.2 装液量优化将乙醇酸高产菌株的单菌落接种于含有不同体积YPD培养基(10、25、50、75、100 mL)的250 mL摇瓶中,28 ℃、250 r/min培养48 h后按1.3.3摇瓶复筛的方式继续发酵72 h,每隔24 h取样冻存于–20 ℃,最后通过HPLC检测乙醇酸的产量。
1.4.3 乙醇酸耐受性评估将乙醇酸高产菌株的单菌落接种于含有50 mL YPD培养基的250 mL摇瓶中,30 ℃、250 r/min培养48 h制备种子液,向种子液中分别加入终浓度为10、20、30、40、50、60、70、80 g/L的乙醇酸溶液,以未添加乙醇酸的种子液作为对照,每隔24 h取样测定菌液的OD600,绘制生长曲线。
1.5 5 L发酵罐培养生产乙醇酸将乙醇酸高产菌株单菌落接种于100 mL YPD培养基中,28 ℃、250 r/min培养48 h制备种子液,随后将种子液接种于含有2.5 L YPD培养基的5 L发酵罐中进行培养。培养期间控制通气量为1 vvm,温度为28 ℃,转速为400 r/min,培养16 h后以1 g/(L·h)的速度流加葡萄糖,继续培养32 h后离心弃上清,用磷酸盐缓冲液重悬菌体,加入20 g/L乙二醇进行发酵。发酵期间控制罐内乙二醇残留浓度在10–13 g/L,通过NH3·H2O调节pH为5.5左右。
1.6 检测方法 1.6.1 高效液相色谱检测乙二醇及乙醇酸将发酵液用水稀释10倍后离心过0.22 μm水系滤膜,用于HPLC检测,检测条件同参考文献[19],紫外检测器用于检测乙醇酸,示差检测器用于检测乙二醇。
1.6.2 多功能酶标仪检测荧光及OD600取50 μL培养的菌液,将其转移至底部透明的黑色96孔板中,加水稀释至适当倍数进行荧光检测,激发波长为485 nm,发射波长为528 nm[20],同时测定600 nm处的吸光值。
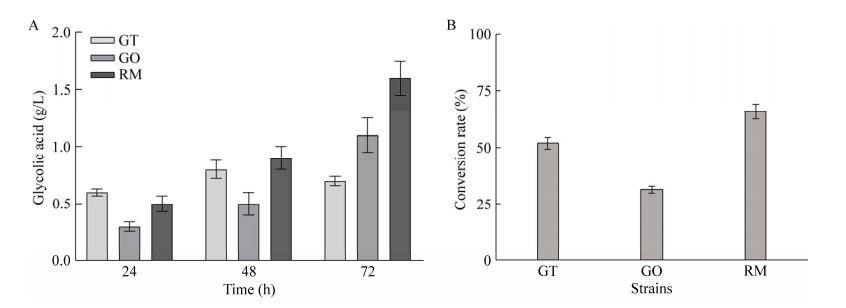
2 结果与分析 2.1 乙醇酸生产菌株的筛选对–80 ℃冰箱保藏的菌株进行平板活化后挑取单菌落,将其接种于摇瓶中培养48 h制备种子液,随后向种子液加入终浓度为20 g/L的乙二醇进行全细胞催化,利用HPLC对发酵液进行检测。结合本实验室前期研究及文献调研,共计挑取800个单菌落进行筛选,结果发现,除已有文献报道的能产乙醇酸的泰国葡糖杆菌和氧化葡萄糖酸杆菌外[21],仅有一株红酵母菌能催化乙二醇合成乙醇酸。如图 2所示,3种菌株对比发现,红酵母催化乙二醇合成的乙醇酸产量及转化率均最高,72 h乙醇酸产量达1.6 g/L,转化率为65.8%。因此,后续研究中选择红酵母Rhodotorula sp.作为实验菌株。
|
| 图 2 不同菌种的乙醇酸产量(A)及转化率(B) Fig. 2 Glycolic acid production (A) and conversion rate (B) of different strains. GT: Gluconobacter Thailandicus. GO: Gluconobacter oxydans. RM: Rhodotorula sp.. GT:泰国葡糖杆菌. GO:氧化葡萄糖酸杆菌. RM:红酵母 |
| |
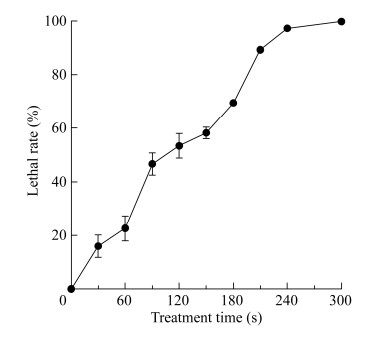
微生物遗传育种是提高菌株生产能力的有效手段[22],为了进一步提高实验菌株红酵母Rhodotorula sp.的乙醇酸产量,本研究通过紫外诱变改变其性状,以期获得一株高产菌株。将含有10 μL红酵母菌悬液的无菌金属载片置于暗室,利用紫外灯分别照射不同时间后用无菌生理盐水稀释涂布于YPD平板,30 ℃培养48 h后测定菌落数。致死率曲线如图 3所示,与大肠杆菌相比,红酵母的耐紫外照射能力更强[23],显现出更为稳定的性状。随着照射时间的不断延长,致死率也逐渐升高,当紫外照射时间为210 s时,致死率达89.3%,继续延长照射时间至240 s,致死率也随之提高到97.3%。当致死率在90.0%–99.0%时,获得正突变菌株的概率较高[24],因此,后续的诱变选择240 s作为最佳紫外照射时间。
|
| 图 3 红酵母紫外诱变致死率曲线 Fig. 3 UV mutagenesis lethality curve of Rhodotorula sp.. |
| |
生物传感器可以将代谢物的浓度以荧光、细胞生长速率等可视化的信号呈现出来,用电信号、化学信号等来代替生物信号[25],相较于传统检测方法更简便快速地对代谢物浓度进行半定量,已被广泛应用于微生物的高通量筛选。
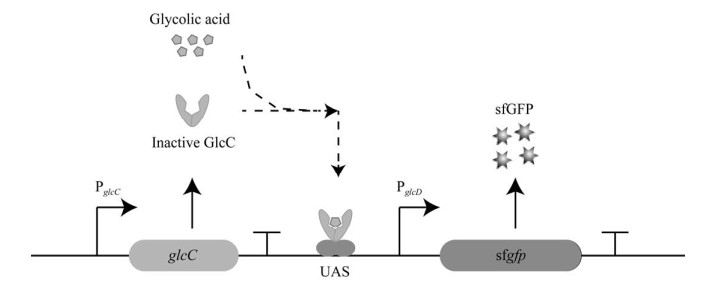
本实验室前期构建了乙醇酸生物传感器pGBS-Pffs-sfgfp,该传感器已成功应用于大肠杆菌产乙醇酸的高通量筛选[18],其工作原理如图 4所示。glcC基因组成型表达并编码GlcC可变构蛋白,在乙醇酸的诱导下,GlcC蛋白与乙醇酸结合,构象发生改变后与荧光蛋白上游激活序列(upstream activating sequence, UAS)结合,激活荧光蛋白基因sfgfp的启动子PglcD启动下游基因表达,在一定浓度范围内,绿色荧光强度与乙醇酸浓度成正比,可通过荧光强度来反映体系的乙醇酸浓度。
|
| 图 4 乙醇酸传感器工作原理 Fig. 4 The response principle of the glycolic acid biosensor. |
| |
为了验证上述传感器在红酵母高通量筛选中的可行性,本研究利用不同浓度乙二醇和乙醇酸的YPD溶液诱导含有传感器pGBS-Pffs-sfgfp的MglyC-GP6菌株,测试其荧光响应情况。由于乙醇酸发酵过程中需要添加底物乙二醇,因此首先对不同浓度乙二醇诱导下传感器的响应情况进行了研究,结果如图 5A所示,在0–10 g/L的乙二醇诱导下,传感器的荧光强度均保持恒定,表明乙醇酸传感器的特异性良好,其工作不会受到乙二醇的干扰。前期研究中测试所用的乙醇酸溶液为水溶液,对荧光检测的干扰较小,本研究所用发酵培养基为颜色较深的YPD培养基,为排除其颜色干扰,测定了不同浓度乙醇酸YPD溶液下传感器的响应情况,结果如图 5B所示,不同浓度乙醇酸诱导2 h后的荧光强度已有所差异,随着乙醇酸浓度的不断增加,荧光值也随之升高,表明YPD培养基的存在并未干扰传感器的正常工作。之前的研究中发现利用红酵母催化乙二醇合成乙醇酸时,48 h后乙醇酸产量仍在增加,表明培养基中的乙二醇未被完全消耗,为了评估在乙二醇及乙醇酸同时诱导下传感器的性能,更准确地将其应用于高通量筛选中,测定了传感器对10 g/L乙二醇及不同浓度乙醇酸混合溶液的响应情况,结果如图 5C所示,诱导4 h后已能观察到明显的梯度响应,表明传感器在乙二醇和乙醇酸混合溶液诱导下仍能稳定工作。诱导8 h时荧光强度最高,随后开始淬灭,因此,高通量筛选时确定诱导后8 h为最佳荧光检测时间点。
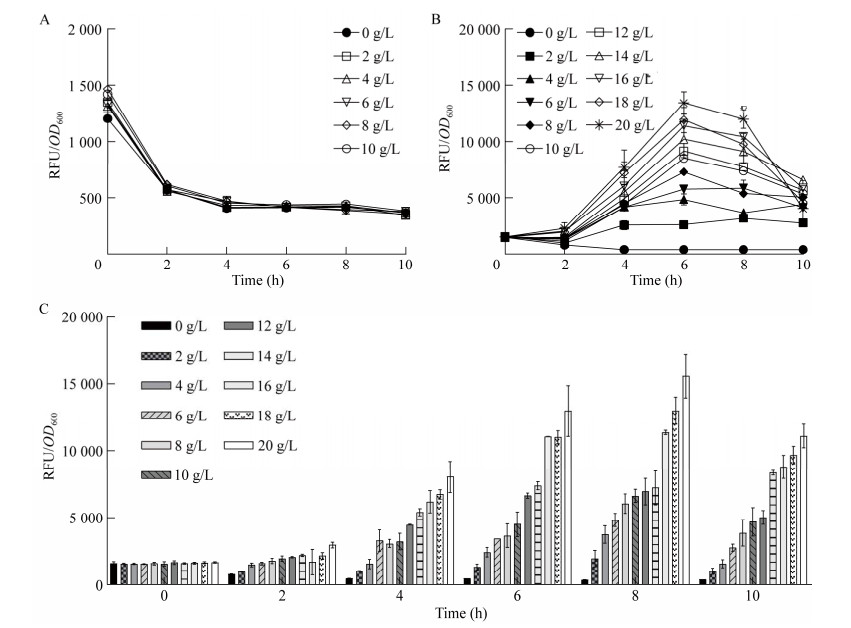
|
| 图 5 乙醇酸传感器对不同浓度乙二醇及乙醇酸的响应情况 Fig. 5 Response of glycolic acid biosensor to different concentrations of ethylene glycol and glycolic acid. A: Response of the biosensor to ethylene glycol. B: Response of the biosensor to glycolic acid. C: Response of the biosensor to the mixed solutions of 10 g/L ethylene glycol and glycolic acid at different concentrations. A:传感器对乙二醇的响应. B:传感器对乙醇酸的响应. C:传感器对10 g/L乙二醇及不同浓度乙醇酸混合溶液的响应 |
| |
将红酵母菌株菌悬液依照1.3.1的方法经紫外照射240 s后涂布于YPD平板,30 ℃培养48 h后挑取单菌落接种于48孔板中,依照1.3.3的方法进行孔板发酵,利用乙醇酸传感器对孔板发酵液中的乙醇酸进行半定量。如图 6A所示,共挑取567个经紫外诱变的红酵母单菌落,其单细胞荧光值分布于446.9–4 762.0之间,选择荧光值最高的20个单菌落进行摇瓶复筛。摇瓶发酵结果如图 6B所示,野生型菌株乙二醇的产量为1.3 g/L,生产速率为0.02 g/(L·h)。所有菌株中20号菌株的乙醇酸产量最高,为5.5 g/L,生产速率为0.08 g/(L·h),相较于野生型菌株产量及生产速率均有所提升。全细胞催化合成乙醇酸的过程中主要有两个酶参与了催化反应,分别是醇氧化酶及乙醇醛脱氢酶,20号菌株产量有显著提升的原因可能是紫外诱变使得上述两种酶的编码基因发生了突变,其底物亲和力或酶活有所提高,催化反应得以快速有效进行。因此,后续实验选择20号菌株用于乙醇酸发酵实验,将其命名为RMGly-20。
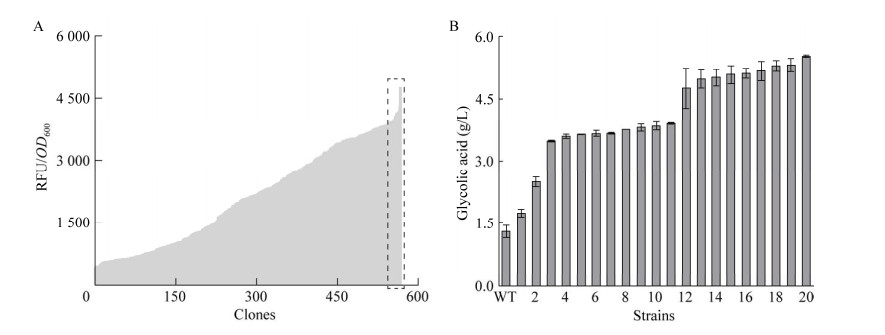
|
| 图 6 高通量筛选乙醇酸高产菌株 Fig. 6 High-throughput screening of glycolic acid producing strain. A: Fluorescence intensity of supernatant of pore plate fermentation. B: Titer of glycolic acid in shaking flasks. A:孔板发酵上清液的荧光强度. B:摇瓶条件下乙醇酸的产量 |
| |
在微生物发酵过程中,温度对产物的合成有显著影响[26]。温度过低时菌体生长受限,温度过高则影响蛋白正确折叠,降低催化效率。将菌株RMGly-20分别在25、28、30、33、37 ℃培养48 h后进行发酵催化,发酵72 h后检测发酵液中乙醇酸的产量。
结果如图 7A、7B所示,随着乙二醇的不断消耗,乙醇酸产量逐渐升高;当温度不断增加时,乙醇酸产量呈现先升高后降低的趋势。温度为28 ℃时,72 h乙醇酸产量最高,为15.5 g/L,此时产物得率为1.1 g/g乙二醇(图 7C);继续升高温度至37 ℃,发酵72 h后乙醇酸的产量降低至7.5 g/L。由此可见,菌株RMGly-20催化乙二醇生产乙醇酸的最适温度为28 ℃。
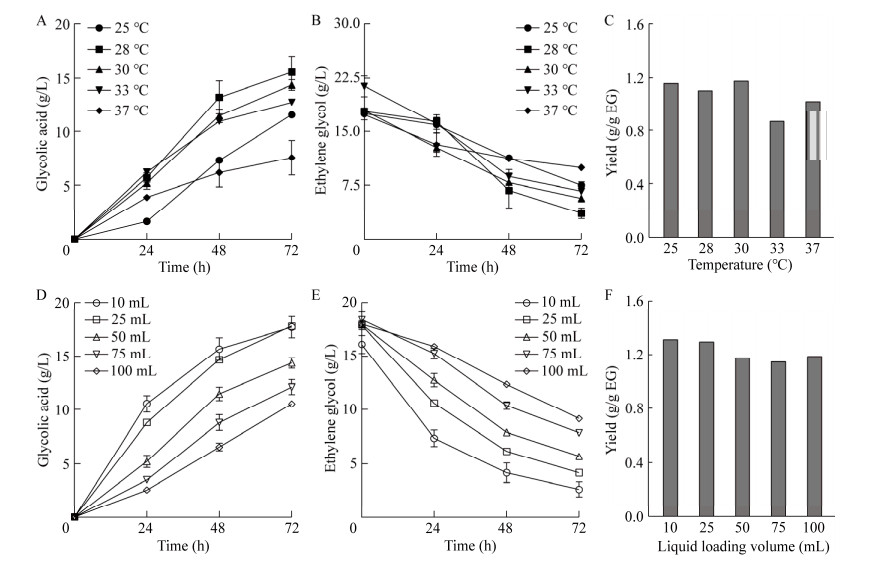
|
| 图 7 温度及装液量对乙醇酸产量的影响 Fig. 7 Effect of temperature and liquid loading volume on the titer of glycolic acid. A: Titer of glycolic acid at different temperatures. B: Concentration of ethylene glycol at different temperatures. C: Yield of glycolic acid for 72 h at different temperatures. D: Titer of glycolic acid at different liquid loading volumes. E: Concentration of ethylene glycol at different liquid loading volumes. F: Yield of glycolic acid for 72 h at different liquid loading volumes. EG: Ethylene glycol. A:不同温度下乙醇酸的产量. B:不同温度下乙二醇的含量. C:不同温度下72 h乙醇酸的得率. D:不同装液量下乙醇酸的产量. E:不同装液量下乙二醇的含量. F:不同装液量下72 h乙醇酸的得率. EG:乙二醇 |
| |
在乙二醇全细胞催化生产乙醇酸的过程中,乙二醇一侧的羟基经氧化反应被催化为羧基,此过程为需氧反应[13],因此,乙醇酸的发酵过程也是好氧发酵的过程。氧气对于好氧发酵至关重要[27],为探究溶氧对乙醇酸产量的影响,本研究通过不同装液量来调节摇瓶发酵过程中的溶氧量。控制250 mL摇瓶中YPD培养基的装液量分别为10、25、50、75、100 mL,发酵72 h后检测发酵液中乙醇酸的产量。
结果如图 7D、7E所示,乙醇酸的合成与乙二醇的消耗均与装液量高度相关。随着装液量的逐渐增加,乙醇酸的产量逐渐降低,乙二醇的消耗也逐渐减少,表明良好的溶氧条件更有利于乙醇酸的生产;当菌株在含有10 mL YPD培养基的250 mL摇瓶中进行培养发酵时,乙醇酸产量为15.6 g/L。至发酵72 h,装液量为25 mL的摇瓶乙醇酸产量与10 mL装液量的产量持平,为17.8 g/L,相较于原始菌株提高了10.1倍,此时乙醇酸的得率也较高(图 7F)。考虑到装液量过低时发酵液被蒸发浓缩的影响较大,因此,乙醇酸发酵过程中较合适的摇瓶发酵装液量为25 mL。
2.3.3 乙醇酸耐受性评估从摇瓶到发酵罐的放大研究中,菌株对产物的耐受性往往是影响产量提高的重要因素。为了探究全细胞催化时菌株RMGly-20对乙醇酸的耐受性,通过摇瓶首先制备了用于催化乙二醇产乙醇酸的种子液,随后向种子液中添加了不同浓度的乙醇酸,其生长曲线如图 8所示。随着乙醇酸浓度的不断增加,菌株的OD600逐渐降低,当乙醇酸浓度达70 g/L时,菌体OD600随培养时间的延长并无明显变化。由此可见,本研究获得的高产菌株RMGly-20可耐受60 g/L的乙醇酸,可为后续乙醇酸的上罐提供指导。
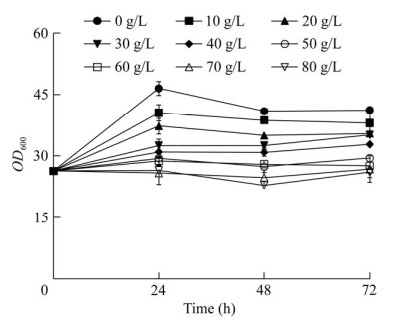
|
| 图 8 不同乙醇酸浓度下菌株RMGly-20的生长曲线 Fig. 8 Growth curves of RMGly-20 under different concentrations of glycolic acid. |
| |
为进一步提高乙醇酸的产量,利用5 L发酵罐对菌株RMGly-20进行培养及发酵。结合2.3发酵优化的条件进行催化。如图 9A所示,至培养16 h,葡萄糖消耗殆尽,此时以1 g/(L·h)的速度流加葡萄糖补充菌体生长所需碳源,培养48 h时对菌液进行离心,用磷酸盐缓冲液重悬菌体以替换原有的种子上清液,避免菌株利用葡萄糖代谢生成乙醇酸对催化结果造成干扰,随后加入20 g/L乙二醇进行发酵。之前的研究发现,在全细胞催化乙二醇合成乙醇酸的过程中,良好的溶氧条件有利于乙醇酸的合成,因此,发酵期间通过关联转速保证罐内溶氧维持在30%以提高催化效率。与此同时,通过流加补料的方式控制罐内乙二醇残留浓度,避免乙二醇浓度过高时抑制催化速率,结果如图 9B所示,发酵72 h时乙醇酸产量为61.1 g/L,共消耗乙二醇58.9 g/L,产率为84.3%,继续延长发酵时间至96 h,乙醇酸产量并无明显提升,分析原因可能是发酵液中高浓度的乙醇酸抑制了菌体催化活性。相较于利用葡萄糖酸杆菌产乙醇酸[15],红酵母生产乙醇酸时使用价格低廉的葡萄糖对菌株进行培养,成本低且转化率高,更适用于工业化生产。
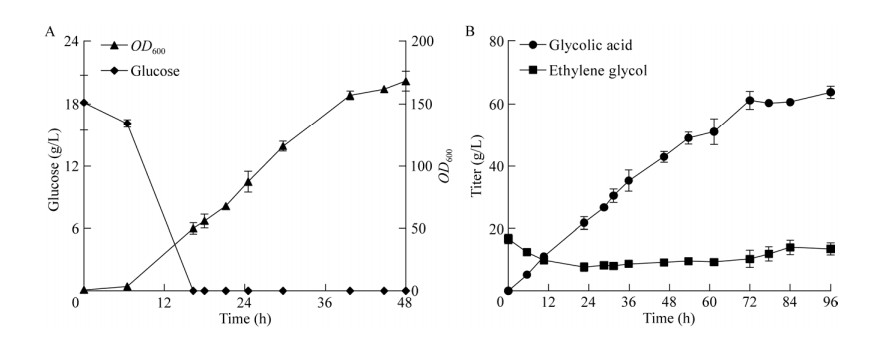
|
| 图 9 菌株RMGly-20在5 L发酵罐中培养生产乙醇酸 Fig. 9 Glycolic acid production of RMGly-20 in 5 L bioreactor. A: Growth curve and residual sugar concentration during cell culture. B: Concentration of glycolic acid and ethylene glycol during cell fermentation. A:菌体培养期间生长曲线及残糖浓度. B:菌体发酵期间乙醇酸及乙二醇的含量 |
| |
在本研究中,首先以实验室现有菌株为基础,筛选获得了一株可以全细胞催化乙二醇生产乙醇酸的红酵母,实现了以乙二醇为底物的乙醇酸的生物合成。随后,基于乙醇酸生物传感器通过紫外诱变对红酵母进行随机突变,获得了一株乙醇酸高产菌株RMGly-20。在此基础上,从摇瓶层面对温度和装液量进行了优化。进一步地,在5 L发酵罐放大实验中,以葡萄糖为碳源培养菌体,通过补料分批流加乙二醇,最终乙醇酸的产量达到61.1 g/L,产率为84.3%。尽管目前报道的全细胞催化法合成乙醇酸的最高产量为113.8 g/L[15],但其菌体培养过程中需要添加大量价格昂贵的山梨醇作为碳源,不利于大规模工业化推广。
作为一种非模式菌株,红酵母的遗传操作方法尚不完善,利用代谢工程的手段对其进行改造存在一定的困难。诱变育种通过随机突变的方式改变菌株的性状,该方法不受限于菌株种属,是提高非模式菌株生产性能的有效途径。然而,育种过程往往伴随大量的菌株筛选工作,因此,高效的菌株筛选方法对提高育种效率尤为重要。随着合成生物学领域的兴起,基于生物传感器的高通量筛选方法逐步为人们熟知并应用。本研究首先对乙醇酸生物传感器应用于筛选红酵母菌的可行性进行了分析,确立了红酵母诱变菌株的高通量筛选方法。随后采用紫外诱变对获得的红酵母进行随机突变,通过高通量筛选获得了具有优良性状的正突变株RMGly-20,对温度和装液量进行优化后,72 h该菌株的乙醇酸产量达17.8 g/L,相较于原始菌株提高了10.1倍,为非模式菌株的遗传改造提供了新的思路。
为进一步提高菌株RMGly-20的乙醇酸产量,推动其工业化生产,在后续的研究中,可从以下方面展开实验。(1) 5 L发酵罐工艺优化:从种子培养时间及乙二醇补加方式等方面入手,通过发酵优化提高乙醇酸产量及生产效率;(2) 实验室适应性进化提高菌株性能:由于乙醇酸酸性较强,催化过程中需要补加氨水以调节pH,菌株的耐酸性及产物耐受性可能也是限制乙醇酸产量的原因。因此,可通过适应性进化提高菌株耐酸性及对乙醇酸的耐受性,以期减少催化过程中碱的添加量并改善菌株生产性能;(3) 深入挖掘菌株催化机理:目前红酵母催化产乙醇酸的机理尚不清晰,可通过转录组学、代谢组学等手段对该菌株的催化机理展开研究[28],解析乙醇酸合成的基本通路及关键基因,将其异源表达于其他模式菌株体内,通过基因工程等手段对其进行改造以进一步提高产量。
| [1] |
ZHAN T, CHEN Q, ZHANG C, BI CH, ZHANG XL. Constructing a novel biosynthetic pathway for the production of glycolate from glycerol in Escherichia coli[J]. ACS Synthetic Biology, 2020, 9(9): 2600-2609.
|
| [2] |
LI W, CHEN J, LIU CX, YUAN QP, LI ZJ. Microbial production of glycolate from acetate by metabolically engineered Escherichia coli[J]. Journal of Biotechnology, 2019, 291: 41-45.
|
| [3] |
CABULONG RB, BAÑARES AB, NISOLA GM, LEE WK, CHUNG WJ. Enhanced glycolic acid yield through xylose and cellobiose utilization by metabolically engineered Escherichia coli[J]. Bioprocess and Biosystems Engineering, 2021, 44(6): 1081-1091.
|
| [4] |
商宽祥, 张大洲, 卢文新, 张宗飞, 谢鸿洲, 张国建. 乙醇酸市场前景及技术进展分析[J]. 化肥设计, 2022, 60(4): 5-7, 35. SHANG KX, ZHANG DZ, LU WX, ZHANG ZF, XIE HZ, ZHANG GJ. Analysis of glycolic acid market prospects and technology progress[J]. Chemical Fertilizer Design, 2022, 60(4): 5-7, 35 (in Chinese). |
| [5] |
KIM K, FUJITA M, DAIMON H, FUJIE K. Change of monochloroacetic acid to biodegradable organic acids by hydrothermal reaction[J]. Journal of Hazardous Materials, 2004, 108(1/2): 133-139.
|
| [6] |
王保伟, 宋华, 许根慧. Cu-Ag/SiO2催化剂上草酸二甲酯加氢反应的研究[C]. 第十届全国青年催化学术会议, 呼和浩特, 2005. WANG BW, SONG H, XU GH. Study on hydrogenation of dimethyl oxalate over Cu-Ag/SiO2 catalyst[C]. The 10th National Youth Congress on Catalysis, Hohhot, 2005 (in Chinese). |
| [7] |
KOIVISTOINEN OM, KUIVANEN J, BARTH D, TURKIA H, PITKÄNEN JP, PENTTILÄ M, RICHARD P. Glycolic acid production in the engineered yeasts Saccharomyces cerevisiae and Kluyveromyces lactis[J]. Microbial Cell Factories, 2013, 12: 82.
|
| [8] |
KANG NK, KIM M, BAEK K, CHANG YK, ORT DR, JIN YS. Photoautotrophic organic acid production: Glycolic acid production by microalgal cultivation[J]. Chemical Engineering Journal, 2022, 433: 133636.
|
| [9] |
LEE SS, PARK J, HEO YB, WOO HM. Case study of xylose conversion to glycolate in Corynebacterium glutamicum: current limitation and future perspective of the CRISPR-Cas systems[J]. Enzyme and Microbial Technology, 2020, 132: 109395.
|
| [10] |
YU Y, SHAO MY, LI D, FAN FY, XU HT, LU FP, BI CH, ZHU XN, ZHANG XL. Construction of a carbon-conserving pathway for glycolate production by synergetic utilization of acetate and glucose in Escherichia coli[J]. Metabolic Engineering, 2020, 61: 152-159.
|
| [11] |
LIN Y, CHEN WW, DING B, GUO M, LIANG M, PANG H, WEI YT, HUANG RB, DU LQ. Highly efficient bioconversion of icariin to icaritin by whole-cell catalysis[J]. Microbial Cell Factories, 2023, 22(1): 64.
|
| [12] |
KATAOKA M, SASAKI M, HIDALGO AR, NAKANO M, SHIMIZU S. Glycolic acid production using ethylene glycol-oxidizing microorganisms[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(10): 2265-2270.
|
| [13] |
CARNIEL A, SANTOS AG, JÚNIOR LSC, CASTRO AM, COELHO MAZ. Biotransformation of ethylene glycol to glycolic acid by Yarrowia lipolytica: a route for poly(ethylene terephthalate) (PET) upcycling[J]. Biotechnology Journal, 2023, 18(6): e2200521.
|
| [14] |
PANDIT AV, HARRISON E, MAHADEVAN R. Engineering Escherichia coli for the utilization of ethylene glycol[J]. Microbial Cell Factories, 2021, 20(1): 22.
|
| [15] |
ZHANG H, SHI LL, MAO XL, LIN JP, WEI DZ. Enhancement of cell growth and glycolic acid production by overexpression of membrane-bound alcohol dehydrogenase in Gluconobacter oxydans DSM 2003[J]. Journal of Biotechnology, 2016, 237: 18-24.
|
| [16] |
DENG Y, MA N, ZHU KJ, MAO Y, WEI XT, ZHAO YY. Balancing the carbon flux distributions between the TCA cycle and glyoxylate shunt to produce glycolate at high yield and titer in Escherichia coli[J]. Metabolic Engineering, 2018, 46: 28-34.
|
| [17] |
胡成杰. 乙醇酸生物法高效合成研究[D]. 无锡: 江南大学硕士学位论文, 2023. HU CJ. Efficient bio-synthesis of glycolic acid[D]. Wuxi: Master's Thesis of Jiangnan University, 2023 (in Chinese). |
| [18] |
XU SM, ZHANG LP, ZHOU SH, DENG Y. Biosensor-based multigene pathway optimization for enhancing the production of glycolate[J]. Applied and Environmental Microbiology, 2021, 87(12): e0011321.
|
| [19] |
ZHU KJ, LI GH, WEI R, MAO Y, ZHAO YY, HE AY, BAI ZH, DENG Y. Systematic analysis of the effects of different nitrogen source and ICDH knockout on glycolate synthesis in Escherichia coli[J]. Journal of Biological Engineering, 2019, 13: 30.
|
| [20] |
DING NN, YUAN ZQ, ZHANG XJ, CHEN J, ZHOU SH, DENG Y. Programmable cross-ribosome-binding sites to fine-tune the dynamic range of transcription factor-based biosensor[J]. Nucleic Acids Research, 2020, 48(18): 10602-10613.
|
| [21] |
HUA X, ZHOU X, XU Y. Improving techno- economics of bioproduct glycolic acid by successive recycled-cell catalysis of ethylene glycol with Gluconobacter oxydans[J]. Bioprocess and Biosystems Engineering, 2018, 41(10): 1555-1559.
|
| [22] |
ALJAMMAS HA, YAZJI S, AZIZIEH A. Enhancement of protease production from Rhizomucor miehei by mutagenesis with ethyl methanesulfonate, ultraviolet, and microwaves: a preliminary study[J]. Bioresource Technology Reports, 2022, 20: 101287.
|
| [23] |
FANG K, MA J, WANG XY, XU ZT, ZHANG ZY, LI PW, WANG RM, WANG JQ, SUN CY, DONG ZY. Flow-cytometric cell sorting coupled with UV mutagenesis for improving pectin lyase expression[J]. Frontiers in Bioengineering and Biotechnology, 2023, 11: 1251342.
|
| [24] |
LUO ZS, ZENG WZ, DU GC, LIU S, FANG F, ZHOU JW, CHEN J. A high-throughput screening procedure for enhancing pyruvate production in Candida glabrata by random mutagenesis[J]. Bioprocess and Biosystems Engineering, 2017, 40(5): 693-701.
|
| [25] |
TAO RK, ZHAO YZ, CHU HY, WANG AX, ZHU JH, CHEN XJ, ZOU YJ, SHI M, LIU RM, SU N, DU JL, ZHOU HM, ZHU LY, QIAN XH, LIU HY, LOSCALZO J, YANG Y. Genetically encoded fluorescent sensors reveal dynamic regulation of NADPH metabolism[J]. Nature Methods, 2017, 14: 720-728.
|
| [26] |
周媛媛. 来源于Bacillus xiaoxiensis STB08的β-CGT酶在大肠杆菌中的分泌表达及发酵优化[D]. 无锡: 江南大学硕士学位论文, 2022. ZHOU YY. Secretion expression in Escherichia coli and fermentation optimization of β-CGTase from Bacillus xiaoxiensis STB08[D]. Wuxi: Master's Thesis of Jiangnan University, 2022 (in Chinese). |
| [27] |
张红, 林金连, 胡定行, 刘贵友, 孙磊. 大肠杆菌高密度发酵表达4-羟基苯乙酸酯3-羟化酶及咖啡酸的高效生物合成[J]. 生物工程学报, 2022, 38(9): 3466-3477. ZHANG H, LIN JL, HU DH, LIU GY, SUN L. High-density fermentation of Escherichia coli to express 4-hydroxyphenylacetate 3-hydroxylase and efficient biosynthesis of caffeic acid[J]. Chinese Journal of Biotechnology, 2022, 38(9): 3466-3477 (in Chinese). |
| [28] |
HE Q, LIU YH, LIU DH, GUO MM. Integration of transcriptomic and proteomic approaches unveils the molecular mechanism of membrane disintegration in Escherichia coli O157: H7 with ultrasonic treatment[J]. The Science of the Total Environment, 2021, 791: 148366.
|