代谢工程改造大肠杆菌生产胸苷
姚卓越
,
李然
,
蒋帅
,
吴鹤云
,
马倩
,
谢希贤
生物工程学报  2024, Vol. 40 2024, Vol. 40 Issue (8): 2432-2443 Issue (8): 2432-2443 |

胸苷作为一种由2-脱氧核糖和胸腺嘧啶碱基构成的天然核苷,是抗艾滋病药物叠氮胸苷和司他夫定的关键前体物[1]。目前,胸苷普遍采用化学合成法或酶法生产。但是,现有生产工艺存在胸苷产量低、环境污染严重和生产成本高昂等问题[2]。因此,开发廉价且高效的胸苷生产方法成为满足胸苷市场需求量的关键。随着系统代谢工程与合成生物学技术的迅速发展,基于微生物发酵法的胸苷生产工艺成为近年来的研究热点。其中,构建高效、稳定的胸苷生产细胞工厂是开发绿色、经济胸苷生产工艺的核心。
在微生物中,嘧啶核苷的合成途径主要有两种:一是利用葡萄糖、氮源等基质从头合成嘧啶核苷类物质,称为从头合成途径(de novo pathway);另一条是核苷酸代谢产生的胸腺嘧啶碱基、脱氧核糖和磷酸重新经过核糖基化、磷酸化生成嘧啶核苷,称为补救途径(salvage pathway)。以大肠杆菌为例,胸苷从头合成途径冗长,代谢通量受多种负反馈调节。除此之外,胸苷从头合成途径与DNA合成相关,多个关键酶的底物选择性较差,胸苷合成存在较多竞争途径(图 1)。因此,如何优化胸苷从头合成途径代谢通量分布与关键酶表达成为构建胸苷高效生产菌株过程中面临的挑战。近年来,研究人员主要采用阻断胸苷降解途径[3-4]、增强前体物供应[4-7]、优化胸苷合成途径[8-9]、平衡胞内氧化还原平衡[10]等策略修饰底盘微生物中胸苷合成途径代谢通量。其中,Kim等[6]以大肠杆菌为出发菌株,通过阻断胸苷分解途径、删除阻遏蛋白解除反馈抑制、强化异源酶以提高胸苷合成通量、修饰胞内氧化还原平衡等策略,得到的最终菌株以甘油为碳源发酵120 h后产生13.2 g/L胸苷。然而,现有胸苷工程菌株仍存在产量低、发酵周期长等问题。为了推动胸苷经济化大规模生产,构建高效、稳定的胸苷生产微生物细胞工厂依然是研究人员努力的方向。

|
| 图 1 代谢工程改造大肠杆菌生产胸苷 Fig. 1 Metabolic engineering of Escherichia coli for thymidine production. Genes and their corresponding enzymes were shown as follows: pyrAA/AB: Carbamoylphosphate synthetase; pyrB: Aspartate carbamoyl transferase; pyrC: Dihydroorotase; pyrD/K: Dihydroorotate dehydrogenase; pyrE: Orotate phosphoribosyltransferase; pyrF: OMP decarboxylase; pyrH: Nucleoside phosphate kinase; nrd: Nucleotide diphosphate reductase; ndk: Nucleoside diphosphate kinase; dut: Deoxyribonucleotide triphosphatase; thyA: Thymidylate synthase; TMPase: PBS TMP phosphohydrolase; deoA: Thymidine phosphorylase; tdk: Thymidine kinase; udp: Uridine phosphorylase; udk: Uridine/cytidine kinase; tmk: dTMP kinase. Abbreviations: G6P: Glucose 6-phosphate; OAA: Oxaloacetate; OMP: Orotidylic acid; UMP: Uridylic acid; UDP: Uridine 5'-diphosphated; dUDP: 2'-deoxyuridine 5'-diphosphate; UTP: Uridine triphosphate; dUTP: 2'-deoxyuridine triphosphate; CTP: Cytidine triphosphate; dCTP: Deoxycytidine triphosphate; CDP: Cytidine diphosphate; dCDP: 2'-deoxycytidine diphosphate; dUMP: Deoxyuridylic acid; dTMP: Thymidylic acid; dUDR: Deoxyuridine; dTDP: Deoxythymidine 5'-diphosphate; eco: Escherichia coli; bsu: Bacillus subtilis. |
| |
本研究以野生型大肠杆菌(Escherichia coli) MG1655为底盘菌株,采用系统代谢工程策略优化胸苷合成途径代谢通量分布及关键酶表达,以期获得高效合成胸苷的微生物细胞工厂。首先,依次敲除deoA、tdk、udp、rihA、rihB、rihC基因,以阻断胸苷分解途径和回补途径;随后,引入异源的嘧啶合成操纵子基因,以增强前体物尿苷酸(uridylic acid, UMP)的积累;最后,依次优化胸苷合成途径中尿苷酸激酶、核糖核苷二磷酸还原酶、胸苷酸合酶和5′-核苷酸酶的表达。在5 L发酵罐中,构建的最优THY6-2工程菌株胸苷产量、转化率和生产强度分别达到了11.10 g/L、0.04 g/g葡萄糖、0.23 g/(L·h)。
1 材料与方法 1.1 菌株和质粒本研究所用的菌株与质粒如表 1所示。
| Strains/Plasmids | Characteristics | Sources |
| Strains | ||
| Escherichia coli DH5α | Host for cloning | Lab store |
| Bacillus subtilis F126 | Donor of pyrimidine operon genes | [11] |
| E. coli MG1655 | Wild type, starting strain | Lab store |
| THY1 | E. coli MG1655, ΔdeoA, Δtdk, Δudp, ΔrihA, ΔrihB, ΔrihC | This study |
| THY2 | THY1, yghX: : Ptrc-pyrBCAAAB*KDFEbsu | This study |
| THY3-1 | THY2, ybeM: : Ptrc-pyrHbsuD90A | This study |
| THY3-2 | THY2, ybeM: : Ptrc-pyrHecoD93A | This study |
| THY3-3 | THY2, ybeM: : PT7-pyrHbsuD90A | This study |
| THY3-4 | THY3-1, ygaY: : Ptrc-pyrHbsuD90A | This study |
| THY4-1 | THY3-4, yciQ: : Ptrc-nrdABCT4 | This study |
| THY4-2 | THY3-4, yciQ: : Ptrc-nrdABCeco | This study |
| THY4-3 | THY4-2, gapC: : Ptrc-nrdABCeco | This study |
| THY4-4 | THY4-3, yjgX: : Ptrc-ndkeco | This study |
| THY4-5 | THY4-4, ycgH: : Ptrc-duteco | This study |
| THY5-1 | THY4-5, ilvG: : Ptrc-tdT4 | This study |
| THY5-2 | THY4-5, ilvG: : Ptrc-CDC21sce | This study |
| THY5-3 | THY4-5, ilvG: : Ptrc-thyAbsu | This study |
| THY5-4 | THY4-5, ilvG: : Ptrc-thyAbaz | This study |
| THY6-1 | THY5-3, mbhA: : Ptrc-ushAeco | This study |
| THY6-2 | THY5-3, mbhA: : Ptrc-TMPase | This study |
| THY6-3 | THY6-2, yeeP: : Ptrc-TMPase | This study |
| Plasmids | ||
| pREDCas9 | Sper, Cas9 and λ Red recombinase expression vector | [12] |
| pGRB | Ampr, gRNA expression vector | [12] |
| Ampr: Ampicillin resistance; Sper: Spectinomycin resistance. | ||
本研究采用CRISPR/Cas9基因编辑技术[12]对底盘菌株E. coli MG1655进行代谢改造,以构建胸苷工程菌株。CRISPR系统由pGRB质粒、pREDCas9质粒、DNA重组片段3个元件共同介导完成基因改造。其中pGRB质粒包含启动子、gRNA蛋白结合区域和终止子,携带氨苄青霉素抗性(50 μg/mL,37 ℃培养);pREDCas9质粒包含RED重组酶、Cas9蛋白以及阿拉伯糖诱导的pGRB质粒消除系统,携带奇霉素抗性(50 μg/mL,32 ℃培养)。基因重组过程由pGRB质粒表达特异性gRNA识别目的基因靶序列与pREDCas9质粒表达的Cas9蛋白共同介导实现靶序列的精准切割,随后在RED重组酶作用下将DNA片段以同源重组的方式对切割位点进行修复,最后依次消除两个工具质粒,获得无质粒工程菌。本研究在基因编辑过程中使用的引物与gRNA序列已提交至国家微生物科学数据中心(登录号:NMDCX0000277)。
1.3 工程菌株发酵斜面培养基(g/L):Yeast Extract 5.0,Tryptone 10.0,NaCl 5.0,牛肉膏10.0,葡萄糖5.0,琼脂粉20.0。
种子培养基(g/L):Yeast Extract 5.0,Tryptone 3.0,KH2PO4 5.0,FeSO4·7H2O 0.01,MnSO4·H2O 0.01,VB1、VB3、VB5、VB12、VH各0.001。
发酵培养基(g/L):Yeast Extract 4.0,Tryptone 5.0,KH2PO4 7.0,柠檬酸2.0,甲硫氨酸1.0,FeSO4·7H2O 0.01,MnSO4·H2O 0.01,VB1、VB3、VB5、VB12、VH各0.001。
1.3.1 摇瓶发酵将菌株接种到斜面培养基培养12 h后,转接至装有30 mL种子培养基的500 mL锥形瓶,220 r/min、37 ℃培养8−10 h。待菌体OD600 为4左右时,以10%的接种量(3 mL)转接至装有26 mL的500 mL挡板瓶发酵培养基中,并且补加1 mL葡萄糖(60%,质量体积比),220 r/min、37 ℃连续培养发酵24 h。发酵过程中通过添加氨水(25%,体积比)来维持整体pH在7.0左右,补加葡萄糖维持菌体生长与胸苷生产。
1.3.2 发酵罐发酵菌株进行两次斜面培养基活化后,用无菌水将斜面上菌落冲洗下来制成菌悬液,全部接种到装有3 L种子培养基的5 L发酵罐中进行扩大培养,当种子OD600达到10−16时,按15%的接种量(450 mL)接入装有3 L发酵培养基的发酵罐中发酵培养,初始发酵培养基中葡萄糖为10 g/L,通过自动控制流加氨水维持pH在7.0左右,发酵温度保持在35 ℃,溶氧控制在25%−35%。当罐中的葡萄糖耗尽时,以一定速率流加葡萄糖(80%,质量体积比),发酵过程中残留葡萄糖浓度维持在0.1−3.0 g/L。
1.4 分析方法生物量:将待测样品稀释适当浓度后,采用紫外分光光度仪在600 nm (OD600)处检测吸光度值。
残糖浓度:将待测样品稀释适当浓度后,采用SBA生物传感仪检测发酵液中残留葡萄糖浓度。
嘧啶类核苷酸检测:使用高效液相色谱仪Thermo U3000;色谱柱Titank C18柱(250 mm× 4.6 mm, 5 μm);流动相为乙腈: 三氟乙酸: 水= 5:0.05:94.5;柱温30 ℃;流速1 mL/min;紫外检测波长260 nm;进样量20 μL。
数据统计学分析:发酵数据代表3组平行发酵数据的均值与标准差。利用t检验双尾分布对两组发酵数据进行单向方差分析。当0.01 < P < 0.05时用“*”标示,表示数据差异显著;当P < 0.01时用“**”标示,表示数据差异极显著。
2 结果与分析 2.1 胸苷分解途径及回补途径的阻断在大肠杆菌中,核苷水解酶(由rihA/B/C基因编码)具有催化胸苷分解为胸腺嘧啶的能力[13],阻断胸苷分解途径是实现胸苷积累的关键之一。除此之外,由于嘧啶核苷的结构类似,大肠杆菌中存在多个酶可以同时催化胸苷与其他核苷之间相互转化。其中,胸苷磷酸化酶(由deoA基因编码)催化胸苷与胸腺嘧啶的可逆转化;胸苷激酶(由tdk基因编码)催化胸苷与胸苷酸(thymidylic acid; dTMP)的可逆转化;尿苷磷酸化酶(由udp基因编码)可同时催化尿苷和胸苷裂解为相应的嘧啶和(脱氧)核糖-1-磷酸。先前的研究表明,依次敲除deoA、tdk、udp可以有效地降低胸苷与其他核苷之间的相互转化,进而提高胸苷的积累量[3-4]。
本研究依次敲除野生型E. coli MG1655菌株基因组中deoA、tdk、udp、rihA、rihB、rihC基因,构建了THY1菌株。摇瓶发酵结果显示,野生型E. coli MG1655菌株中尿嘧啶产量为0.09 g/L,没有检测到尿苷积累,OD600值为55.5;THY1菌株中无尿嘧啶积累,但尿苷积累量达到2.10 g/L,OD600值为52.3 (图 2)。发酵数据表明,阻断胸苷降解途径和回补途径并未对菌株生长表型造成不利影响,副产物尿嘧啶消失,同时检测到尿苷积累。但是,发酵样品中并未检测到胸苷积累,可能是由于其合成途径冗长,且合成途径代谢通量受严格反馈调控机制控制,导致胸苷合成途径代谢通量不足。
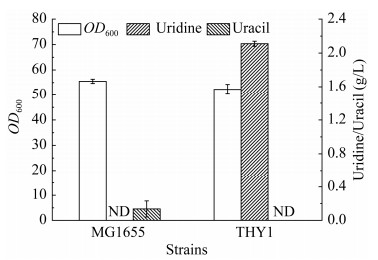
|
| 图 2 阻断胸苷降解途径和回补途径对细胞生长与胸苷生产的影响 Fig. 2 Effect of blocking the degradation pathway and salvage pathway on cell growth and thymidine production. MG1655 indicates the wild-type E. coli MG1655. The genotype of THY1 strain: MG1655, ΔdeoA, Δtdk, Δudp, ΔrihA, ΔrihB, ΔrihC. ND: Not detected. |
| |
在大肠杆菌中,尿苷酸(UMP)是合成胸苷的关键前体物,其生物合成途径由8步酶(分别由carA/B、pyrB/I、pyrC、pyrD、pyrE、pyrF基因编码)催化反应组成,且合成途径代谢通量受严格的反馈调控机制控制。其中,pyrBI、pyrE和pyrF操纵子转录受UMP的反馈抑制;pyrC和pyrD操纵子转录受三磷酸胞苷(cytidine triphosphate, CTP)和三磷酸鸟苷(guanosine triphosphate, GTP)的共同调控;carAB操纵子表达受到嘧啶核苷和精氨酸的共同调控[13-15]。在先前的研究中,Fan等[11]以枯草芽孢杆菌(Bacillus subtilis) 168为出发菌株,采用ARTP随机诱变结合高通量筛选策略得到尿苷高产突变菌株B. subtilis F126,该菌株中UMP合成途径代谢通量显著增强。
为了增强嘧啶核苷前体物UMP的合成途径代谢通量,本研究将来源于B. subtilis F126中的pyr操纵子基因整合至THY1菌株中yghX假基因位点,由Ptrc启动子控制,构建了THY2菌株。摇瓶发酵结果显示(图 3),THY2菌株中尿苷产量为5.60 g/L,较对照THY1菌株提升166.7%;胸苷产量为0.18 g/L。发酵数据表明,引入异源嘧啶核苷操纵子基因可以显著增强UMP合成途径代谢通量,从而为下游产物胸苷合成提供充足的前体物。除此之外,THY2菌株中胸苷产量远低于前体物UMP的产量,表明从UMP至胸苷的合成途径代谢通量强度较弱。因此,强化UMP至胸苷的合成途径代谢通量是进一步提高胸苷合成效率的关键。
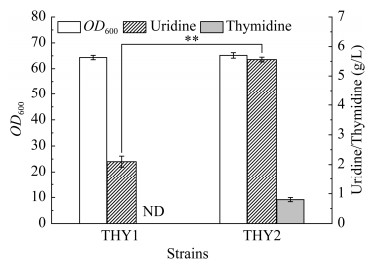
|
| 图 3 增强前体物UMP供应对细胞生长与胸苷生产的影响 Fig. 3 Effect of enhancing the supply of precursor UMP on cell growth and thymidine production. The genotype of strains were THY2: THY1, yghX: : Ptrc-pyrBCAAAB*KDFEbsu; THY1, MG1655, ΔdeoA, Δtdk, Δudp, ΔrihA, ΔrihB, ΔrihC. ND: Not detected. The ** represents P < 0.01. |
| |
在大肠杆菌中,尿苷酸激酶(由pyrH基因编码)催化尿苷酸(UMP)生成二磷酸尿苷(uridine diphosphate, UDP),是尿苷酸流向胸苷合成途径中的第一步反应。尿苷酸激酶活性受到GTP的变构激活和UTP的反馈抑制。有研究表明,尿苷酸激酶突变体pyrHD93A可以显著减弱UTP触发的反馈抑制机制[16]。除此之外,枯草芽孢杆菌作为嘧啶核苷的优势底盘菌株[17-18]其天然嘧啶核苷代谢更强,来自B. subtilis 168的代谢酶可能比E. coli MG1655具有更高的催化活性。因此,本研究尝试将pyrHbsu蛋白序列第90位天冬氨酸突变为丙氨酸(D90A),以评估修饰后的尿苷酸激酶对胸苷合成的影响。
本研究分别将修饰后的pyrHbsuD90A、pyrHecoD93A基因整合至THY2菌株的ybeM基因位点,并由Ptrc启动子控制,分别构建了THY3-1和THY3-2菌株。摇瓶发酵结果显示,与对照THY2菌株相比,THY3-1菌株OD600值提高4.4%,胸苷产量为0.31 g/L,较对照菌株(0.18 g/L)提高了72.2%。除此之外,THY3-1菌株中副产物尿苷的产量降低了90.7% (由5.60 g/L降低至0.52 g/L) (图 4A)。THY3-2菌株中胸苷产量为0.21 g/L,较对照菌株提升了16.7%,尿苷产量为2.80 g/L,较对照菌株降低了50.0% (图 4A)。发酵数据表明,与大肠杆菌本源的pyrHecoD93A相比,来源于枯草芽孢杆菌的pyrHbsuD90A更利于提高胸苷合成效率。
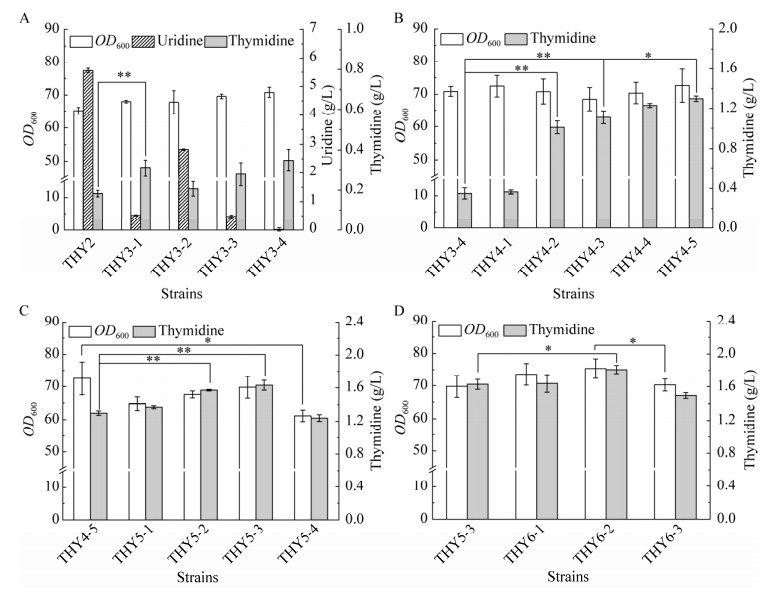
|
| 图 4 优化胸苷合成途径对细胞生长与胸苷生产的影响 Fig. 4 Effect of optimization of the thymidine synthesis pathway on cell growth and thymidine production. A: The effect of optimization uridine phosphatase on cell growth and thymidine production. The genotype of strains were THY3-1: THY2, ybeM: : Ptrc-pyrHbsuD90A; THY3-2: THY2, ybeM: : Ptrc-pyrHecoD93A; THY3-3: THY2, ybeM: : PT7-pyrHbsuD90A; THY3-4: THY3-1, ygaY: : Ptrc-pyrHbsuD90A. B: The effect of optimization nucleotide diphosphate reductase, nucleoside diphosphate kinase and deoxyribonucleotide triphosphatase on cell growth and thymidine production. The genotype of strains were THY4-1: THY3-4 yciQ: : Ptrc-nrdABCT4; THY4-2: THY3-4, yciQ: : Ptrc-nrdABCeco; THY4-3: THY4-2, gapC: : Ptrc-nrdABCeco; THY4-4: THY4-3, yjgX: : Ptrc-ndkeco; THY4-5: THY4-4, ycgH: : Ptrc-duteco. C: The effect of optimization thymidylate synthase on cell growth and thymidine production. The genotype of strains were THY5-1: THY4-5, ilvG: : Ptrc-tdT4; THY5-2: THY4-5, ilvG: : Ptrc-CDC21sce; THY5-3: THY4-5, ilvG: : Ptrc-thyAbsu; THY5-4: THY4-5, ilvG: : Ptrc-thyAbaz. D: The effect of optimization of 5′-nucleotidase on cell growth and thymidine production. The genotype of strains were THY6-1: THY5-3, mbhA: : Ptrc-ushAeco; THY6-2: THY5-3, mbhA: : Ptrc-TMPase; THY6-3: THY5-3, yeeP: : Ptrc-TMPase. The * represents 0.01 < P < 0.05, and the ** represents P < 0.01. |
| |
为了进一步优化异源pyrHbsuD90A基因的转录表达,本研究采用PT7强启动子控制pyrHbsuD90A表达,同样将其整合至THY2菌株的ybeM基因位点,构建了THY3-3菌株。摇瓶发酵结果显示,与THY3-1菌株相比,THY3-3菌株中胸苷产量未见显著变化(图 4A)。随后,为了进一步强化异源pyrHbsuD90A基因的表达,本研究将Ptrc启动子控制的pyrHbsuD90A基因整合至THY3-1菌株基因组中的ygaY基因位点,构建了THY3-4菌株。摇瓶发酵结果显示,与THY3-1菌株相比,THY3-4菌株中胸苷产量为0.35 g/L,较对照菌株提高了12.9%;尿苷产量为0.02 g/L,较对照菌株降低了96.2% (图 4A)。发酵数据表明,优化异源尿苷酸激酶表达可以显著提升胸苷合成效率。但是,THY3-4菌株中前体尿苷转化为胸苷的比例仍较低,推测可能是从尿苷到胸苷仍存在尚未打通的代谢流节点,同时还可能是其他前体物如甲基供应不足等限制了胸苷合成。因此,强化UDP至胸苷合成途径代谢通量是进一步提高胸苷合成效率的关键。
2.3.2 核糖核苷二磷酸还原酶的优化表达二磷酸尿苷(UDP)可以通过多种途径生成三磷酸脱氧尿苷(deoxyuridine triphosphated, UTP),其中常见的有两条:一条是由核糖核苷二磷酸还原酶(由nrd基因编码)和核苷二磷酸激酶(由ndk基因编码)通过脱羟基和磷酸化两步反应生成dUTP;另一条是由核苷二磷酸激酶(由ndk基因编码)、CTP合酶(由pyrG基因编码)、核糖核苷二磷酸还原酶(由nrd基因编码)、dCTP脱氨酶(由dcd基因编码)通过繁杂的胺化去胺化,磷酸化去磷酸化和脱羟基反应生成dUTP。尽管第2条反应途径较长,但是细胞内70%−80%的dUTP由该途径合成[19]。
作为DNA合成的关键反应之一,过表达nrdABC能够使UDP更多地流向胸苷合成途径而不是胞苷合成途径。为了减少碳流无益消耗,本研究分别将来源于T4噬菌体[4]和大肠杆菌本源的nrdABC基因引入THY3-4菌株基因组中的yciQ基因位点,使用Ptrc启动子控制,分别构建了THY4-1和THY4-2菌株。摇瓶发酵结果显示,与对照THY3-4菌株相比,THY4-2菌株中胸苷产量为1.00 g/L,较对照提高了185.7%,且未对菌株生长表型造成不利影响(图 4B)。THY4-1菌株中胸苷产量较对照菌株相比未见明显变化(图 4B),该结果与先前的研究[3]不一致,可能是由于T4噬菌体来源的核糖核苷二磷酸还原酶在大肠杆菌中底物亲和力较差。随后,为了进一步强化nrdABCeco基因的表达,本研究将Ptrc启动子控制的nrdABCeco基因整合至THY4-2菌株基因组中的gapC基因位点,构建了THY4-3菌株。发酵结果显示,与对照THY4-2菌株相比,THY4-3菌株胸苷产量为1.11 g/L,较对照菌株提升了11.0%,且OD600值为70.8 (图 4B)。发酵数据表明,强化核糖核苷二磷酸还原酶表达可以显著提升胸苷合成效率。
2.3.3 核苷二磷酸激酶和dUTP二磷酸酶的强化表达核苷二磷酸激酶(由ndk基因编码)催化五磷酸脱氧尿苷(deoxyuridine pentaphosphate, dUDP)转化为三磷酸脱氧尿苷(dUTP),dUTP二磷酸酶(由dut基因编码)催化dUTP转化为一磷酸脱氧尿苷(dUMP)。为了消除胸苷下游合成途径的限制,将dUDP转化为dUMP,本研究迭代强化ndk和dut的表达:将Ptrc启动子控制的大肠杆菌本源的ndk基因整合至THY4-3菌株基因组的yjgX基因位点,构建了THY4-4菌株;进一步将大肠杆菌本源的dut基因整合至THY4-4菌株基因组的ycgH基因位点,且由Ptrc启动子控制表达,构建了THY4-5菌株。摇瓶发酵结果显示(图 4B),与对照THY4-3菌株相比,THY4-4菌株胸苷产量为1.23 g/L,较对照菌株提高了10.8%,生长表型无显著变化。与对照THY4-4菌株相比,THY4-5菌株胸苷产量为1.30 g/L,较对照菌株提高了5.7%,且OD600值为72.6,较对照菌株提高3.2%。此外,与THY4-3菌株相比,THY4-4菌株的胸苷产量显著提升了17.1%。发酵数据表明迭代强化表达核苷二磷酸激酶和dUTP二磷酸酶可以将dUDP转化至dUMP,显著提高了胸苷合成效率。
2.3.4 胸苷酸合酶的强化表达胸苷酸合酶(由thyA基因编码)催化一磷酸脱氧尿苷(dUMP)和5, 10-亚甲基四氢叶酸甲基化生成胸苷酸(dTMP)和二氢叶酸。胸苷酸合酶作为dUMP合成dTMP的关键酶,在大肠杆菌中与其对应的mRNA会直接结合,受严格反馈抑制调控[20]。为了提高dUMP合成dTMP的代谢通量,本研究采用蛋白预测软件筛选来源不同宿主的胸苷酸合酶(国家微生物科学数据中心登录号:NMDCX0000277)。依据前期研究[6]与蛋白预测结果,本研究将来源于噬菌体(phage) T4、酿酒酵母(Saccharomyces cerevisiae) S288c、B. subtilis 168和解淀粉芽孢杆菌(Bacillus amyloliquefaciens) TA208菌株中的胸苷酸合酶引入THY4-5菌株的ilvG基因位点,并用Ptrc启动子控制,分别构建了THY5-1、THY5-2、THY5-3和THY5-4菌株。摇瓶发酵结果显示,与对照THY4-5菌株相比,THY5-2和THY5-3菌株中胸苷产量分别为1.57 g/L、1.63 g/L,较对照菌株分别提高了20.7%、25.4% (图 4C)。此外,与对照THY4-5菌株相比,THY5-1菌株中胸苷产量未见显著变化,且OD600值较对照菌株下降了10.7%,推测可能是酶的无义表达造成了生长负担;THY5-4菌株中胸苷产量和OD600值较对照菌株分别下降了4.6%和15.7%,推测可能是异源同工酶的酶活过高引起中间产物积累,造成了局部代谢阻遏,扰乱胞内代谢平衡。发酵数据表明,异源B. subtilis胸苷酸合酶的表达可以有效地提高菌株合成胸苷的效率。
2.3.5 5′-核苷酸酶的强化表达5′-核苷酸酶是催化胸苷酸水解生成胸苷的关键酶。参与该步反应的酶(由ushA、umpH、umpG、yfbR、yjjG基因编码)对于大多数嘧啶或嘌呤核苷的生成都能够起到同样的催化作用,可以催化尿苷酸生成尿苷、胞苷酸生成胞苷,催化肌苷酸生成肌苷、腺苷酸生成腺苷等。但该酶的底物特异性不佳,对于胸苷酸偏好性差。
为了评估不同来源的5′-核苷酸酶对于胸苷合成的影响,本研究分别将大肠杆菌本源的ushA基因[4]和枯草芽孢杆菌噬菌体PBS的TMPase基因[8]整合至THY5-3菌株基因组中的mbhA基因位点,并用Ptrc启动子控制,构建了THY6-1和THY6-2菌株。摇瓶发酵结果显示,与对照THY5-3菌株相比,THY6-2菌株的OD600值为75.3,胸苷产量1.80 g/L,较对照菌株胸苷产量提升10.4%,生物量提升7.9% (图 4D)。THY6-1菌株的OD600值73.5,胸苷产量1.64 g/L,与对照菌株无显著差别(图 4D)。发酵结果表明,过表达噬菌体PBS来源的TMPase基因可以显著提高胸苷合成效率。为了进一步优化异源5′-核苷酸酶表达,本研究将Ptrc启动子控制的异源TMPase基因整合至THY6-2菌株基因组中的yeeP基因位点,构建了THY6-3菌株。发酵结果显示,与对照THY6-2菌株相比,THY6-3菌株OD600值70.2,较对照菌株下降了6.7%;胸苷产量为1.50 g/L,较对照菌株下降了16.7% (图 4D)。发酵数据表明单拷贝TMPase基因已能够满足当前菌株胸苷合成代谢需求,过量的TMPase表达会导致代谢负担。
2.4 分批补料发酵生产胸苷为了进一步测试THY6-2菌株的生产性能,本研究在5 L生物反应器中进行了分批补料发酵试验,并实时检测发酵过程pH、溶氧、葡萄糖消耗量等发酵参数。发酵结果显示,THY6-2菌株在10 h后进入快速生长阶段,28 h后进入稳定生长期,40 h菌体生物量达到最高值。发酵10 h后,胸苷快速积累,发酵48 h胸苷产量为11.10 g/L,葡萄糖转化率为0.04 g/g葡萄糖,生产强度为0.23 g/(L·h) (图 5)。

|
| 图 5 工程菌THY6-2在5 L发酵罐中的分批补料发酵曲线 Fig. 5 Fed-batch fermentation profiles of the engineered strain THY6-2 in 5 L bioreactor. |
| |
嘧啶核苷及其衍生物具有抗菌[21]、抗病毒[22]和治疗肿瘤[23]的作用,在医药行业广泛应用。现阶段,开发廉价且高效的胸苷生产方法成为满足胸苷市场需求的关键。大肠杆菌具有基因编辑效率高、遗传背景清晰、发酵周期短等优势,是构建高效胸苷生产微生物细胞工厂的优良底盘微生物。本研究以野生型E. coli MG1655为出发菌株,采用系统代谢工程策略优化胸苷从头合成途径代谢通量分布,构建了高效合成胸苷的工程菌株。
首先,本研究阻断了胸苷降解途径和回补途径,失活胸苷磷酸化酶和核苷水解酶可以有效阻断胸苷向胸腺嘧啶转化;失活胸苷激酶可以阻断胸苷磷酸化为dTMP;失活尿苷磷酸化酶可以阻断尿苷和胸苷向相应的嘧啶和(脱氧)核糖- 1-磷酸的裂解。其次,增强了前体UMP供应,引入B. subtilis F126中pyr操纵子基因,解除反馈抑制,增强了前体物UMP合成途径代谢通量。最后,对胸苷合成模块的4个关键酶进行表达优化,发现来源于B. subtilis的尿苷酸激酶突变体可以强而有效地将尿苷的代谢通量导向胸苷的合成途径之中;过表达E. coli自身的核糖核苷二磷酸还原酶,避免了代谢通量在胞苷途径的消耗,使胸苷产量增加了2.7倍,显著提高了胸苷的积累;通过蛋白预测,对胸苷酸合酶催化的甲基化反应进行多来源同工酶的异源表达测试,筛选到来源B. subtilis菌株的胸苷酸合酶可以显著促进胸苷产量提高25.4%;最后,本研究引入来源枯草芽孢杆菌噬菌体PBS的胸苷酸水解酶(由TMPase基因编码)以强化胸苷酸脱磷酸化生成胸苷,使胸苷产量显著提高至1.80 g/L。
本研究中的重编程策略主要集中在理性代谢工程改造,平衡细胞内氧化还原平衡和改变辅因子水平可能是进一步提高胸苷生产的方法,还需进一步探究。在胸苷的合成途径中,存在两步酶催化反应消耗辅因子NADPH,即二磷酸尿苷(UDP)还原为二磷酸脱氧尿苷(dUDP)和一磷酸脱氧尿苷(dUMP)到胸苷酸(dTMP)的甲基循环中二氢叶酸向四氢叶酸的转化。在大肠杆菌中,可以通过吡啶核苷酸转氢酶,即膜结合转氢酶(PntAB)和可溶性转氢酶(UdhA),来维持胞内NADH和NADPH之间的平衡,维持代谢系统的还原当量池、保护细胞免受损害。同样地,强化磷酸戊糖途径中NADP+依赖性葡萄糖-6-磷酸脱氢酶(Zwf)、应激反应因子(stress response factors, RpoS)和大肠杆菌噬菌体休克蛋白A (PspA)的表达,也有助于减轻细胞的应激反应。
与现有报道的胸苷生产菌株相比(表 2),THY6-2菌株发酵周期为48 h,胸苷生产强度为0.23 g/(L·h),是E. coli HLT026菌株的1.1倍,较报道菌株具有明显优势,本研究为大肠杆菌高效合成胸苷的合成生物学研究提供了优异的底盘菌株。
| [1] |
FURMAN PA, FYFE JA, ST CLAIR MH, WEINHOLD K, RIDEOUT JL, FREEMAN GA, LEHRMAN SN, BOLOGNESIDP, BRODER S, MITSUYA H. Phosphorylation of 3′-azido-3′-deoxythymidine and selective interaction of the 5′-triphosphate with human immunodeficiency virus reverse transcriptase[J]. Proceedings of the National Academy of Sciences of the United States of America, 1986, 83(21): 8333-8337.
|
| [2] |
REESE CB, SANGHVI YS. Conversion of 2′-deoxyuridine into thymidine and related studies[J]. Journal of the Chemical Society, Chemical Communications, 1983(16): 877-879.
|
| [3] |
LEE HC, KIM JH, KIM JS, JANG W, KIM SY. Fermentative production of thymidine by a metabolically engineered Escherichia coli strain[J]. Applied and Environmental Microbiology, 2009, 75(8): 2423-2432. DOI:10.1128/AEM.02328-08
|
| [4] |
李思梦, 李晓静, 陈涛. 代谢工程方法改造大肠杆菌生产胸苷[J]. 生物工程学报, 2015, 31(1): 105-114. LI SM, LI XJ, CHEN T. Metabolic engineering of Escherichia coli for thymidine production[J]. Chinese Journal of Biotechnology, 2015, 31(1): 105-114 (in Chinese). |
| [5] |
BECKER J, KLOPPROGGE C, ZELDER O, HEINZLE E, WITTMANN C. Amplified expression of fructose 1, 6-bisphosphatase in Corynebacterium glutamicum increases in vivo flux through the pentose phosphate pathway and lysine production on different carbon sources[J]. Applied and Environmental Microbiology, 2005, 71(12): 8587-8596. DOI:10.1128/AEM.71.12.8587-8596.2005
|
| [6] |
KIM JS, JEONG MK, KOO BS, LEE HC. Development of a novel plasmid-free thymidine producer by reprogramming nucleotide metabolic pathways[J]. Applied and Environmental Microbiology, 2015, 81(22): 7708-7719. DOI:10.1128/AEM.02031-15
|
| [7] |
WU HY, LI YJ, MA Q, LI Q, JIA ZF, YANG B, XU QY, FAN XG, ZHANG CL, CHEN N, XIE XX. Metabolic engineering of Escherichia coli for high-yield uridine production[J]. Metabolic Engineering, 2018, 49: 248-256. DOI:10.1016/j.ymben.2018.09.001
|
| [8] |
LEE HC, AHN JM, LEE SN, KIM JH. Overproduction of thymidine by recombinant Brevibacterium helvolum amplified with thymidine monophosphate phosphohydrolase gene from bacteriophage PBS2[J]. Biotechnology Letters, 2004, 26(4): 265-268. DOI:10.1023/B:BILE.0000015423.83278.e2
|
| [9] |
ZHU H, YANG SM, YUAN ZM, BAN R. Metabolic and genetic factors affecting the productivity of pyrimidine nucleoside in Bacillus subtilis[J]. Microbial Cell Factories, 2015, 14: 54. DOI:10.1186/s12934-015-0237-1
|
| [10] |
LEE HC, KIM JS, JANG W, KIM SY. High NADPH/NADP+ ratio improves thymidine production by a metabolically engineered Escherichia coli strain[J]. Journal of Biotechnology, 2010, 149(1/2): 24-32.
|
| [11] |
FAN XG, WU HY, LI GL, YUAN H, ZHANG HC, LI YJ, XIE XX, CHEN N. Improvement of uridine production of Bacillus subtilis by atmospheric and room temperature plasma mutagenesis and high-throughput screening[J]. PLoS One, 2017, 12(5): e0176545. DOI:10.1371/journal.pone.0176545
|
| [12] |
LI YF, LIN ZQ, HUANG C, ZHANG Y, WANG ZWTANG YJ, CHEN T, ZHAO XM. Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J]. Metabolic Engineering, 2015, 31: 13-21. DOI:10.1016/j.ymben.2015.06.006
|
| [13] |
PIÉRARD A, GLANSDORFF N, GIGOT D, CRABEEL M, HALLEUX P, THIRY L. Repression of Escherichia coli carbamoylphosphate synthase: relationships with enzyme synthesis in the arginine and pyrimidine pathways[J]. Journal of Bacteriology, 1976, 127(1): 291-301. DOI:10.1128/jb.127.1.291-301.1976
|
| [14] |
SCHWARTZ M, NEUHARD J. Control of expression of the pyr genes in Salmonella typhimurium: effects of variations in uridine and cytidine nucleotide pools[J]. Journal of Bacteriology, 1975, 121(3): 814-822. DOI:10.1128/jb.121.3.814-822.1975
|
| [15] |
PAULUS TJ, SWITZER RL. Characterization of pyrimidine-repressible and arginine-repressible carbamyl phosphate synthetases from Bacillus subtilis[J]. Journal of Bacteriology, 1979, 137(1): 82-91. DOI:10.1128/jb.137.1.82-91.1979
|
| [16] |
YANG K, LI ZM. Multistep construction of metabolically engineered Escherichia coli for enhanced cytidine biosynthesis[J]. Biochemical Engineering Journal, 2020, 154: 107433. DOI:10.1016/j.bej.2019.107433
|
| [17] |
QUINN CL, STEPHENSON BT, SWITZER RL. Functional organization and nucleotide sequence of the Bacillus subtilis pyrimidine biosynthetic operon[J]. The Journal of Biological Chemistry, 1991, 266(14): 9113-9127. DOI:10.1016/S0021-9258(18)31559-X
|
| [18] |
ASAHI S, TSUNEMI Y, DOI M. Improvement of a cytidine-producing mutant of Bacillus subtilis introducing a mutation by homologous recombination[J]. Bioscience, Biotechnology, and Biochemistry, 1995, 59(11): 2123-2126. DOI:10.1271/bbb.59.2123
|
| [19] |
JOHANSSON E, THYMARK M, BYNCK JH, FANØ M, LARSEN S, WILLEMOËS M. Regulation of dCTP deaminase from Escherichia coli by nonallosteric dTTP binding to an inactive form of the enzyme[J]. The FEBS Journal, 2007, 274(16): 4188-4198. DOI:10.1111/j.1742-4658.2007.05945.x
|
| [20] |
VOELLER DM, CHANGCHIEN LM, MALEY GF, MALEY F, TAKECHI T, TURNER RE, MONTFORT WR, ALLEGRA CJ, CHU E. Characterization of a specific interaction between Escherichia coli thymidylate synthase and Escherichia coli thymidylate synthase mRNA[J]. Nucleic Acids Research, 1995, 23(5): 869-875. DOI:10.1093/nar/23.5.869
|
| [21] |
董金娇, 朱昕悦, 冯思冉, 张超超, 刘振明, 乔晓强, 宋亚丽. 7-苯基-6H, 7H-1, 3, 4-噻二唑并[3, 2-a]-硫色烯并[4, 3-d]嘧啶类化合物的合成及抗真菌活性研究[J]. 有机化学, 2021, 41(6): 2467-2475. DONG JJ, ZHU XY, FENG SR, ZHANG CC, LIU ZM, QIAO XQ, SONG YL. Synthesis and antifungal activity of 7-phenyl-6H, 7H-1, 3, 4-thia-diazolo[3, 2-a]- thiochromeno[4, 3-d]pyrimidine compounds[J]. Chinese Journal of Organic Chemistry, 2021, 41(6): 2467-2475 (in Chinese). |
| [22] |
罗云龙, 沈明贵, 蔡照胜, 商士斌, 宋湛谦. 脱氢枞酸酰胺基-3, 4-二氢嘧啶酮衍生物的合成与抗病毒活性研究[J]. 林产化学与工业, 2019, 39(2): 46-52. LUO YL, SHEN MG, CAI ZS, SHANG SB, SONG ZQ. Synthesis and antiviral activity evaluation of dehydroabietic acid amide derived 3, 4-dihydropyrimidinthiones[J]. Chemistry and Industry of Forest Products, 2019, 39(2): 46-52 (in Chinese). |
| [23] |
ISLAM F, QUADERY TM, BAI RL, LUCKETT-CHASTAIN LR, HAMEL E, IHNAT MA, GANGJEE A. Novel pyrazolo[4, 3-d]pyrimidine microtubule targeting agents (MTAs): synthesis, structure-activity relationship, in vitro and in vivo evaluation as antitumor agents[J]. Bioorganic & Medicinal Chemistry Letters, 2021, 41: 127923.
|
| [24] |
KOO BS, HYUN HH, KIM SY, KIM CH, LEE HC. Enhancement of thymidine production in E. coli by eliminating repressors regulating the carbamoyl phosphate synthetase operon[J]. Biotechnology Letters, 2011, 33(1): 71-78. DOI:10.1007/s10529-010-0413-7
|