熊果苷的生物合成研究进展
张雨捷
,
石曈
,
王佳
,
孙新晓
,
申晓林
,
袁其朋
生物工程学报  2024, Vol. 40 2024, Vol. 40 Issue (8): 2457-2472 Issue (8): 2457-2472 |

熊果苷(arbutin),又名熊果素,其化学式为C12H16O7,是一种氢醌(hydroquinone, HQ)的糖苷化合物。熊果苷能够通过抑制酪氨酸酶的活性阻止黑色素的合成,从而达到美白的效果,同时它还具有抗氧化、抗菌、抗炎症、抗肿瘤等药理活性,被用于治疗尿路感染、皮肤色素过度沉着以及肠道消炎等[1-3]。一些研究表明,熊果苷还能通过诱导线粒体断裂以及干扰RNA和蛋白质合成,抑制癌细胞的生长、增殖,因此在抗癌领域具有临床应用的潜力[4-5]。目前,熊果苷已被广泛应用于化妆品及医药领域。根据糖苷键构型的区别,熊果苷被分为β-熊果苷(对-羟基苯-β-d-吡喃葡萄糖苷)和α-熊果苷(对-羟基苯-α-d-吡喃葡萄糖苷),β-熊果苷的旋光度为–60°,α-熊果苷的旋光度为180°,它们的分子结构如图 1所示。

|
| 图 1 熊果苷的生物合成方法 Fig. 1 Biosynthesis of arbutin by using different methods. pHBA: p-hydroxybenzoic acid; HQ: hydroquinone; MNX1 encodes 4-hydroxybenzoate 1-hydroxylase; AS encodes arbutin synthase. |
| |
β-熊果苷是植物来源的天然产物,在菊科、杜鹃花科、山龙眼科以及蔷薇科植物体内均有不同含量的β-熊果苷[6-7]。1852年,Kawalier[8]在熊果叶(Arctostaphylos uva-ursi)中分离得到β-熊果苷;1858年,Strecker[9]将β-熊果苷水解后得到葡萄糖和HQ,由此确定了β-熊果苷的分子组成以及分子式;1912年,Mannich[10]以HQ和葡萄糖为起始底物经多步化学反应首次合成β-熊果苷;1952年,Tatsuo等[11]利用化学法首次合成非天然产物α-熊果苷,但化学法合成熊果苷受限于反应条件严苛、立体选择性差、废气废物生成量大及工业化困难等问题。不同于非天然产物α-熊果苷,天然产物β-熊果苷能够通过植物提取法获得,但植物提取法存在植物生长周期长、体内含量分布不均、易受环境气候影响、提取过程繁琐且得率低的缺点[11-14]。
近年来,生物合成法在天然产物合成方面取得了诸多成果,生物合成熊果苷也成为研究的热点,并取得较多进展。本文将目前应用于生物合成熊果苷的方法总结为以下4种:植物转化法、酶催化法、全细胞催化法以及微生物发酵法(图 1),并对这4种方法展开综述,总结了生物合成熊果苷的研究过程与最新进展,并分别对这4种生物合成方式进行分析讨论,对生物合成熊果苷领域进行了思路总结与方法探讨,对未来有效开展更为清洁、环保、成本低廉的熊果苷生物合成方法进行展望。
1 植物转化法一些应用于药物、香料、色素的天然产物本身就来源于植物,因此,除了通过植物提取法获得这些天然产物,对植物的细胞、组织或器官进行体外培养,并作为生物催化剂对添加的底物进行转化也是一种获得目标天然产物的方式。相较于植物提取法,植物转化技术不易受到气候、环境、原材料供给的影响,因而成为生物合成熊果苷的一种具有应用前景的方法[15-16] (表 1)。目前,被应用于合成β-熊果苷的主要方法是植物细胞悬浮培养法和植物组织转化法。
| Source | HQ (g/L) | Conversion (%) | Titer (g/L) | References |
| Cell suspensions of Capsicum annuum L. | 1.7 | 13.1 | 0.56 | [17] |
| Cell suspensions of Catharanthus roseus | 3.8 | 98.0 | 9.20 | [18] |
| Cell suspensions of Rauvolfia serpentina | 8.8 | 83.0 | 18.00 | [19] |
| Hairy roots of Polygonum multi florum | 1.1 | 81.5 | 2.22 | [20] |
| Crown gall of Panax quinquefolium | 0.3 | 88.4 | 0.66 | [21] |
1976年,Tabata等[22]首次报道了曼陀罗(Datura innoxia)的悬浮培养物能够将HQ转化为β-熊果苷。在该研究中,向处于指数生长后期的曼陀罗细胞悬浮培养物中添加HQ,连续孵育3 d后对产物进行测定,鉴定产物为β-熊果苷,且β-熊果苷以晶体形式存在于细胞内而非培养基中。该研究证明,在合成β-熊果苷的糖基化反应中,尿苷二磷酸葡萄糖(uridine diphosphate glucose, UDPG)是β-熊果苷的糖基供体,为后续生物合成β-熊果苷提供了研究基础。该研究同时也证实了HQ具有细胞毒性,通过探究HQ的最适添加时间,发现在指数期添加HQ可缓解细胞的生长抑制,相较于生长后期添加HQ,β-熊果苷的产量更高。由于底物HQ的细胞毒性对β-熊果苷的生产有负面影响,有文献研究了适合细胞生长与产物生产的HQ添加量及添加方式,并尝试了利用不同方式缓解细胞毒性。Yokoyama等[23]使用长春花(Catharanthus roseus)细胞悬浮培养物合成β-熊果苷,结果表明,高浓度的糖可以缓解HQ的细胞毒性影响。Inomata等[18]使用细胞群体密度与指数生长后期相当的长春花细胞作为催化剂,以分批补料的方式添加HQ,最终在5 L发酵罐中生产了9.2 g/L β-熊果苷。Lutterbach等[19]使用高密度的蛇根木(Rauvolfia serpentina)细胞悬浮培养物对HQ进行转化,培养7 d后,β-熊果苷产量达到18.00 g/L。
除了通过植物细胞悬浮培养的方式进行HQ的糖基化反应之外,一些植物组织同样可以转化HQ,合成β-熊果苷。严春艳等[20]通过诱导筛选得到了适宜悬浮培养的何首乌(Polygonum multi florum)毛状根作为生物催化剂,实现了HQ向β-熊果苷的生物转化。在确定最优的底物添加和共培养时间后,通过添加1.1 g/L HQ,培养72 h获得2.22 g/L的β-熊果苷,HQ转化率为81.5%。张章等[21]向预培养20 d的西洋参(Panax quinquefolium)冠瘿组织培养物中加入300 mg/L HQ共培养60 h后,检测到培养物中β-熊果苷产量为655.5 mg/L,转化率达到88.4%。
由上述研究可知,利用植物转化法可在植物体内催化糖基化反应的酶未知的情况下,直接利用植物细胞或组织作为生物催化剂,通过优化培养条件实现HQ向熊果苷的高效转化。但由于HQ细胞毒性及易氧化等问题,该方法难以进一步扩大生产。同时,植物细胞、组织的培养条件苛刻、周期长、成本高昂以及产物分离纯化困难也限制了植物转化法在工业化生产中的应用。[12, 16]
2 酶催化法与β-熊果苷不同,非天然产物α-熊果苷无法通过植物提取或植物转化得到。研究表明,α-熊果苷对酪氨酸酶的抑制作用比β-熊果苷强10倍[3],因此,α-熊果苷的合成受到广泛关注。近年来,不同微生物来源的糖基转移酶被鉴定出可以催化HQ的糖基化反应生成α-熊果苷。酶催化法因其催化条件简单、耗时短等优势,成为合成熊果苷的研究热点。目前,有7类不同微生物来源的酶被用于α-熊果苷的生物合成。如图 2所示,蔗糖磷酸化酶(sucrose phosphorylase)、α-淀粉酶(α-amylase)、环糊精糖基转移酶(cyclodextrin glycosyltransferase)、α-葡萄糖苷酶(α-glucosidase)、葡聚糖蔗糖酶(dextransucrase)、淀粉蔗糖酶(amylosucrase)和蔗糖异构酶(sucrose isomerase)都可利用HQ为底物,使用不同的糖基供体如蔗糖、麦芽糖等,将HQ糖基化,生成α-熊果苷[24],酶催化法合成α-熊果苷的总结如表 2所示。
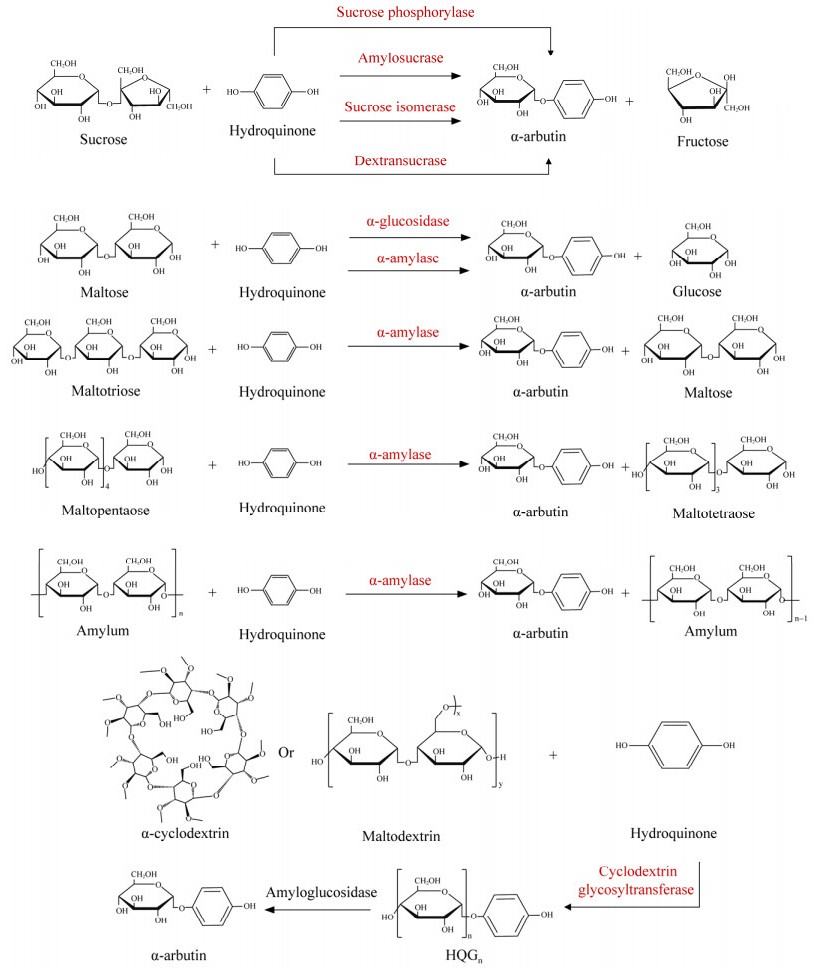
|
| 图 2 不同酶催化合成α-熊果苷 Fig. 2 Synthesis of α-arbutin by using different enzymes. |
| |
| Enzyme | Microbial source | Donor | Donor: HQ ratio | Conversion (%) | References |
| Sucrose phosphorylase | Leuconostoc mesenteroides | Sucrose | 10:1 | 46.5 | [25] |
| Sucrose | 20:1 | 65.0 | [25] | ||
| Sucrose | 4:1 | 78.3 | [26] | ||
| Sucrose | 5:1 | 99.0 | [27] | ||
| Dextransucrase | Leuconostoc mesenteroides | Sucrose | 2:1 | 0.4 | [28] |
| Sucrose isomerase | Erwinia rhapontici | Sucrose | 20:1 | 33.2 | [29] |
| Amylosucrase | Deinococcus geothermalis | Sucrose | 1:1 | 1.3 | [30] |
| Sucrose | 10:1 | 90.0* | [30] | ||
| Cellulomonas carboniz T26 | Sucrose | 4:1 | 44.7 | [31] | |
| α-amylase | Bacillus subtilis X-23 | Maltose | 2:1 | 9.0 | [32] |
| Maltotriose | 2:1 | 22.4 | [32] | ||
| Maltopentaose | 2:1 | 24.8 | [32] | ||
| Soluble starch | 2:1 | 32.4 | [32] | ||
| Cyclodextrin glycosyltransferase | Thermoanaerobacter | α-cyclodextrin | 6:1 | 23.3 | [33] |
| Maltodextrin | 31:1 | 21.7 | [33] | ||
| α-glucosidase | Xanthomonas campestris WU-9701 | Maltose | 27:1 | 55.6 | [34] |
| Saccharomyces cerevisiae | Maltose | 167:1 | 13.0 | [35] | |
| Maltose | 30:1 | 4.6 | [35] | ||
| *: Add 0.035 g/L ascorbic acid. | |||||
在这7类酶中,蔗糖磷酸化酶、葡聚糖蔗糖酶、蔗糖异构酶和淀粉蔗糖酶均以蔗糖为糖基供体进行α-熊果苷的合成。其中,蔗糖磷酸化酶(EC 2.4.1.7)是最早被报道用于酶催化反应合成α-熊果苷的酶。1994年,Kitao等[25]研究了肠膜明串珠菌(Leuconostoc mesenteroides)来源的蔗糖磷酸化酶对若干醌类化合物的转糖基作用,当添加500 g/L蔗糖与10 g/L HQ作为底物时,2 g HQ被消耗生成2.3 g纯化产物,HQ转化率为46.5%,该纯化产物被鉴定为单一的α-熊果苷;在对蔗糖和HQ的添加比例进行调整后,蔗糖浓度为50%时该酶对HQ的转化率达到65.0%。李晓玉等[27]将肠膜明串珠菌的蔗糖磷酸化酶基因进行密码子优化后在大肠杆菌(Escherichia coli)中异源表达,添加40 g/L HQ,且蔗糖与HQ的摩尔比为5:1时,α-熊果苷产量达到98 g/L,HQ转化率接近99.0%。这些数据表明,来自肠膜明串珠菌的蔗糖磷酸化酶能够高效地将HQ转化为α-熊果苷,为α-熊果苷生物合成提供了新方法。Seo等[28]探究了利用其他种类的酶来生产α-熊果苷,研究发现同样是来自肠膜明串珠菌的葡聚糖蔗糖酶(EC 2.4.1.5),也可用于酶催化反应合成α-熊果苷,但添加49.5 g/L HQ和73.7 g/L蔗糖,仅生成了0.54 g/L α-熊果苷,HQ转化率仅为0.4%,证明该酶并不适用于生产熊果苷。Zhou等[29]探究了大黄欧文氏菌(Erwinia rhapontici)的蔗糖异构酶(EC 5.4.99.11)催化HQ生产α-熊果苷,并对其催化口袋进行改造,突变体F321W对HQ的转化率由33.2%提升至88.2%。Seo等[30]在大肠杆菌中表达并纯化了来自地热球菌(Deinococcus geothermalis)的淀粉蔗糖酶(EC 2.4.1.4),并以蔗糖和HQ为底物进行转糖基反应,鉴定产物为α-熊果苷;但是由于HQ极易氧化造成底物大量浪费,在未添加抗氧化剂的情况下,蔗糖与HQ摩尔比为1:1进行添加实验时,HQ转化率较低,仅为1.3%,为了解决HQ的氧化问题,该研究额外添加了抗坏血酸作为抗氧化剂,当抗坏血酸浓度达到HQ浓度的10%时,该反应HQ转化率达到55.0%,显示了抗氧化剂在酶催化合成α-熊果苷中的积极作用;而后,通过优化底物的添加比例,当添加0.035 g/L抗坏血酸时,蔗糖与HQ的摩尔比为10:1,HQ的转化率提高至90.0%。
除了以蔗糖作为糖基供体,可溶性淀粉、α-环糊精、麦芽糊精、麦芽糖、麦芽三糖以及麦芽五糖也可作为糖基供体实现α-熊果苷的酶催化合成。Nishimura等[32]首次报道了枯草芽孢杆菌(Bacillus subtilis) X-23的α-淀粉酶(EC 3.2.1.1)在酶催化合成α-熊果苷中的作用;该酶以HQ为糖基受体,分别以麦芽糖、麦芽三糖、麦芽五糖和可溶性淀粉为糖基供体,在酶的催化下合成α-熊果苷,HQ转化率分别为9.0%、22.4%、24.8%和32.4%,显示了该酶的底物杂泛性,为α-熊果苷的生产提供了更多底物和方法。类似地,Mathew等[33]以嗜热厌氧杆菌属(Thermoanaerobacter)中的环糊精糖基转移酶(EC 2.4.1.19)催化HQ的糖基化反应,在以α-环糊精和麦芽糖精作为糖基供体时,能生产包含α-熊果苷在内的HQ糖基化产物混合物,其中α-熊果苷的转化率分别为23.3%和21.7%,进一步与淀粉葡萄糖苷酶(amyloglucosidase)联用,将混合糖基化产物水解获得单一产物α-熊果苷。
Sato等[34]纯化表征了WU-9701中的糖基转移酶,鉴定为α-葡萄糖苷酶(EC 3.2.1.20),在该酶的催化下,以麦芽糖作为糖基供体,HQ可以被转化为α-熊果苷,转化率为55.6%。该研究为利用麦芽糖作为底物生产熊果苷提供了更高效的酶,并展示了该酶良好的应用前景。
以上研究可以证明,以HQ作为底物,催化转糖基作用合成α-熊果苷的酶来源广泛且类型多样,不同的酶在不同反应条件下(如糖基供体、反应温度、反应时间等),生产α-熊果苷的能力具有较大差异[15]。但是,大部分酶对2种底物的最适浓度比例有较为严格的要求。这些酶需要非常高的糖基供体浓度,不仅造成了糖基供体的严重浪费,还产生了大量的剩余单糖(如果糖或葡萄糖)作为副产物,增加成本的同时还导致了分离纯化困难。最重要的是,体外酶催化的生产方式需要对酶进行分离纯化或固定化来保持酶的活性及可重复利用性,工艺复杂、成本较高。这些问题都影响了酶催化法在工业化中的进一步应用,为了解决这些问题,研究者们尝试利用全细胞催化法生产熊果苷。
3 全细胞催化法全细胞催化法同样是α-熊果苷的主要合成方式之一。相较于酶催化的生产方式,该方法不需要破碎细胞以及对酶进行分离纯化,而是将表达关键酶的微生物进行培养,将培养至一定浓度后的细胞进行收集、洗涤、重悬等处理后,直接作为生物催化剂加入反应体系进行催化,解决了纯化过程复杂、成本高,酶体外催化活性较低的问题,具有转化率高、产量稳定、易于扩大培养等优点(表 3)。
| Host | Enzyme | Donor | HQ (g/L) | Conversion (%) | Titer (g/L) | References |
| Xanthomonas campestris WU-9701 | – | 411 g/L maltose | 5 | 93.0 | 11.0 | [36] |
| Escherichia coli | α-glucosidase from Xanthomonas campestris BCRC12846 | 411 g/L maltose | 11 | 83.0 | 23.0 | [37] |
| Escherichia coli | Amylosucrase from X. campestris pv. campestris ATCC 33913 | 321 g/L maltose | 26 | 95.5 | 60.9 | [38] |
| Xanthomonas maltophilia BT-112 | – | 174 g/L sucrose | 28 | 95.2 | 65.9 | [39] |
| Escherichia coli | Amylosucrase from Xanthomonas campestris pv. campestris 8004 | 410 g/L sucrose | 35 |
95.0 | 83.3 | [40] |
| 547 g/L sucrose | 63 | 95.0 | 147.0 | [41] | ||
| 329 g/L sucrose | 46 | 95.0 | 108.4 | [41] | ||
| Bacillus subtilis | Sucrose phosphorylase from Streptococcus mutans | 250 g/L sucrose | 50 | 96.6 | 119.4 | [42] |
| Bacillus subtilis | Sucrose phosphorylase from Leuconostoc mesenteroides | 800 g/L sucrose | 55 | 95.3 | 129.6 | [43] |
2002年,Kurosu等[36]首次以冻干的野油菜黄单胞菌WU-9701细胞作为生物催化剂,在40 ℃下反应36 h,将5 g/L HQ和411 g/L麦芽糖转化为11 g/L α-熊果苷,HQ转化率为93%。为了进一步提高产量,Wu等[37]将野油菜黄单胞菌BCRC12608截短的冰核蛋白与产生α-熊果苷的转糖苷酶融合得到的重组蛋白引导至大肠杆菌细胞表面;以改造后的大肠杆菌作为生物催化剂,加入11 g/L的HQ及411 g/L的麦芽糖,在40 ℃反应1 h后,产生23 g/L的α-熊果苷,HQ转化率为83%;而在相同条件下,使用野生型野油菜黄单胞菌BCRC12846催化得到的α-熊果苷浓度仅为4 g/L,HQ转化率为16%,该研究证明可以将糖基转移酶在其他微生物中异源表达并作为全细胞催化剂生产α-熊果苷,该方法也被普遍应用于后续研究中。
然而,添加过高浓度的HQ对全细胞催化剂的活性有着明显抑制作用[41]。有研究表明,在生产过程中对HQ进行分批补料并将其浓度控制在合适范围内,可有效避免由于大量添加HQ而导致的生产效率降低的问题。Yang等[38]将野油菜黄单胞菌致病变种ATCC 33913来源的淀粉蔗糖酶在大肠杆菌JM109中异源表达,将重组菌株作为生物催化剂,分别以蔗糖和HQ为底物进行全细胞催化以合成α-熊果苷;在分批补料的策略下,α-熊果苷最终产量达60.9 g/L,HQ转化率为95.5%,显示了分批补料的生产优势。类似地,Zhu等[40]表征了来源于野油菜黄单胞菌致病变种8004的淀粉蔗糖酶,将该酶在大肠杆菌BL21中异源表达,以分批补料的策略利用重组大肠杆菌进行全细胞催化,α-熊果苷产量为83.3 g/L,HQ转化率95%。Zhu等[41]进一步探究了全细胞催化的最佳条件,在50 mL体系中使用OD600为10的全细胞催化剂,以分批补料的方式添加63 g/L HQ和547 g/L蔗糖,反应18 h生产了147 g/L α-熊果苷;为了验证该方法的工业化应用潜力,该研究在5 000 L反应器中以3 500 L和4 000 L的反应体系进行全细胞催化,通过分批补料的方式将HQ浓度控制在46 g/L,α-熊果苷产量分别为108.4 g/L和102.1 g/L,HQ转化率分别为95.0%和94.5%,展现了全细催化法生产α-熊果苷在工业化上的可行性。
除了以野油菜黄单胞菌的α-葡萄糖苷酶和淀粉蔗糖酶为基础的全细胞催化,蔗糖磷酸化酶用于全细胞催化合成α-熊果苷的研究也成为近年来的热点。沈洋等[44]对变形链球菌(Streptococcus mutans)来源的蔗糖磷酸化酶进行突变改造,将底物结合口袋中柔性环结构的Ile336进行定点饱和突变,获得了催化能力更强的突变体SmSPI336L;该研究将携带编码SmSPI336L基因的质粒导入枯草芽孢杆菌WB600并进行培养,对细胞进行收集、洗涤后,重悬于包含磷酸盐缓冲液、HQ以及蔗糖的反应体系中,作为生物催化剂进行全细胞催化,α-熊果苷产量达到71.7 g/L,HQ转化率达到72.5%,而携带野生型酶的对照中,HQ转化率为50.4%;酶学性质表征结果显示,SmSPI336L的催化活性比野生型提高了1.54倍,相较于野生型,SmSPI336L与HQ结合形成了2个新的极性键,且平均键长更短,由此提升了酶与HQ结合的亲和性与稳定性。周祺等[42]将编码SmSPI336L的基因整合在枯草芽孢杆菌WB800的基因组上,使用改造后的枯草芽孢杆菌进行全细胞催化,在整合4个拷贝编码SmSPI336L的基因的情况下,使用启动子P43调控该酶的表达,α-熊果苷产量为54.05 g/L,HQ的摩尔转化率为43.7%;该团队优化了P43-SmSPI336L表达框中核糖体结合位点的序列,增强了启动子强度,从而提高了SmSPI336L的表达量,在加入50 g/L HQ、250 g/L蔗糖的情况下,α-熊果苷产量达到了119.4 g/L,HQ的摩尔转化率提高至96.6%,展示了良好的应用前景。另外,Ao等[43]对肠膜明串珠菌来源的蔗糖磷酸化酶进行突变,以解决底物通道入口较窄的问题,获得了催化活性高于野生型4.6倍的突变体LmSPR137F,并通过敲除枯草芽孢杆菌中的lytC、sdpC和skfA降低高浓度HQ对细胞的抑制作用,提高细胞稳定性;最终,在添加55 g/L HQ和800 g/L蔗糖的情况下,5 L发酵罐中α-熊果苷产量达到129.6 g/L,HQ转化率达到95.3%,同样证明将蔗糖磷酸化酶应用于全细胞催化生产α-熊果苷具有较好的工业化潜力。
在目前利用蔗糖磷酸化酶进行α-熊果苷合成的研究中,虽然HQ的摩尔转化率达到了很高的水平,但是蔗糖转化率较低,例如在Ao等[43]的研究中,蔗糖转化率仅为20%。为了达到最佳的生产能力,相比于HQ的浓度,需始终维持较高的蔗糖浓度,从而造成蔗糖的浪费,不利于控制成本。同时,在利用枯草芽孢杆菌全细胞催化生产α-熊果苷时,胞外蔗糖可以诱导分泌型左旋蔗糖酶和膜锚定型果聚糖酶的表达使部分蔗糖在胞外被水解为葡萄糖和果糖,而这2种单糖并不能直接作为糖基供体进行α-熊果苷的合成,造成蔗糖的损失。再者,外源添加的蔗糖通过磷酸转移酶系统(phosphotransferase system, PTS)进入胞内,形成蔗糖-6-磷酸在蔗糖磷酸化酶的作用下将葡萄糖基转移到HQ上合成α-熊果苷,剩余1分子果糖,同样造成了底物的浪费。为了解决蔗糖水解问题,Zhou等[45]敲除了编码蔗糖胞外水解相关酶的基因(sacB、sacC、levB),同时敲除了水解蔗糖-6-磷酸的酶(sacA)以降低蔗糖-6-磷酸在胞内的损失,将蔗糖转化率从45.0%提升至51.5%。
另一方面,为了避免蔗糖在转糖基作用后剩余的果糖被浪费,Zhou等[45]通过调控6-磷酸果糖激酶的降解以及额外整合1个拷贝的葡萄糖6-磷酸异构酶和磷酸葡萄糖变位酶,促进果糖向葡萄糖-1-磷酸(glucose-1-phosphate, G-1-P)转化,而蔗糖磷酸化酶可以G-1-P为糖基供体参与α-熊果苷的合成;最终,在添加50 g/L HQ、250 g/L蔗糖的情况下,生产了120 g/L α-熊果苷,蔗糖的转化率提升至60.4%。该方法提高了蔗糖的利用率,减少了底物的浪费。为α-熊果苷的工业化生产提供了一个降低成本的可行性策略。
综上,全细胞催化法相较于酶催化,进一步简化了工艺,降低了成本,α-熊果苷产量得到提升,并实现了5 000 L规模的放大生产。在目前的研究中,全细胞催化的转化率普遍较高,且α-熊果苷产量显著高于其他合成方式,是目前最具工业化潜力的方式之一。
4 微生物发酵法微生物发酵和全细胞催化的生物合成方式都是依赖完整细胞作为生物催化剂,而不同之处在于,微生物发酵是在培养活细胞生长繁殖的同时利用细胞体内代谢反应进行目标产物的生产,并不需要对细胞进行离心、洗涤、重悬等处理,而是直接在发酵过程中完成催化反应。微生物发酵法又可以分为外源添加HQ合成α-熊果苷和从头合成生产β-熊果苷。该方法成本低廉、生产工艺简单、利于扩大培养,具有更大的工业化潜力(表 4)。
| Method | Host | Donor | HQ (g/L) | Conversion (%) | Titer (g/L) | References |
| Feeding experiment | Xanthomonas maltophilia BT-112 | 82.1 g/L sucrose | 13.2 | 93.6 | 30.60 | [46] |
| 164.2 g/L sucrose | 26.0 | 94.5 | 61.70 | [47] | ||
| 87.7 g/L sucrose | 16.3 | 93.7 | 38.20 | [48] | ||
| De novo biosynthesis | Escherichia coli | 30.0 g/L glucose | – | – | 4.19 | [49] |
| Yarrowia lipolytica | 100.0 g/L glucose | – | – | 8.60 | [50] | |
| Pseudomonas chlororaphis P3 | 36.0 g/L glucose | – | – | 6.79 | [51] | |
| Escherichia coli | 130.0 g/L glucose | – | – | 43.79 | [52] | |
| Escherichia coli | 50.0 g/L glycerol | – | – | 28.10 | [53] | |
| –: The values of “HQ” and “Conversion” are not required in de novo biosynthesis. | ||||||
由于HQ对微生物细胞有毒性,因此需要发掘既能耐受HQ又能高效转化HQ生产熊果苷的微生物。Liu等[46]采用一系列方法诱变嗜麦芽黄单胞菌(Xanthomonas maltophilia),筛选出耐受HQ并具有高α-立体选择性和糖基化活性的稳定遗传突变体X. maltophilia BT-112,添加13 g/L HQ和82 g/L蔗糖反应72 h,突变菌株BT-112可生产18.5 g/L的α-熊果苷,是野生型菌株的15倍,HQ转化率为56.7%;进一步优化培养基成分和发酵罐搅拌器转速后,添加13.2 g/L HQ及82.1 g/L蔗糖,在5 L发酵罐中培养72 h,α-熊果苷最大产量达到30.6 g/L,HQ转化率为93.6%。另外,Liu等研究了不同的分批补料策略[47],研究表明基于溶解氧控制的脉冲分批补料是最有效的方法,当采用此方式将含有26 g/L HQ及6.25 g酵母提取物的250 mL混合溶液分批加入反应体系,熊果苷产量达到61.7 g/L,HQ的摩尔转化率达到94.5%,这些研究说明了溶氧的控制在α-熊果苷生产过程中具有重要作用。Wei等[48]以X. maltophilia BT-112为生产菌株在50 mL体系中测试不同表面活性剂对生产α-熊果苷的影响,研究表明,0.4% (质量体积比)的吐温-80可有效促进α-熊果苷的合成,相比未添加表面活性剂,产量提升了124.8%;该团队探究最佳发酵条件并逐步放大培养规模,当放大至3 000 L培养规模时,α-熊果苷产量为38.2 g/L,HQ摩尔转化率为93.7%,证明了该工艺的稳定性及以X. maltophilia BT-112发酵生产α-熊果苷的工业化潜力。
4.2 从头合成生产β-熊果苷外源添加HQ的生物合成方式需要综合考虑HQ添加量及添加方式等多种因素,以免影响细胞生长及产物生产。相较于外源添加HQ,由简单碳源从头合成熊果苷有着更环保、更经济的优势。Shen等[49]于2017年在大肠杆菌中首次设计并构建了β-熊果苷的从头合成途径(图 3)。该研究筛选并表征了来自平滑念珠菌(Candida parapsilosis) CBS604的4-羟基苯甲酸1-羟化酶MNX1和来自蛇根木的糖基转移酶(arbutin synthase, AS),前者可以高效地催化对羟基苯甲酸(p-hydroxybenzoic acid, pHBA)生成HQ,后者能利用UDPG为糖基供体并催化HQ的糖基化生成β-熊果苷[54–56]。Shen等[49]将携带编码MNX1和AS基因的质粒导入大肠杆菌中,以葡萄糖作为碳源,首次实现了β-熊果苷的从头合成,产量为54.71 mg/L。为了进一步提高β-熊果苷的产量,该研究通过过表达莽草酸途径相关基因,如编码转酮醇酶的tktA、编码磷酸烯醇丙酮酸合成酶的ppsA、编码2-脱氢-3-脱氧磷酸庚二酸醛缩酶的抗反馈抑制突变体aroGfbr、编码莽草酸激酶II的aroL以及编码分支酸裂解酶的ubiC,使碳通量更多地流入β-熊果苷的合成途径中以提高pHBA的供应,该策略将熊果苷的产量提高到3.29 g/L;对培养基中葡萄糖添加量进行优化,在以30 g/L葡萄糖作为碳源的情况下,最终摇瓶中β-熊果苷产量达到4.19 g/L,比初始菌株高约77倍。
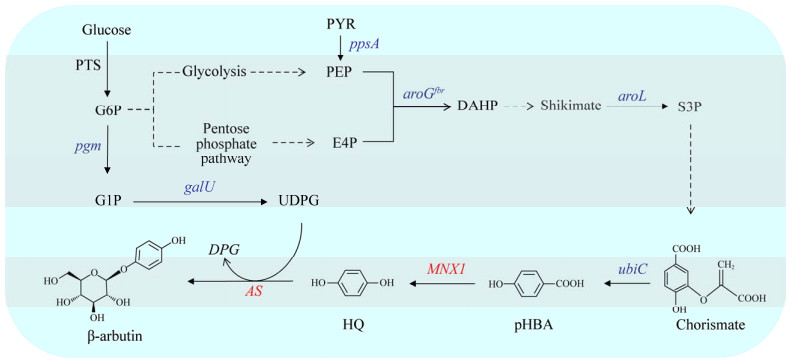
|
| 图 3 大肠杆菌中人工构建的β-熊果苷从头合成路径 Fig. 3 The artificial pathway for de novo biosynthesis of β-arbutin in E. coli. PTS: Phosphotransferase system; G6P: Glucose-6-phosphate; G1P: Glucose-1-phosphate; PYR: Pyruvic acid; PEP: Phosphoenolpyruvate; E4P: Erythrose 4-phosphate; DHAP: 3-deoxy-darabino-heptulosonate-7-phosphate; S3P: Shikimate-3-phosphate; pHBA: p-hydroxybenzoic acid; HQ: Hydroquinone; UDPG: Uridine diphosphate glucose; UDP: Uridine diphosphate; pgm encoding phosphoglucomutase; galU encoding UTP-glucose-1-phosphate uridylyltransferase; ppsA encoding phosphoenolpyruvate synthetase; aroGfbr encoding 3-deoxy-7-phosphoheptulonate synthase without feedback inhibition; aroL encoding shikimate kinase 2; ubiC encoding chorismate lyase; MNX1 encoding 4-hydroxybenzoate 1-hydroxylase. |
| |
在此基础上,Shang等[50]在解脂耶氏酵母(Yarrowia lipolytica)中构建了β-熊果苷的生物合成途径;研究通对分支丙酮酸裂解酶(UbiC)、MNX1和AS进行了密码子优化和异源表达,β-熊果苷产量为72.3 mg/L;同样为了增强pHBA供应,该研究将内源莽草酸途径中部分基因分别进行过表达,结果显示只有过表达编码编码3-脱氧-δ-阿拉伯糖庚酮糖-7-磷酸(3-deoxy- d-arabino-heptulosonate-7-phosphate, DAHP)合酶的基因DSH1和DHS2时,β-熊果苷产量有明显提升,产量达到819.6 mg/L;将葡萄糖添加量提升至100 g/L时,熊果苷的产量在144 h达到8.6 g/L,碳收率为0.086 g/g葡萄糖。
上述研究通过在生产菌株中导入携带途径酶的质粒实现了β-熊果苷的高效生物合成。然而,质粒的存在会导致菌株代谢负担重、遗传稳定性低以及抗生素依赖等问题,这对于工业大规模生产以及后续的产物提纯是不利的。因此,相比于引入质粒,将合成途径中的基因整合到菌株基因组中可以提高其遗传稳定性,解除菌株对抗生素的依赖并降低代谢负担,是一种更适用于工业化菌株的基因工程改造策略[57-61]。
Wang等[51]将MNX1、AS以及编码邻氨基苯甲酸合酶的XanB2整合在绿针假单胞菌(Pseudomonas chlororaphis)的突变体P3的基因组中,用于构建β-熊果苷的生物合成途径;为了提高前体物质的积累,该研究整合了莽草酸途径中的ppsA、tktA、编码3-脱氢奎尼酸合酶的基因aroB、编码3-脱氢奎尼酸脱水酶的基因aroD、编码莽草酸脱氢酶的基因aroE以及编码DAHP合酶的基因phzC,同时敲除竞争途径部分基因,包括编码4-羟基苯甲酸3-单加氧酶的pobA、编码丙酮酸激酶的pykA、编码邻氨基苯甲酸合酶的phzE,以减少副产物的生成;另外,该研究还敲除了参与次级代谢调节的基因rpeA、lon和remE来削弱β-熊果苷合成的竞争途径;在途径优化后,以甘油为碳源时,β-熊果苷的产量达到2.22 g/L;进一步通过优化培养基并添加pHBA混合分批补料发酵,β-熊果苷产量可达6.79 g/L。
熊果苷产量的不断提高显示出其潜在的工业生产价值,但是碳收率低、前体物质供应量不足以及副产物未能被完全鉴定与消除,是提高β-熊果苷产量并应用于工业化生产中亟待解决的问题。为了解决上述问题,An等[52]对工程菌株进行了改造,通过增加前体物质磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)和UDPG的供应,鉴定培养物中的未知化合物并进行了副产物的消除,极大程度上提升了β-熊果苷的产量,展现了生物合成β-熊果苷的工业化潜力。在该研究中,携带β-熊果苷从头合成必需基因和促进分支酸生产基因[62]的大肠杆菌BW25113可生产0.39 g/L β-熊果苷;为了增强前体PEP的供应,在大肠杆菌敲除编码的丙酮酸激酶的pykA和pykF,阻断PEP向丙酮酸(pyruvic acid, PYR)的转化,将摇瓶产量提升至0.73 g/L;通过过表达大肠杆菌编码磷酸葡萄糖变位酶的内源基因pgm和编码UTP-葡萄糖-1-磷酸核苷酸基转移酶的基因galU,提高了UDPG的供应,将摇瓶产量提高至1.81 g/L,最后,在3 L发酵罐中进行以葡萄糖为碳源的补料分批发酵,β-熊果苷产量达到36.12 g/L,碳收率为0.11 g/g葡萄糖。为了进一步提高目标产物得率,An等[52]鉴定了发酵液中的3种主要副产物(6-O-乙酰熊果苷、酪氨酸和乙酸),并通过敲除了生成副产物6-O-乙酰熊果苷的基因maa、生成副产物酪氨酸的基因tyrA及pts HIcrr操纵子,使PTS系统失活,在3 L发酵罐中以葡萄糖为碳源进行分批补料发酵,β-熊果苷产量达43.79 g/L,碳收率为0.22 g/g葡萄糖,是目前报道中的微生物生物合成β-熊果苷的最高产量及碳收率,为β-熊果苷的工业化生产提供了良好前景。
除了PEP和UDPG,赤藓糖4-磷酸(erythrose 4-phosphate, E4P)是生物合成β-熊果苷的另一重要前体物质,An等[53]开发了一种新的生长偶联的E4P生成策略,将E4P的形成与细胞生长相耦合,生长驱动力促进了E4P的高效生产;采用该策略,以甘油为碳源时,在摇瓶中生产了7.91 g/L β-熊果苷,最终在3 L发酵罐中生产了28.1 g/L熊果苷,碳收率为0.20 g/g甘油,为β-熊果苷工业化生产提供了一种新策略。
5 总结与展望熊果苷作为一种安全稳定的美白剂,被广泛应用于化妆品领域,目前常利用植物转化法、酶催化法、全细胞催化法以及微生物发酵法进行生产。在目前的研究中,植物转化法和微生物从头合成发酵法被用于β-熊果苷的合成;酶催化法、全细胞催化法以及外源添加前体的生物发酵法主要被用于α-熊果苷的合成。
生物合成熊果苷的方法中,全细胞催化法和微生物发酵法具有产量高、培养周期短、成本低廉且工艺简单、易于扩大规模等优点,更适用于熊果苷的工业化生产。目前,一些生物公司(如华恒生物)已经实现了利用全细胞催化法进行α-熊果苷的工业化生产,以及使用葡萄糖为原料,从头合成β-熊果苷的工业化生产。
然而,在全细胞催化法合成α-熊果苷的过程中,HQ细胞毒性会抑制全细胞催化剂活性及微生物发酵菌株的生长。同时,糖类底物利用率不高的问题也有待解决。随着基因组学及代谢组学的不断发展,许多间接影响细胞生长状态与生产能力的基因或蛋白被表征,通过对其进行合理调控,有利于在未来构建HQ耐受性更强、生产能力更高的底盘菌株。而计算机辅助的蛋白质工程能够更快速地得到高效的糖基转移酶突变体,以提高HQ和糖类底物的利用率。
从头合成β-熊果苷虽然不需要考虑HQ细胞毒性带来的影响,但仍存在前体供应不足及碳收率较低的问题,在未来还需要对代谢网络不断优化,平衡微生物的生长与产物的生产,使碳通量更多地流入β-熊果苷的合成途径,确保充足的前体供应,并通过抑制竞争途径及消除副产物等方式进一步提高合成途径的碳通量,在提高产量的同时提高碳收率。这些策略有望进一步提高熊果苷生物合成的产量,降低生产成本,更好地推进熊果苷的低成本工业化。
| [1] |
MIGAS P, KRAUZE-BARANOWSKA M. The significance of arbutin and its derivatives in therapy and cosmetics[J]. Phytochemistry Letters, 2015, 13: 35-40. DOI:10.1016/j.phytol.2015.05.015
|
| [2] |
GHASEMI-KASMAN M, YAVARPOUR BALI H, ABDI S. Arbutin as a Natural Soluble Glycosylated Phenol and Usage in Neuroinflammation[J]. Treatments, Nutraceuticals, Supplements, and Herbal Medicine in Neurological Disorders. Amsterdam: Elsevier, 2023, 525-539.
|
| [3] |
SAEEDI M, KHEZRI K, SEYED ZAKARYAEI A, MOHAMMADAMINI H. A comprehensive review of the therapeutic potential of α-arbutin[J]. Phytotherapy Research: PTR, 2021, 35(8): 4136-4154. DOI:10.1002/ptr.7076
|
| [4] |
刘晓婷, 王鑫璇. 熊果苷的药理作用及机制研究进展[J]. 食品与发酵工业, 2022, 48(2): 309-316. LIU XT, WANG XX. Research progress on the pharmacological action and mechanism of arbutin[J]. Food and Fermentation Industries, 2022, 48(2): 309-316 (in Chinese). |
| [5] |
TAKEBAYASHI J, ISHII R, CHEN JB, MATSUMOTO T, ISHIMI Y, TAI A. Reassessment of antioxidant activity of arbutin: multifaceted evaluation using five antioxidant assay systems[J]. Free Radical Research, 2010, 44(4): 473-478. DOI:10.3109/10715761003610760
|
| [6] |
NAHAR L, AL-GROSHI A, KUMAR A, SARKER SD. Arbutin: occurrence in plants, and its potential as an anticancer agent[J]. Molecules, 2022, 27(24): 8786. DOI:10.3390/molecules27248786
|
| [7] |
ASENSIO E, VITALES D, PÉREZ I, PERALBA L, VIRUEL J, MONTANER C, VALLÈS J, GARNATJE T, SALES E. Phenolic compounds content and genetic diversity at population level across the natural distribution range of bearberry (Arctostaphylos Uva-ursi, Ericaceae) in the Iberian peninsula[J]. Plants, 2020, 9(9): 1250. DOI:10.3390/plants9091250
|
| [8] |
KAWALIER A. Ueber die Blätter von Arctostaphylos uva ursi[J]. Justus Liebigs Annalen Der Chemie, 1852, 82(2): 241-243. DOI:10.1002/jlac.18520820213
|
| [9] |
STRECKER A. Ueber das Arbutin und seine Verwandlungen[J]. Justus Liebigs Annalen Der Chemie, 1858, 107: 228-234. DOI:10.1002/jlac.18581070214
|
| [10] |
MANNICH C. Ueber Arbutin und seine Synthese[J]. Archiv Der Pharmazie, 1912, 250(1): 547-560. DOI:10.1002/ardp.19122500146
|
| [11] |
TATSUO K, MITSUO T, KIYOKAZU T. Syntheses of Glucosides. I[J]. Yakugaku Zasshi, 1952, 72: 13-16. DOI:10.1248/yakushi1947.72.1_13
|
| [12] |
XU KX, XUE MG, LI ZM, YE BC, ZHANG B. Recent progress on feasible strategies for arbutin production[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10: 914280. DOI:10.3389/fbioe.2022.914280
|
| [13] |
ZHOU HY, ZHAO J, LI AT, REETZ MT. Chemical and biocatalytic routes to arbutin[J]. Molecules, 2019, 24(18): 3303. DOI:10.3390/molecules24183303
|
| [14] |
PAREJO I, VILADOMAT F, BASTIDA J, CODINA C. A single extraction step in the quantitative analysis of arbutin in bearberry (Arctostaphylos uva-ursi) leaves by high-performance liquid chromatography[J]. Phytochemical Analysis: PCA, 2001, 12(5): 336-339. DOI:10.1002/pca.602
|
| [15] |
周防震, 郭勇. 生物转化生产熊果苷的研究进展[J]. 安徽农业科学, 2009, 37(26): 12393-12394, 12396. ZHOU FZ, GUO Y. Research progress on the manufacture of arbutin by biotransformation[J]. Journal of Anhui Agricultural Sciences, 2009, 37(26): 12393-12394, 12396 (in Chinese). DOI:10.3969/j.issn.0517-6611.2009.26.013 |
| [16] |
GURI A, DHINGRA V, GIRI CC, SiINGH A, WARD OP, NARASU ML. Biotransformations using plant cells, organ cultures and enzyme systems: current trends and future prospects[J]. Biotechnology Advance, 2001, 19(3): 175-99. DOI:10.1016/S0734-9750(01)00054-4
|
| [17] |
KITTIPONGPATANA N, MANEERAT P, PATTANAKITKOSOL P, KITTIPONGPATANA O. Effect of some factors on the growth of Capsicum annuum L. cell suspension culture and biotransformation of hydroquinone to arbutin[J]. Chiang Mai University Journal of Natural Sciences, 2007, 6(2): 207-218.
|
| [18] |
INOMATA S, YOKOYAMA M, SETO S, YANAGI M. High-level production of arbutin from hydroquinone in suspension cultures of Catharanthus roseus plant cells[J]. Applied Microbiology and Biotechnology, 1991, 36(3): 315-319.
|
| [19] |
LUTTERBACH R, STÖCKIGT J. High-yield formation of arbutin from hydroquinone by cell-suspension cultures of Rauwolfia serpentina[J]. Helvetica Chimica Acta, 1992, 75(6): 2009-2011. DOI:10.1002/hlca.19920750625
|
| [20] |
严春艳, 张章, 于荣敏, 孔令义. 何首乌毛状根生物转化对苯二酚生产熊果苷的研究[J]. 中国中药杂志, 2007, 32(3): 192-195. YAN CY, ZHANG Z, YU RM, KONG LY. Studies on biotransformation of arbutin by 4-hydroxy phenol in hairy root of Polygonum multiflorum[J]. China Journal of Chinese Materia Medica, 2007, 32(3): 192-195 (in Chinese). DOI:10.3321/j.issn:1001-5302.2007.03.003 |
| [21] |
张章, 陈敏青, 任胜芳, 赵昱, 于荣敏. 转基因西洋参冠瘿组织生物合成熊果苷的研究[J]. 中草药, 2006, 37(5): 759-761. ZHANG Z, CHEN MQ, REN SF, ZHAO Y, YU RM. Biosynthesis of arbutin from crown gall of transgenic Panax quinquefolium[J]. Chinese Traditional and Herbal Drugs, 2006, 37(5): 759-761 (in Chinese). DOI:10.3321/j.issn:0253-2670.2006.05.046 |
| [22] |
TABATA M, IKEDA F, HIRAOKA N, KONOSHIMA M. Glucosylation of phenolic compounds by Datura innoxia suspension cultures[J]. Phytochemistry, 1976, 15(8): 1225-1229. DOI:10.1016/0031-9422(76)85082-0
|
| [23] |
YOKOYAMA M, INOMATA S, SETO S, YANAGI M. Effects of sugars on the glucosylation of exogenous hydroquinone by Catharanthus roseus cells in suspension culture[J]. Plant and Cell Physiology, 1990, 31(4): 551-555.
|
| [24] |
ZHU XT, TIAN YQ, ZHANG WL, ZHANG T, GUANG CE, MU WM. Recent progress on biological production of α-arbutin[J]. Applied Microbiology and Biotechnology, 2018, 102(19): 8145-8152. DOI:10.1007/s00253-018-9241-9
|
| [25] |
KITAO S, SEKINE H. α-d-glucosyl transfer to phenolic compounds by sucrose phosphorylase from Leuconostoc mesenteroides and production of α-arbutin[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(1): 38-42. DOI:10.1271/bbb.58.38
|
| [26] |
万月佳, 马江锋, 徐蓉, 贺爱永, 姜岷, 陈可泉, 姜引. 重组大肠杆菌产蔗糖磷酸化酶的酶学性质及其催化合成α-熊果苷[J]. 生物工程学报, 2012, 28(12): 1450-1459. WAN YJ, MA JF, XU R, HE AY, JIANG M, CHEN KQ, JIANG Y. Properties of sucrose phosphorylase from recombinant Escherichia coli and enzymatic synthesis of α-arbutin[J]. Chinese Journal of Biotechnology, 2012, 28(12): 1450-1459 (in Chinese). |
| [27] |
李晓玉, 夏媛媛, 沈微, 杨海泉, 曹钰, 陈献忠. 肠膜明串珠菌蔗糖磷酸化酶的酶学表征及在催化合成α-熊果苷中的应用[J]. 生物工程学报, 2020, 36(8): 1546-1555. LI XY, XIA YY, SHEN W, YANG HQ, CAO Y, CHEN XZ. Characterization of a sucrose phosphorylase from Leuconostoc mesenterides for the synthesis of α-arbutin[J]. Chinese Journal of Biotechnology, 2020, 36(8): 1546-1555 (in Chinese). |
| [28] |
SEO ES, KANG J, LEE JH, KIM GE, KIM GJ, KIM D. Synthesis and characterization of hydroquinone glucoside using Leuconostoc mesenteroides dextransucrase[J]. Enzyme and Microbial Technology, 2009, 45(5): 355-360. DOI:10.1016/j.enzmictec.2009.07.011
|
| [29] |
ZHOU X, ZHENG YT, WEI XM, YANG KD, YANG XK, WANG YT, XU LM, DU LQ, HUANG RB. Sucrose isomerase and its mutants from Erwinia rhapontici can synthesise α-arbutin[J]. Protein and Peptide Letters, 2011, 18(10): 1028-1034. DOI:10.2174/092986611796378774
|
| [30] |
SEO DH, JUNG JH, HA SJ, CHO HK, JUNG DH, KIM TJ, BAEK NI, YOO SH, PARK CS. High-yield enzymatic bioconversion of hydroquinone to α-arbutin, a powerful skin lightening agent, by amylosucrase[J]. Applied Microbiology and Biotechnology, 2012, 94(5): 1189-1197. DOI:10.1007/s00253-012-3905-7
|
| [31] |
YU SH, WANG YC, TIAN YQ, XU W, BAI YX, ZHANG T, MU WM. Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J]. Process Biochemistry, 2018, 68: 93-99. DOI:10.1016/j.procbio.2018.02.012
|
| [32] |
NISHIMURA T, KOMETANI T, TAKII H, TERADA Y, OKADA S. Purification and some properties of α-amylase from Bacillus subtilis X-23 that glucosylates phenolic compounds such as hydroquinone[J]. Journal of Fermentation and Bioengineering, 1994, 78(1): 31-36. DOI:10.1016/0922-338X(94)90174-0
|
| [33] |
MATHEW S, ADLERCREUTZ P. Regioselective glycosylation of hydroquinone to α-arbutin by cyclodextrin glucanotransferase from Thermoanaerobacter sp.[J]. Biochemical Engineering Journal, 2013, 79: 187-193. DOI:10.1016/j.bej.2013.08.001
|
| [34] |
SATO T, HASEGAWA N, SAITO J, UMEZAWA S, HONDA Y, KINO K, KIRIMURA K. Purification, characterization, and gene identification of an α-glucosyl transfer enzyme, a novel type α-glucosidase from Xanthomonas campestris WU-9701[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 80: 20-27. DOI:10.1016/j.molcatb.2012.04.014
|
| [35] |
PRODANOVIĆ RM, MILOSAVIĆ NB, SLADIĆ D, VELICKOVIĆ TC, VUJCIĆ Z. Synthesis of hydroquinone-alpha-glucoside by alpha-glucosidase from baker's yeast[J]. Biotechnology Letters, 2005, 27(8): 551-554. DOI:10.1007/s10529-005-2880-9
|
| [36] |
KUROSU J, SATO T, YOSHIDA K, TSUGANE T, SHIMURA S, KIRIMURA K, KINO K, USAMI S. Enzymatic synthesis of alpha-arbutin by alpha-anomer-selective glucosylation of hydroquinone using lyophilized cells of Xanthomonas campestris WU-9701[J]. Journal of Bioscience and Bioengineering, 2002, 93(3): 328-330. DOI:10.1016/S1389-1723(02)80037-8
|
| [37] |
WU PH, GIRIDHAR R, WU WT. Surface display of transglucosidase on Escherichia coli by using the ice nucleation protein of Xanthomonas campestris and its application in glucosylation of hydroquinone[J]. Biotechnology and Bioengineering, 2006, 95(6): 1138-1147. DOI:10.1002/bit.21076
|
| [38] |
YANG CY, FAN WM, ZHANG RJ, SHI JP, Knežević-Jugović Z, ZHANG BG. Study on transglucosylation properties of amylosucrase from Xanthomonas campestris pv. Campestris and its application in the production of α-arbutin[J]. Catalysts, 2019, 9(1): 5.
|
| [39] |
LIU CQ, DENG L, ZHANG P, ZHANG SR, XU T, WANG F, TAN TW. Efficient production of α-arbutin by whole-cell biocatalysis using immobilized hydroquinone as a glucosyl acceptor[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 91: 1-7. DOI:10.1016/j.molcatb.2013.01.026
|
| [40] |
ZHU LJ, JIANG D, ZHOU YY, LU YL, FAN YX, CHEN XL. Batch-feeding whole-cell catalytic synthesis of α-arbutin by amylosucrase from Xanthomonas campestris[J]. Journal of Industrial Microbiology & Biotechnology, 2019, 46(6): 759-767.
|
| [41] |
ZHU LJ, XU M, LU CX, CHEN LY, XU AJ, FANG JY, CHEN HC, LU YL, FAN YX, CHEN XL. Optimization of whole-cell biotransformation for scale-up production of α-arbutin from hydroquinone by the use of recombinant Escherichia coli[J]. AMB Express, 2019, 9(1): 94. DOI:10.1186/s13568-019-0820-7
|
| [42] |
周祺, 吕雪芹, 柴雪莹, 刘延峰, 李江华, 堵国成, 刘龙. 枯草芽孢杆菌全细胞催化高效合成α-熊果苷[J]. 食品与发酵工业, 2021, 47(22): 1-7. ZHOU Q, LYU XQ, CHAI XY, LIU YF, LI JH, DU GC, LIU L. Highly efficient synthesis of α-arbutin by whole-cell catalysis of Bacillus subtilis[J]. Food and Fermentation Industries, 2021, 47(22): 1-7 (in Chinese). |
| [43] |
AO JW, PAN XW, WANG Q, ZHANG HW, REN KX, JIANG A, ZHANG X, RAO ZM. Efficient whole-cell biotransformation for α-arbutin production through the engineering of sucrose phosphorylase combined with engineered cell modification[J]. Journal of Agricultural and Food Chemistry, 2023, 71(5): 2438-2445. DOI:10.1021/acs.jafc.2c07972
|
| [44] |
沈洋, 吕雪芹, 林璐, 李江华, 堵国成, 刘龙. 蔗糖磷酸化酶的半理性设计及生产α-熊果苷的条件优化[J]. 食品与发酵工业, 2020, 46(13): 1-9. SHEN Y, LYU XQ, LIN L, LI JH, DU GC, LIU L. Semi-rational design of sucrose phosphorylase and optimization of conditions for α-arbutin production[J]. Food and Fermentation Industries, 2020, 46(13): 1-9 (in Chinese). |
| [45] |
ZHOU Q, WU YK, DENG JY, LIU YF, LI JH, DU GC, LV XQ, LIU L. Combinatorial metabolic engineering enables high yield production of α-arbutin from sucrose by biocatalysis[J]. Applied Microbiology and Biotechnology, 2023, 107(9): 2897-2910. DOI:10.1007/s00253-023-12496-2
|
| [46] |
LIU CQ, DENG L, ZHANG P, ZHANG SR, LIU L, XU T, WANG F, TAN TW. Screening of high α-arbutin producing strains and production of α-arbutin by fermentation[J]. World Journal of Microbiology and Biotechnology, 2013, 29(8): 1391-1398. DOI:10.1007/s11274-013-1302-8
|
| [47] |
LIU CQ, ZHANG P, ZHANG SR, XU T, WANG F, DENG L. Feeding strategies for the enhanced production of α-arbutin in the fed-batch fermentation of Xanthomonas maltophilia BT-112[J]. Bioprocess and Biosystems Engineering, 2014, 37(2): 325-329. DOI:10.1007/s00449-013-0980-9
|
| [48] |
WEI M, REN Y, LIU CX, LIU RC, ZHANG P, WEI Y, XU T, WANG F, TAN TW, LIU CQ. Fermentation scale up for α-arbutin production by Xanthomonas BT-112[J]. Journal of Biotechnology, 2016, 233: 1-5. DOI:10.1016/j.jbiotec.2016.05.022
|
| [49] |
SHEN XL, WANG J, WANG J, CHEN ZY, YUAN QP, YAN YJ. High-level de novo biosynthesis of arbutin in engineered Escherichia coli[J]. Metabolic Engineering, 2017, 42: 52-58. DOI:10.1016/j.ymben.2017.06.001
|
| [50] |
SHANG YZ, WEI WP, ZHANG P, YE BC. Engineering Yarrowia lipolytica for enhanced production of arbutin[J]. Journal of Agricultural and Food Chemistry, 2020, 68(5): 1364-1372. DOI:10.1021/acs.jafc.9b07151
|
| [51] |
WANG SW, FU C, BILAL M, HU HB, WANG W, ZHANG XH. Enhanced biosynthesis of arbutin by engineering shikimate pathway in Pseudomonas chlororaphis P3[J]. Microbial Cell Factories, 2018, 17(1): 174. DOI:10.1186/s12934-018-1022-8
|
| [52] |
AN N, ZHOU SB, CHEN X, WANG J, SUN XX, SHEN XL, YUAN QP. High-yield production of β-arbutin by identifying and eliminating byproducts formation[J]. Applied Microbiology and Biotechnology, 2023, 107(20): 6193-6204. DOI:10.1007/s00253-023-12706-x
|
| [53] |
AN N, XIE C, ZHOU SB, WANG J, SUN XX, YAN YJ, SHEN XL, YUAN QP. Establishing a growth-coupled mechanism for high-yield production of β-arbutin from glycerol in Escherichia coli[J]. Bioresource Technology, 2023, 369: 128491. DOI:10.1016/j.biortech.2022.128491
|
| [54] |
EPPINK MH, BOEREN SA, VERVOORT J, van BERKEL WJ. Purification and properties of 4-hydroxybenzoate 1-hydroxylase(decarboxylating), a novel flavin adenine dinucleotide-dependent monooxygenase from Candida parapsilosis CBS604[J]. Journal of Bacteriology, 1997, 179(21): 6680-6687. DOI:10.1128/jb.179.21.6680-6687.1997
|
| [55] |
AREND J, WARZECHA H, HEFNER T, STÖCKIGT J. Utilizing genetically engineered bacteria to produce plant-specific glucosides[J]. Biotechnology and Bioengineering, 2001, 76(2): 126-131. DOI:10.1002/bit.1152
|
| [56] |
HEFNER T, AREND J, WARZECHA H, SIEMS K, STÖCKIGT J. Arbutin synthase, a novel member of the NRD1beta glycosyltransferase family, is a unique multifunctional enzyme converting various natural products and xenobiotics[J]. Bioorganic & Medicinal Chemistry, 2002, 10(6): 1731-1741.
|
| [57] |
TYO KEJ, AJIKUMAR PK, STEPHANOPOULOS G. Stabilized gene duplication enables long-term selection-free heterologous pathway expression[J]. Nature Biotechnology, 2009, 27: 760-765. DOI:10.1038/nbt.1555
|
| [58] |
STRIEDNER G, PFAFFENZELLER I, MARKUS L, NEMECEK S, GRABHERR R, BAYER K. Plasmid-free T7-based Escherichia coli expression systems[J]. Biotechnology and Bioengineering, 2010, 105(4): 786-794. DOI:10.1002/bit.22598
|
| [59] |
ENGLAENDER JA, JONES JA, CRESS BF, KUHLMAN TE, LINHARDT RJ, KOFFAS MAG. Effect of genomic integration location on heterologous protein expression and metabolic engineering in E. coli[J]. ACS Synthetic Biology, 2017, 6(4): 710-720. DOI:10.1021/acssynbio.6b00350
|
| [60] |
MAIRHOFER J, SCHARL T, MARISCH K, CSERJAN-PUSCHMANN M, STRIEDNER G. Comparative transcription profiling and in-depth characterization of plasmid-based and plasmid-free Escherichia coli expression systems under production conditions[J]. Applied and Environmental Microbiology, 2013, 79(12): 3802-3812. DOI:10.1128/AEM.00365-13
|
| [61] |
WANG JL, NIYOMPANICH S, TAI YS, WANG JY, BAI WQ, MAHIDA P, GAO T, ZHANG KC. Engineering of a highly efficient Escherichia coli strain for mevalonate fermentation through chromosomal integration[J]. Applied and Environmental Microbiology, 2016, 82(24): 7176-7184. DOI:10.1128/AEM.02178-16
|
| [62] |
LIN YH, SHEN XL, YUAN QP, YAN YJ. Microbial biosynthesis of the anticoagulant precursor 4-hydroxycoumarin[J]. Nature Communications, 2013, 4: 2603. DOI:10.1038/ncomms3603
|