医美活性成分微生物合成研究进展
赵嫚
,
池倬雨
,
赖冬连
,
刘科瑞
,
柳志强
,
郑裕国
生物工程学报  2024, Vol. 40 2024, Vol. 40 Issue (8): 2489-2512 Issue (8): 2489-2512 |

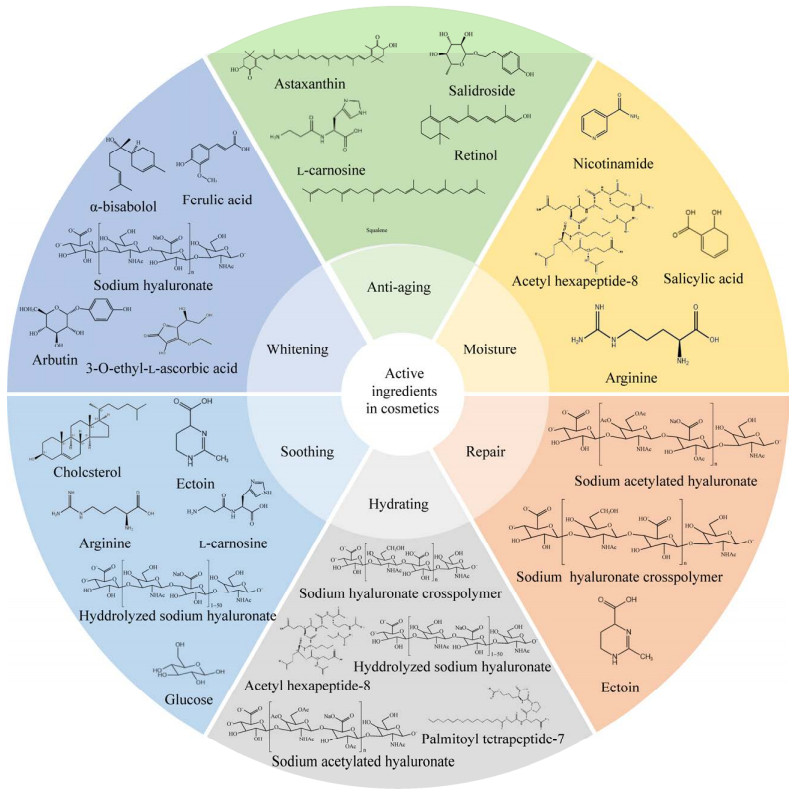
随着人们生活水平的提高,医美产业迅猛发展。从广义上说,医美主要包括医疗美容和化妆品两大行业,医疗美容又包括手术类医疗美容(手术类医美)和非手术类医疗美容(轻医美)两类。截至2022年,全球医美行业市场规模约926亿美元,中国占了其中的34%左右[1-2]。全球化妆品行业2017年达到5 000亿美元规模,到2023年超过8 000亿美元,年增长率超过7%,中国化妆品市场2021年有600亿美元规模,预计2050年达到4 500亿美元[3]。医美产品功能的发挥,很大程度上取决于原料的功效。功能性护肤产品是医美发展的主要趋势,按照其功效作用和护肤品品类成分,功能性护肤产品主要包括保湿、修复、补水、舒缓、美白和抗衰等类型,涉及的功能性护肤原料主要包括:氨基酸、玻尿酸、烟酰胺、视黄醇(A醇)、水杨酸、维生素C、胶原蛋白、肽类、玻色因、维生素B5和神经酰胺等(图 1)[4]。
|
| 图 1 医美活性成分的种类和功能 Fig. 1 Types and functions of active ingredients in cosmetics. |
| |
医美活性成分主要通过化学合成、动植物提取和微生物合成等方法获得。化学合成具有反应条件苛刻、环境不友好、反应步骤复杂等劣势;动植物提取方法具有得率低、过程复杂、成本高等缺点,而且过度捕杀或采摘会严重影响动植物资源和生态平衡。比如从红景天(Rhodiola rosea L.)、深海鲨鱼等中能够获取红景天苷和角鲨烯等天然产物,但是随着需求量的持续增加,过度获取导致野生动植物资源濒临灭绝[5-6]。微生物合成医美活性成分因其过程简单、绿色、可持续且来源天然等优势备受关注,已经逐渐开始取代提取法和化学合成法。
近年来,随着基因工程、代谢工程、合成生物技术等生物制造技术的发展,微生物通过合成生物技术合成医美活性成分已经取得了很大的进展。本文将重点对主要医美生物活性物质如蛋白质与肽类、多酚类和萜烯类等的微生物合成研究进行综述(表 1)。
| Types | Functions |
| Collagen | Maintaining tissue structure and regulating the cellular physiological environment |
| L-carnosine | Antioxidant, anti-glycation, free radical scavenging, anti-immune, neuroprotective |
| Carcinine | Antioxidant, anti-glycosylation, free radical scavenging, metal ion chelation, anti-tumor, prevention of retinopathy, improvement of learning deficits |
| Hyaluronic acid | Moisturizing, plasticity, permeability, biocompatibility |
| Salidroside | Protects against UV radiation, hinders melanin synthesis, eliminates free radicals |
| Arbutin | Inhibits melanin production, antioxidant, anti-inflammatory, whitening |
| Ferulic acid | Antioxidant, anti-immune |
| Salicylic acid | Exfoliates dead skin cells, reduces clogged pores, promotes skin regeneration, anti-inflammatory, antibacterial |
| Squalene | Antioxidant, anti-aging and anti-wrinkle |
| Retinol | Regulates skin metabolism, promotes collagen synthesis, antioxidant, anti-free radicals, repair, whitening |
| Astaxanthin | Antioxidant |
| D-pantothenic acid | Involved in energy metabolism, signaling, and epigenetic processes in organisms |
| Ascorbic acid | Whitening, antioxidant, promotes collagen synthesis |
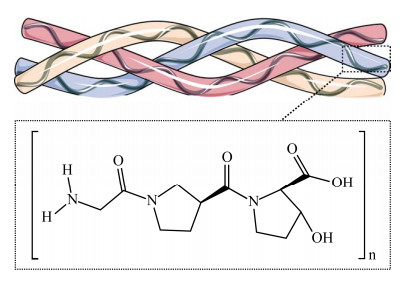
胶原蛋白(collagen)在哺乳动物中含量非常丰富,占机体总蛋白的30%以上,是细胞外基质的重要组成部分,参与维持组织结构和调节细胞生理环境等,且因其低抗原性和高黏附性,已经被广泛应用于化妆品、医药、组织工程等行业,是医美领域的明星分子[7]。胶原蛋白是由3条α链组成的三螺旋结构,每一条α链都由重复的肽三联体(Gly-X-Y)组成,其中X和Y通常分别表示脯氨酸(proline, Pro)和羟脯氨酸(hydroxyproline, Hyp)[8] (图 2)。胶原蛋白作为最丰富的动物蛋白,至今已发现29种以上,因其结构多样性,主要分为Type I、Type II和Type III三种类型,其中Ⅰ型和Ⅲ型主要分布于人体皮肤,也常作为化妆品的主要成分[9]。根据弗若斯特沙利文数据(https://www.frostchina.com/content/insight/detail?id=666ffcd3c05900a30c9477d2),中国重组胶原蛋白产品市场规模从2017年到2021年,已经从15亿元增加到108亿元,年复合增长率为63.8%,预计从2022年到2027年将以年复合增长率42.4%的增速发展,市场价值将从185亿元增至1 083亿元。目前,市面上的胶原蛋白大体分为动物源胶原蛋白和重组胶原蛋白两类。动物源胶原蛋白因其易感染病原体、批间不稳定性和预处理与提取过程复杂等原因,现已被大规模限制使用。利用微生物合成的重组胶原蛋白无疑是一种安全有效的替代方式,而且已有研究发现,重组胶原蛋白相较于传统动物提取胶原蛋白,具有更高的亲水性、更高的生物活性区域、更优异的抗氧化性能以及止血与促伤口愈合能力,目前已经取得了较多的研究进展[10]。
|
| 图 2 胶原蛋白结构图 Fig. 2 Structure of collagen. |
| |
杨晶等[11]在大肠杆菌(Escherichia coli) BL21中诱导表达重组类人Ⅰ型胶原蛋白(pET28a-rhC),获得520 mg/L分子量为40 kDa的重组蛋白。尽管重组蛋白不具备完整的三螺旋结构,但通过二苯基碘鎓六氟磷酸盐(diphenyliodonium hexafluorophosphate, DPPH)自由基清除试验与噻唑蓝(thiazolyl blue, MTT)比色法试验发现其具有一定的抗氧化性,且能够有效促进小鼠纤维细胞3T3细胞的增殖,也可以作为护肤品添加剂应用于化妆品行业和作为止血材料促进伤口愈合应用于医疗行业。但是,E. coli表达体系缺乏使胶原蛋白三螺旋结构稳定的羟基化酶,且未经羟基化修饰的胶原蛋白的Tm值较低。基于此,Liu等[12]将筛选到的羟基化率可达63.6%的炭疽杆菌(Bacillus anthracis)中的脯氨酸-4-羟化酶(prolyl 4-hydroxylase, P4H)与胶原蛋白基因在E. coli中共表达,在5 L发酵罐中进行分批发酵,获得了0.8 g/L的羟基化胶原蛋白,该蛋白相较未羟基化的胶原蛋白具有更好的生物相容性。进一步研究发现,酵母内源的胶原蛋白和人Ⅱ型、Ⅲ型胶原蛋白具有高度的同源性,说明酵母可能是更合适的表达宿主。1997年,Vuorela等[13]在毕赤酵母(Pichia pastoris)中共表达了胶原蛋白多肽链与P4H,结果发现胶原蛋白多肽链的表达有利于P4H的表达,且生产的羟基化Ⅲ型胶原蛋白含量高达15 mg/L,该研究为P. pastoris生产胶原蛋白打开了新思路。2017年,李维娜等[14]对P. pastoris表达III型胶原蛋白的培养基进行条件优化,在22 L发酵罐高密度发酵,产量达到4.71 g/L。2019年,侯增淼等[15]利用P. pastoris发酵合成人Ⅰ型胶原蛋白Gly-X-Y,结果获得纯度大于95%、表达量高达4.50 g/L的重组人Ⅰ型胶原蛋白,扫描电镜分析及细胞毒性试验表明该人源性胶原蛋白冻干品具有多孔纤维网状结构及优良的细胞相容性,能进一步应用于化妆品以及生物医学领域。研究人员通过10多年的深度研究,发现了III型重组人源胶原蛋白COL3A1中的关键区域483–512 aa,并对其进行重复拼接,在大肠杆菌中诱导表达,开发了全套制备工艺,获得了水溶性强、生物活性高的重组人源化III型胶原蛋白,并实现了产业化[16-17]。除了在微生物合成中的进展,在植物、昆虫杆状病毒和动物等表达体系中,人源胶原蛋白的大规模表达也取得了极大的进展[18]。尽管如此,目前制备的重组胶原蛋白在成本、产量、羟脯氨酸羟化率、三螺旋结构特性及纯度仍有待提升和改进。未来随着生物制造技术(蛋白质的定向设计和细胞工厂的重构适配等)的发展,更多安全、多样和不同功效的重组胶原蛋白将会被大量合成。
1.2 肽类的生物合成医美活性成分中的肽类物质主要是由2–50个左右氨基酸形成的短肽,具有抗氧化、抗衰老、抗炎和抗菌等多种生物活性,是化妆品中理想的活性成分[19-20]。基于这些肽类物质开发出的新型化妆品,具有治疗和保护功能,有益于皮肤美白、保湿和再生,应用范围广泛。根据作用方式的差异,肽类物质可以分为4类:信号肽、载体肽、神经递质抑制肽和酶抑制肽[20-21] (表 2)。例如,棕榈酰五肽-3是最早被生物合成的活性肽之一,可以刺激胶原蛋白的合成,被用于抗衰老和伤口愈合治疗;人体可以合成的蓝铜胜肽(copper glycyl-histidine-tripeptide, Cu-GHK),被应用于护肤品中,具有促进胶原合成和修复DNA损伤的功能;乙酰六肽-3是另一种流行的商业化合成肽,具有潜在的抗皱和保湿特性[22-24]。尽管如此,绝大多数肽类均是通过化学合成,仅有部分肽类如肌肽、脱羧肌肽等的生物合成法被开发。
| Bioactive peptide | Type | Function |
| Signal peptide | L-carnosine, carcinine, Trifluoroacetyltripeptide-2, palmitoyl tripeptide-3/5 | Stimulate collagen and elastin synthesis, stimulate keratinocytes, and stimulate epidermal cell proliferation |
| Carrier peptide | GHK-Cu glycine histolysin, manganese tripeptide complex-1 GHK-Mn | Provide trace elements to stimulate collagen synthesis for wound healing and enzyme reaction processes |
| Neurotransmitter inhibitory peptide | Acetyl hexapeptide 3/8, dipeptide diaminobutylbenzylamide diacetate | Promote collagen and ealstin synthesis and inhibit melanin synthesis |
| Enzyme inhibitory peptide |
Soybean amino acids, rice peptides, silkworm silk protein | Provide moisturizing effects to reduce the breakdown of collagen and elastin |
L-肌肽(L-carnosine)是由β-丙氨酸和L-组氨酸缩合得到的活性二肽,属于信号肽类,参与生物体多种生理功能,具有抗氧化、抗糖化、清除自由基等功能,广泛应用于化妆品、药品和保健品添加剂[19, 25]。目前,工业上肌肽主要依靠化学合成,但该路线消耗大、副产物多、环境污染严重,因此高效绿色环保的生物法逐渐成为有前景的发展方向。目前肌肽的生物法合成主要以酶法为主,且已经取得了很大的进展[26-27]。Heyland等[28]以β-丙氨酰胺与L-组氨酸为底物,以重组β-氨肽酶的E. coli为催化剂,催化合成L-肌肽,产量高达3.7 g/L。但是β-丙氨酰胺的成本较高,为了减少L-肌肽的生产成本,殷东亚等[26]通过基因挖掘获得粘氏沙雷氏菌(Serratia marcescens)来源的二肽水解酶(dipeptidase, SmPepD)直接催化β-丙氨酸和L-组氨酸合成L-肌肽,最高产量为62.5 mmol/L,并进一步对SmPepD进行定向进化获得高活性的突变体SmPepDM13,接着以该酶的粗酶粉催化L-肌肽合成,水相中最高产量可达89 mmol/L。Liu等[29]从深海沉积物宏基因组中挖掘一个新氨肽酶,可以催化L-肌肽的合成,通过定向进化获得突变体G310A,可催化产生10 mmol/L的L-肌肽。最近,有研究在E. coli中组合蛋白质工程和转运体工程,通过构建SmPepD的突变体T168S/G148D,同时删除L-组氨酸外排蛋白yeaS,最终在5 L发酵罐中通过添加5.6 mol/L β-丙氨酸和0.27 mol/L L-组氨酸,可实现生物转化L-肌肽的产量为133.2 mmol/L,这是目前报道的最高产量。
1.2.2 脱羧肌肽的生物合成脱羧肌肽(carcinine)是一种单羧酸酰胺,最初在甲壳类动物和一些哺乳动物心脏中被发现,脱羧肌肽不仅具有抗氧化、抗糖基化、清除自由基、金属离子螯合等功能,而且具有抗肿瘤、预防视网膜病变、改善学习缺陷等药理作用,突出的功能特性使其近几年在医药、医美领域的需求呈长期稳定增长趋势[30]。研究已经发现,在果蝇(Drosophila melanogaster)体内,脱羧肌肽可由非核糖体肽合成酶(nonribosomal peptide synthetase, NRPS) Ebony在磷酸泛酰巯基转移酶(phosphopantetheinyl transferase, sfp)的辅助下合成[31-32]。目前关于生物法生产脱羧肌肽的报道相对较少,本实验室[33]将Ebony和枯草芽孢杆菌(Bacillus subtilis)中的sfp用GSG连接,构建了融合蛋白sfp-GSG-ebony (SGE),并在大肠杆菌中过表达,该蛋白在以β-丙氨酸和L-组胺为底物的催化体系下,36 h内可以合成脱羧肌肽7.34 g/L,转化效率为0.204 g/(L·h),这也是目前报道的最高产量。
2 透明质酸的生物合成透明质酸(hyaluronic acid,HA)是一种D-葡萄糖醛酸和N-乙酰氨基葡萄糖通过β-1, 3和β-1, 4糖苷键交替连接而成的天然线性糖胺聚糖,也是医美领域的明星分子。HA分为高分子量(HMW-HA, ≥100 kDa)、低分子量(LMW-HA, 10–100 kDa)和寡聚透明质酸(o-HA, ≤10 kDa)三类,其生物活性取决于分子量。因其具有高度的保湿性、可塑性、渗透性和生物相容性,在医药、化妆品和食品等领域广泛应用[34]。
HA是链球菌荚膜的主要成分,主要由A组和C组链球菌生产,如酿脓链球菌(Streptococcus pyogenes)、兽疫链球菌(Streptococcus zooepidemicus)、马疫链球菌(Streptococcus equi subsp. zooepidemicus)等[34]。HA的生物合成主要由HAS操纵子实现,其中最关键的3个酶分别是透明质酸合成酶(hyaluronan synthase A, HasA)、UDP-葡萄糖脱氢酶(uridine diphosphate glucose dehydrogenase, UDPG dehydrogenase, HasB)和UDP-葡萄糖焦磷酸化酶(UDP glucose pyrophosphorylase, HasC)。HA的合成从葡萄糖-6-磷酸开始,经过多步分别流向两个单体UDP-葡萄糖醛酸(UDP-glucuronic acid, UDP- GlcUA)和UDP-N-乙酰氨基葡萄糖(UDP-N- acetylglucosamine, UDP-GlcNAc),最终UDP-GlcUA和UDP-GlcNAc在hasA的催化作用下形成长链,转运到胞外形成HA[35]。HA可以通过动物组织提取和微生物发酵等方法获得,其中动物提取因材料来源、成本控制和道德伦理等因素,已经逐渐被微生物发酵法所替代。目前微生物发酵合成HA已经被广泛研究,S. zooepidemicus是HA的天然合成菌株,生产的HA生物相容性好、分子量高,被应用得最多,但也存在生长相对较慢、培养基成分和下游处理成本较高等缺点[36]。因此很多研究已经对改善培养基成分和培养条件提升S. zooepidemicus生产HA产量和品质进行了探究,主要研究进展如下:Amado等[37]采用乳清奶酪合成HA,分子量为3.71×103 kDa,产量达到4.02 g/L,与对照(3.19 g/L)相比显著提升;此外,Amado等[38]利用玉米浆作为氮源替代蛋白胨,最高产量可达3.48 g/L (对照3.60 g/L),分子量为3.8×103 kDa,显著降低生产成本;Zhang等[39]用淀粉代替葡萄糖作为碳源,最终产量可达6.7 g/L;Duffeck等[40]用活性炭处理甘蔗糖蜜替代葡萄糖进行发酵,发现HA的产量显著提高到0.71 g/L (对照0.47 g/L)。除了培养基成分,一些添加剂、培养条件如pH、温度、溶氧、搅拌、底物浓度等都会影响HA的产量,研究人员也都对其进行了不同程度的优化[36]。
此外,随着代谢工程、合成生物技术的发展,E. coli、谷氨酸棒状杆菌(Corynebacterium glutamicum)、枯草芽孢杆菌(Bacillus subtilis)和P. pastoris等也都被开发用于HA的生产,主要生产小分子量HA。在E. coli中,过表达激活半乳糖利用途径,异源过表达hasA基因,并敲除6-磷酸果激酶1 (6-phosphofructokinase 1, PfkA)和6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase, Zwf)合成基因协调半乳糖和葡萄糖的利用速率,最终HA的产量为29.98 mg/L[41]。在乳酸乳球菌(Lactococcus lactis)中,研究人员过表达hasA基因,利用可诱导的NICE系统并添加乳酸链球菌素(nisin)使HA的产量达到6.09 g/L[42]。利用C. glutamicum生产HA的研究较多,产量也最高。2016年,Cheng等[43]在C. glutamicum中异源表达ssehasA和hasB基因,并进行发酵条件优化,HA的产量达到8.3 g/L,分子量为1.3×103 kDa。进一步通过过表达hasAB且删除乳酸脱氢酶基因(lactate dehydrogenase, ldh),获得工程化菌株C. glutamicum/Δldh-ABC,通过葡萄糖分批补料发酵,最大产量可达21.6 g/L,是野生型菌株的3倍[44]。Du等[45]通过敲除iolR基因提高葡萄糖的吸收,过表达心磷脂合成基因(cardiolipin synthase, pgsA1/pgsA2/cls)强化心磷脂的合成,适量表达透明颤菌(Vitreoscilla)血红蛋白,提供更多的ATP并增加NAD+/NADH的比率,以及揭示谷氨酰胺在提高HA含量的作用,并添加谷氨酰胺,最终实现60 h内HA的产量达32 g/L。Wang等[46]通过选择最高效的HA合酶spHasA,过表达强化中间代谢途径,将葡萄糖大量转化为HA的合成单体UDP-GlcA和UDP-GlcNAc,并敲除cg0420和cg0424以减少内源性细胞外多糖生物合成来设计HA合成菌株,最后在发酵过程中补充外源水蛭透明质酸酶(hyaluronidase, LHAase)使工程化谷氨酸棒杆菌HA产量达74.1 g/L,产物分子量为53 kDa。
3 多酚类化合物的生物合成植物中富含各种天然活性物质,不仅能够促进皮肤健康,还能保护皮肤免受紫外线、自由基等伤害[47]。多酚类化合物是其中一类重要的活性化合物,它们在分子结构中存在多个羟基与芳香基团相结合,清除体内过多的自由基,具有很强的抗氧化活性[48]。红景天苷、熊果苷、阿魏酸、白藜芦醇等已经被广泛应用于化妆品中,且在微生物合成方面也取得了很大的进展。
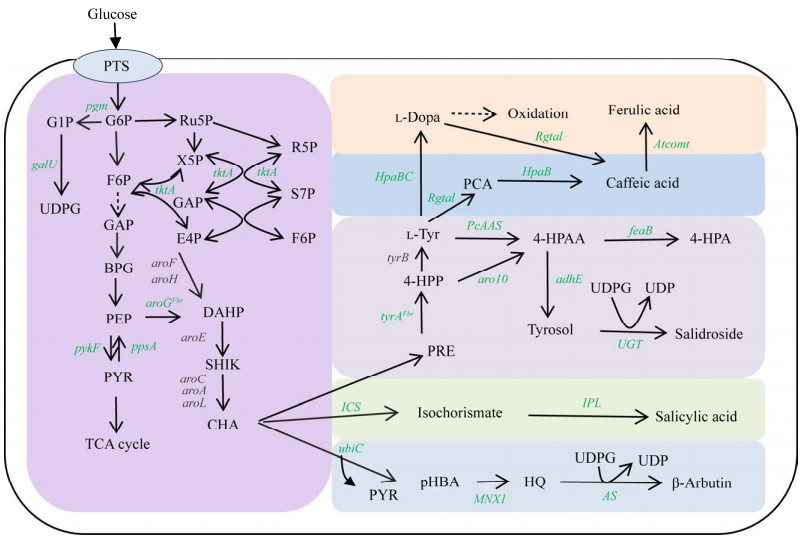
多酚类化合物的生物合成大多来源于莽草酸途径的中间体或芳香族氨基酸。莽草酸途径由中心代谢途径的D-赤藓糖-4-磷酸(4-phosphate erythritol, E4P)和磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)缩合,经3-脱氧-δ-阿拉伯糖庚酮糖-7-磷酸合酶(3-deoxy-D-arabino-heptulosonate 7-phosphate synthase, DAHP synthase)催化,羟醛缩合生成DAHP,接着经6步酶催化反应合成分支酸,分支酸接着通过多步反应实现芳香族氨基酸的合成[49]。之后通过不同分支修饰酶类的催化,实现多酚类化合物的合成(图 3)。
|
| 图 3 医美中部分多酚类化合物的生物合成途径 Fig. 3 The biosynthetic pathways of polyphenolic compounds in cosmetics. PTS: Glucose transport pathway; G6P: 6-phosphoglucose; G1P: 1-Glucose phosphate; UDPG: UDP-glucose; F6P: 6-phosphofructose; GAP: Glyceraldehyde-3-phosphate ester; BPG: Diphosphoglycerate; PEP: Phosphoenolpyruvate; PYR: Pyruvate; Ru5P: 5-phosphoribose; R5P: 5-phosphoribose; X5P: 5-phosphoxylulose; S7P: 7-phosphodoheptanose; E4P: 4-phosphate erythritol; DAHP: 3-deoxy-D-arabinogenose-7-phosphate; SHIK: Shikimic acid; CHA: chorismic acid; TYR: Tyrosine; 4HPA: 4-hydroxyphenylacetic acid; 4HPP: 4-hydroxyphenylpyruvate; 4HPAA: Hydroxyphenylacetaldehyde; PCA: p-coumaric acid; PHBA: p-hydroxybenzoic acid; HQ: Hydroquinone; L-Dopa: Levodopa; PGM: Phosphoglucose mutase; GalU: Glucose-1-phosphate uridyltransferase; PykF: Pyruvate kinase; TktA: Transketolase I; AroGfbr: 3-deoxy-7-phosphate heptanate synthase; AroL: Mangiferate kinase II; AroE: Mangiferate dehydrogenase; AroA: 3-Phosphate shikimate 1-carboxyethyltransferase; AroC: Chorionic synthase; UbiC: Chorionic lyase; MNX1: 4-hydroxybenzoate 1-hydroxylase; AS: Arbutin synthase; UGT: Uridine diphosphate glucuronic acid transferase; AdhE: A bifunctional enzyme (aldehyde dehydrogenase and ethanol dehydrogenase); Aro10: Phenylpyruvate decarboxylase; ICS: Isobranched acid synthase; IPL: Isobranched pyruvate lyase; TyrA: Tyrosinase; TyrB: Tyrosine synthetase B; HpaBC: Hydroxyphenylpyruvate synthase; FeaB: Phenylacetaldehyde dehydrogenase; Atcomt: Caffeic acid O-methyltransferase; Rgtal: Tyrosine ammonia lyase. |
| |
红景天苷(salidroside)是红景天的主要活性成分之一,具有抵抗紫外线辐射、阻碍黑色素合成、消除自由基的作用,是重要的医美活性成分。目前红景天苷主要来自于植物提取,但由于红景天生长环境的特殊性和有限的植物资源,过度采摘会对生态造成不可修复的破坏。因此,近年来很多研究已经致力于使用微生物合成红景天苷,以满足市场需求[50]。
红景天苷由UDP-葡萄糖(UDP glucose, UDPG)和酪醇脱水缩合生成[51-52]。酪醇在生物体内有3条合成路线。第一条途径是酪氨酸通过芳香醛合成酶(aromatic aldehyde synthase, AAS)直接转化为4-羟基丙烯酸[53],后者被醇脱氢酶(alcoholdehydrogenase, ADH)还原为酪醇,酪醇经过糖基化反应生成红景天苷,该途径在红景天、香芹等植物中广泛存在[54]。第二条途径是存在于酿酒酵母中的埃里希(Ehrlich)途径,该途径是酪氨酸前体物质4-羟基苯基丙酮酸(4-hydroxyphenylpyruvate, 4HPP),在苯丙酮酸脱羧酶(phenylpyruvate decarboxylase, Aro10)催化下4HPP直接转化为4-羟基苯乙醛(4-hydroxyphenylacetaldehyde, 4-HPAA)。4-HPAA被醇脱氢酶转化为酪醇,后者再在糖基转移酶催化下生成红景天苷(图 3)。第三种途径是酪氨酸在脱羧酶催化下生成酪氨,后者被氧化酶催化为4-HPAA,随后在醇脱氢酶作用下生成酪醇,再经糖基转移酶催化合成最终产物红景天苷。红景天苷在微生物中的合成已经取得了很大进展,本课题组通过代谢工程改造大肠杆菌,解除代谢途径的反馈抑制DAHP合成酶(aroGfbr)和酪氨酸酶(tyrosinase, tyrAfbr),敲除竞争途径苯丙氨酸和色氨酸合成途径中的分支酸变位和预苯酸脱水双功能酶(chorismate mutase/prephenate dehydratase, pheA)和蒽酸磷酸核糖转移酶(anthranilate phosphoribosyltransferase, trpD),增加前体供应,并引入外源基因PcAAS、Aro10和葡萄糖基转移酶基因(UDP-glycosyltransferase 85A1, UGT85A1),最终在5 L发酵罐中,实现红景天苷的产量2.2 g/L,酪醇产量7.18 g/L[55]。Liu等[56]设计构建了一种双菌共培养生产红景天苷的方法,其中一个菌株是苯丙氨酸缺陷型的糖苷配基菌株(aglycone, AG),以木糖为原料用于生产酪醇,另一个是以葡萄糖为原料的酪氨酸缺陷的糖苷菌株(glycoside, GD),用于合成UDPG,将两种大肠杆菌共培养,最终AG菌株和GD菌株分别以木糖和葡萄糖为原料,共同合成红景天苷,分批补料发酵的产量为6.03 g/L。此外,Liu等[57]在酿酒酵母中通过解除中间物酪氨酸等对关键酶Aro4K229L、分支变位酶(chorismate mutase, Aroh)和Aro7G141S的反馈抑制,过表达rki1和tkl1基因,增加前体供应,同时敲除竞争性途径的pha2和pdc1,筛选高转化率的糖基转移酶(glycosyltransferase, RrU8GT33opt),最终菌株在5 L发酵罐中生产酪醇和红景天苷的产量分别为(9.90±0.06) g/L和(26.55±0.43) g/L,这是目前微生物细胞工厂中的最高水平。
3.2 熊果苷的生物合成熊果苷(arbutin)是一种对苯二酚葡萄糖苷化合物,能抑制黑色素的生成,具有抗氧化、抗炎和美白等生物活性,因此在医药和化妆品领域备受关注。熊果苷有α和β两种构型,其中α-熊果苷的美白效果是β-熊果苷的10倍以上。β-熊果苷可以通过化学合成法、天然植物提取法、植物细胞培养法和微生物发酵或酶转化法制备,α-熊果苷一般只能通过微生物发酵法或酶催化法制备[58]。熊果苷能够被α-淀粉酶、蔗糖磷酸化酶和α-葡萄糖苷酶等催化合成,但是活性普遍较低。2012年一种淀粉蔗糖酶(amylosucrase, DGAS)被报道,可以催化蔗糖和氢醌合成熊果苷,而且在坏血酸存在的情况下,转化率可达90%,然而在缺乏坏血酸的情况下,转化率仅1.3%[59]。2018年,一种碳化纤维单胞菌(Cellulomonas carboniz)中的T26淀粉蔗糖酶(CcAS)被鉴定,底物浓度为20 mmol/L蔗糖和5 mmol/L氢醌,在pH 7.0、温度40 ℃条件下,不添加抗坏血酸,2 h可实现基于氢醌的40%–44.7%的α-熊果苷摩尔转化率[60]。尽管如此,熊果苷的产量仍然相对较低,为了进一步提高熊果苷的产量,Shen等[61]通过强化内源的莽草酸途径,强化前体对羟基甲酸的合成,引入外源的4-羟基苯甲酸酯1-羟化酶(4-hydroxybenzoate 1-hydroxylase, MNX1)、熊果苷合酶(arbutin synthase, AS)生成β-熊果苷,摇瓶产量达到4.19 g/L,实现了大肠杆菌β-熊果苷的从头合成(图 3)。An等[62]通过增强PEP和UDPG两个前体的供应,并通过O-乙酰基转移酶,去除副产物,最终获得43.79 g/L的β-熊果苷。同时,Zhou等[63]在大肠杆菌中通过敲除蔗糖6-果糖基转移酶(levansucrase, SacB)、细胞外柠檬酶(extracellular levanase, SacC)、内切酶(endolevanase, LevB)和蔗糖6磷酸水解酶(sucrose-6-phosphate hydrolase, SacA),开发了一种可诱导的蛋白降解系统Lon protease控制6-磷酸果糖激酶(6-phosphofructokinase, PfkA)的活性,进而促进更多的葡萄糖-6-磷酸转化为葡萄糖-1-磷酸,同时过表达葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase, Pgi)和磷酸葡萄糖变位酶(phosphoglucomutase, PgcA),使α-熊果苷的产量达120 g/L,蔗糖的转化率达到60.4% (mol/mol)。
3.3 阿魏酸的生物合成阿魏酸(ferulic acid)是一类广泛存在于植物中的酚酸类化合物,具有很强的抗氧化和抗菌能力[63-64]。阿魏酸主要是从碱水解或酯酶处理的植物原料(如当归、阿魏、女贞、小麦、米糠等)中提取,其中小麦和米糠是商业阿魏酸的主要来源,但这些过程下游处理需要昂贵的膜分离过程。微生物合成阿魏酸的案例较少,产量较低。目前人工合成阿魏酸主要在E. coli中进行(图 3),是在酪氨酸经酪氨酸胺裂解酶(tyrosine ammonia lyase, TAL)、4-香豆酸-3-羟化酶(p-coumarate 3-hydroxylase, Sam5)和咖啡酸O-甲基转移酶(caffeic acid-O-methyltransferase, COMT)的作用下合成[65]。Choi等[66]过表达来自糖丝菌(Saccharothrix espanaensis)的TAL、S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)和来自拟南芥(Arabidopsis thaliana)的COMT,阿魏酸的产量为(7.1±1.3) mg/L。Lv等[67]通过过表达tal、sam5和comt在大肠杆菌中构建阿魏酸异源合成途径,并过表达zwf、6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase, gnd)、异柠檬酸脱氢酶(isocitrate dehydrogenase, icd)和转氢酶(transhydrogenase, pntAB)等烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)再生的酶以及合成SAM的甲硫氨酸转移酶(methionine adenosyltransferase, MetK),最终阿魏酸的产量为(207.3±2.9) mg/L。接着2022年,Zhou等[68]构建阿魏酸异源合成菌株,并降低酪氨酸羟化酶(tyrosine hydroxylase, HpaBC)的活性,融合表达黄素还原酶,促进还原型黄素腺嘌呤二核苷酸(flavine adenine dinucleotide, FADH2)的再生,改造酪氨酸合成途径过表达基因tyrAfbr、磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, ppsA)基因、转酮醇酶(transketolase I, tktA)基因和aroGfbr,删除2个丙酮酸激酶编码基因(pyruvate kinase, pykA and pykF)和pheA,提高前体物质的供应,最终经过分批补料发酵后,阿魏酸的产量达到5.09 g/L。
3.4 水杨酸的生物合成水杨酸(salicylic acid,SA)是一种天然存在的活性化合物,是莽草酸途径下游产物分支酸异化后的裂解产物(图 3),被广泛用于化妆品和制药行业,可作为护肤品的成分以及阿司匹林和抗艾滋病药物的前体[69]。
Liu等[70]利用E. coli ATCC31884,将启动子T7控制的SA生物合成模块整合到大肠杆菌染色体上,通过干扰pheA和tyrA消除了苯丙氨酸和酪氨酸的积累,增强aroG的表达并强化上游途径,敲除基因pykA和pykF以保存PEP,最终SA摇瓶产量为(1560.6±50.2) mg/L。Zhang等[71]以E. coli MG1655-U7为底盘菌株,过表达来自嗜甲基拟无枝酸菌(Amycolatopsis methanolica)的水杨酸合成酶(salicylate synthase, AmS),SA产量达到(421.2±42.1) mg/L。李若松等[72]以E. coli Tyr002为出发菌株,将铜绿假单胞菌(Pseudomonas aeruginosa)的异分支酸裂解酶基因(isochorismate pyruvate lyase, pchB)整合在大肠杆菌基因组plf B位置,过表达水杨酸合酶基因(Isochorismate synthase, entC),敲除异分支酸裂解酶基因(bifunctional isochorismate lyase, EntB)和TyrA,摇瓶发酵SA产量为1.05 g/L。
4 萜类化合物的生物合成萜类化合物(terpenes)是指萜烯及其官能化衍生物,广泛存在于植物、海洋生物及微生物中,包括单萜、倍半萜、二萜和三萜等[73]。自然界中已统计的萜类化合物大于70 000种,具有抗肿瘤、抗氧化以及增强免疫力等多种药理作用,广泛应用于医药、食品、香精香料和化工等领域[74]。其中角鲨烯、视黄醇、虾青素、红没药醇等因其具有很强的抗氧化、抗自由基、调节皮肤代谢、促进皮肤健康等功能,被广泛应用于化妆品中。传统上,萜类化合物主要通过植物提取和化学合成获得,但是植物提取会消耗很多植物资源且目标化合物难分离,而化学法过程繁琐、易产生污染,因此微生物合成是一种有潜力的合成替代方法[75-76]。
萜类化合物的生物合成途径已经被揭示,主要包括甲羟戊酸(mevalonate, MVA)途径和2-C-甲基-D-赤藓糖醇-4磷酸(methylerythritol 4-phosphate, MEP)途径两种。在细菌、蓝细菌等微生物中主要以MEP途径合成,在酵母、真菌、植物等高等生物中主要以MVA途径合成。MVA途径和MEP途径均能够合成异戊烯基焦磷酸(isopentenyl pyrophosphate, IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate, DMAPP)这两种物质。在MVA途径中,2分子乙酰辅酶A在乙酰乙酰辅酶A硫解酶(acetyl-CoA acetyltransferase 1, ACAT1)以及羟甲基戊二酰辅酶A合酶(hydroxymethylglutaryl-CoA synthase, HMGS)作用下催化生成3-羟基-3-甲基乙酰辅酶A (3-Hydroxy-3-methylglutaryl-coenzyme A, HMG-CoA),随后通过重要的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase, HMGR)生成关键中间体甲羟戊酸,并通过焦磷酸化、脱羧化和脱水生成IPP。IPP和DMAPP在异戊烯焦磷酸异构酶(isopente-nyl pyrophosphate isomerase, IDI)的作用下相互转换,接着IPP和DMAPP在香叶基焦磷酸合成酶(geranylpyrophosphate synthase, GPPS)的催化作用下生成香叶基焦磷酸(geranyl pyrophosphate, GPP),法尼基焦磷酸合成酶(farnesyl pyrophosphate synthase, FPPS)可催化GPP转变为法尼基焦磷酸(farnesyl pyrophosphate, FPP),不同萜类化合物则在GPP和FPP的基础上继续合成(图 4)。目前萜类化合物生物合成的调整策略主要包括限速步骤的优化、辅因子NADPH的调控和中心碳途径的强化等[77]。

|
| 图 4 部分萜烯类活性成分的生物合成途径 Fig. 4 The biosynthetic pathways of some terpenes in cosmetics. HMG CoA: 3-hydroxy-3-methylglutarate monoacyl CoA; IPP: Isoprene pyrophosphate; DMAPP: Dimethylallyl pyrophosphate; FPP: Farnesyl pyrophosphate; GGPP: Geranylgeranyl pyrophosphate; MrBBS: α-Red myrrh alcohol synthase; Hsqs: Squalene synthase; PSPP: Pre squalene diphosphate; Blh: β-Carotene 15, 15′-oxidase; Ybbo: Retinol reductase; CrtE: GGPP synthase; CrtB: Eight hydrogen lycopene synthase; CrtI: Octahydrolycopene dehydrogenase; CrtY: Lycopene β-cyclizing enzyme; CrtZ: β-Carotene hydroxylase; CrtW: β-Carotene ketolase. |
| |
角鲨烯(squalene)是由6种异戊二烯组成的不饱和三萜化合物,具有多种共轭和不饱和双键,具有优异的抗氧化性能,可用于制造抗衰老和抗皱化妆品[78]。2014年,全球角鲨烯市场需求约为26.7万t,预计到2023年市场规模会达到2.419亿美元,其中主要收入来自个人护理产品和化妆品[79]。几十年来,鲨鱼肝脏一直是角鲨烯产生的主要来源,尽管鲨鱼中角鲨烯含量丰富,但是考虑到对鲨鱼资源和海洋环境的保护,此方法具有不可持续性;从植物橄榄油中也可提取角鲨烯,但产率仅为5.69 mg/g DCW,且含量低、提取工艺复杂,不适合大规模生产[6]。角鲨烯的化学合成非常复杂(7步),产率低,仅限于实验室规模。微生物合成角鲨烯已经取得了较大的进展,主要包括增强代谢通量、增加辅助因子水平、修饰关键酶等。
Tang等[80]探索了不同提高乙酰辅酶A水平的策略,包括过表达柠檬酸裂解酶(ATP-citrate lyase, ACL)和乙酰辅酶A合成酶(acyl coenzyme A synthetase, ACS)促进碳通量流向乙酰辅酶A,敲除柠檬酸合酶(citrate synthase 2, CIT2)和苹果酸合成酶(malate synthase 1, MLS1)减少乙酰辅酶A进入竞争途径,过表达截短的HMGR,更稳定高效地将乙酰辅酶A引入角鲨烯的生物合成,经过发酵工艺优化后,角鲨烯产量达到10 mg/g DCW,是野生型的50倍。此外,在培养基中加入柠檬酸钠,通过柠檬酸裂解酶转化为草酰乙酸和乙酰辅酶A,为目标产物的合成提供前体库,最终角鲨烯产量达到731.18 mg/L。
一般来说,合成1分子角鲨烯需要3分子DMAPP和3分子IPP (图 4)。在酵母中通过MVA途径产生1分子IPP或DMAPP需要2分子NADPH作为还原辅因子。因此,充足的NADPH供应对提高角鲨烯的生产效率至关重要。Paramasivan等[81]在酿酒酵母中过表达HMGR促进萜类的合成,过表达NADH激酶(NADH kinase, pos5)促进NADPH再生,最终角鲨烯的产量提高26.5倍。Xu等[82]在大肠杆菌中过表达限速酶IDI、1-脱氧木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase, DXS)和FPP,并过表达吡啶核苷酸转氢酶(soluble pyridine nucleotide transhydrogenase, UdhA)改良NADPH/NADP+的比例,同时用2-酮-3-脱氧-6-磷酸葡糖酸途径(2-keto-3-deoxy-6-phosphogluconate pathway, EDP)和磷酸戊糖途径(pentose phosphate pathway, PPP)替代糖酵解(glycolytic pathway)强化异戊烯焦磷酸途径,并过表达限速酶Zwf和6-磷酸葡萄糖酸内酯酶(6-phosphogluconolactonase, pgl),最终角鲨烯的产量可达28.5 mg/g DCW和52.1 mg/L。角鲨烯在细胞内积累会对细胞造成一定的伤害,因此区室化研究成为提高角鲨烯产量的一个策略。Liu等[83]通过在酿酒酵母中整合角鲨烯合成途径、引入HMG-CoA还原酶和替换角鲨烯环氧酶基因ERG1启动子,使角鲨烯产量达到(321.08±18.78) mg/g DCW,接着利用过氧化物酶体作为角鲨烯合成场所,过表达异柠酸脱氢酶(isocitrate dehydrogenase 2/3, idp2/idp3)和腺苷酸转运体(adenine nucleotide translocator 1, ANT1)提高NADPH和ATP供给,改造乙酰辅酶A代谢途径,提高乙酰辅酶A供给,最终使角鲨烯产量达到1 312.82 mg/L,最终通过细胞质和过氧化物酶体的双重工程化和分批发酵,角鲨烯的产量达到11.0 g/L;接着,该课题组利用细胞质和线粒体工程组合的策略,减少线粒体中区域化MVA通路引起的代谢负担,同时提高细胞质代谢途径的通量,经过两阶段发酵过程,角鲨烯产量达到21.10 g/L[84]。2023年,Amyris公司以甘蔗为底物发酵生成反式β-法尼烯,开发了一种千克级角鲨烯的半合成路线,通过对反应和工艺的优化,从而合成了纯度约为90%的角鲨烯,角鲨烯因其特异的物理化学性质和生物活性,是理想的疫苗佐剂,该产品也达到了当前药典对疫苗的标准要求[85]。
4.2 视黄醇的生物合成视黄醇(retinol, A醇),是脂溶性维生素A家族一员,具有调节皮肤代谢、促进胶原蛋白合成、抗氧化、抗自由基、修复、美白等功效,是目前市场认可度较高的抗衰老成分之一,广泛用于保健品、化妆品和医药领域[86]。2020年,全球视黄醇市场规模达到46亿元,2026年将达到63亿元,年复合增长率为4.5%[87]。目前,视黄醇商业生产方法是化学合成,需要使用石油基化学品(如丙酮和乙炔)进行酸化和水解,然后纯化去杂质,显著增加了纯视黄醇的生产成本。
视黄醇在微生物中合成多以混合物存在,包括视黄醇、视黄醛和视黄酸。视黄醇合成的直接前体视黄醛,是由β-胡萝卜素-15, 15′-单(双)加氧酶[β-carotene-15, 15′-mom(di)oxygenase, BCM(D)O]催化β-胡萝卜素产生,视黄醛可以分别通过生物还原或氧化反应转化为视黄醇和视黄酸(图 4)。β-胡萝卜素是由3分子IPP和1分子DMAPP组成。Jang等[88-89]在重组大肠杆菌中引入外源MVA途径和异源BCM(D)O,并在培养基中加入十二烷,通过双相发酵最终获得136 mg/L类视黄醇,包括67 mg/L视黄醛、54 mg/L视黄醇和15 mg/L乙酸视黄酯。为了去除类视黄醇,研究者在上述菌株中敲除乙醛脱氢酶基因(acetaldehyde dehydrogenase, eutE)、γ-谷氨酰-γ-氨基丁醛脱氢酶基因(gamma-glutamyl-gamma- aminobutyraldehyde dehydrogenase, puuC)和过表达NADP(+)依赖性醛还原酶基因[NADP(+)-dependent aldehyde reductase, ybbO]和氯霉素抗性基因(chloramphenicol acetyltransferase, cat),最终获得76 mg/L视黄醇。酿酒酵母拥有内源性MVA途径,是生产视黄醇的理想底盘[88]。Sun等[86]使用木糖作为碳源,将β-胡萝卜素生物合成途径中香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthase, crtE)、番茄红素脱氢酶(phytoene desaturase, crtI)和番茄红素环化酶(phytoene synthase, crtYB) 基因以及bcmo基因引入酿酒酵母菌株,并采用十二烷或橄榄油作为提取剂进行双相原位提取,最终产生维生素A为3 350 mg/L,其中包括视黄醛2 094 mg/L和视黄醇1 338 mg/L。Lee等[90]将来自人类和大肠杆菌的氧化还原酶基因(retinol dehydrogenase 10, rdh10)和ybbO引入酿酒酵母,以木糖为碳源,发现视黄醇的产量均显著提升,但仍有大量的视黄醛产生,而当引入人类rdh12基因时,视黄醇产量提高到97.09 mg/L,几乎没有视黄醛被检测,但是细胞内氧化还原水平失衡,当引入乳酸乳球菌(Lactococcus lactis)中NADH氧化酶(NADH oxidase, noxE)时,解决了氧化还原失衡,视黄醇产量达到123.1 mg/L。由于视黄醇的不稳定性,温度、光照和抗氧化剂等培养条件也被用于优化视黄醇的生产。解脂耶氏酵母(Yarrowia lipolytica)是一种含油性酵母,细胞质中乙酰辅酶A丰富,该化合物合成油脂和萜类化合物的常用前体[88]。研究者首先构建了Y. lipolytica生产β-胡萝卜素菌株,并在其中插入11个拷贝的来自海洋细菌66A03 (Marinobacter hydrocarbonoclasticus Blh, Mb.Blh)的β类胡萝卜素裂解加氧酶(beta-carotene oxygenase, bco)基因,添加抗氧化剂丁基羟基甲苯(Butylated Hydroxytoluene, BHT)并过表达谷胱甘肽合成酶基因(glutathione synthetase, gsh2),并结合BHT处理和吐温80萃取,在5 L发酵罐中通过分批补料发酵生产4.86 g/L视黄醇和0.26 g/L视黄醛,这是目前报道的最高产量[91]。
4.3 虾青素的生物合成虾青素(astaxanthin)是一种橙红色的类胡萝卜色素,具有很强的抗氧化活性,在食品、医疗、化妆品等多种领域应用广泛。其生物合成途径由葡萄糖开始,经过糖酵解途径、MVA途径、脂肪酸途径,生成前体β-类胡萝卜素,最后在β-胡萝卜素酮醇酶(β-carotene ketolase, CrtW)和β-胡萝卜素羟化酶(β-carotene hydroxylase, CrtZ)的作用下生成虾青素(图 4)[92]。
Jia等[93]利用红发夫酵母(Phaffia rhodozyma) AS2.1557,通过添加0.5 mg/L外源水杨酸,并过表达多胺转运蛋白(polyamine transport protein, PT)基因,使得虾青素的产量达到2.3 mg/L;Pan等[94]利用红发夫酵母(Xanthophyllomyces dendrorhous) UV3-721,添加3 g/L的柠檬酸钠,过表达参与虾青素生物合成途径中的异柠檬酸酶基因(isocitrate lyase, icl)、hmgs、crtE、crtYB、crtI和虾青素合酶基因(astaxanthin synthase, crtS),摇瓶培养24 h时虾青素产量为22.5 mg/L,在5 L发酵罐中分两组进行分批发酵,120 h产量达到44.2 mg/L;Liu等[95]以红发夫酵母CBS6938为出发菌株,添加500 mg/L赤霉酸(gibberellic acid, GA),GA诱导增加了脂肪酸去饱和酶和ABC转运蛋白基因的表达,从而促进虾青素的产生,其产量达到539.76 μg/g;Ma等[92]采用Y. lipolytica细胞器区室化的方法生产虾青素,首先,用酶融合的方法将来源于伊氏副球菌(Paracoccus)的CrtW和雨生红球藻(Haematococcus pluvialis)的CrtZ融合起来,并将融合酶的虾青素生物合成途径导入到亚细胞区室,同时将该酶锚定到脂肪体、内质网或过氧化物酶体3个细胞器中,产量显著增加,补料分批发酵中产生了858 mg/L的虾青素。
5 D-泛酸的生物合成D-泛酸(D-pantothenic acid, D-PA),也被称为维生素B5或遍多酸,是一种水溶性维生素,参与生物体的能量代谢、信号转导和表观遗传等过程,具有重要的生理生化功能,已被广泛应用于食品、饲料、化妆品和医疗等领域[96-100]。D-泛酸的合成方法主要包括化学合成法、化学酶法和生物发酵法,其中,化学酶法和生物发酵法是目前D-泛酸生产的主要方法。化学酶法中D-泛酸的合成前体D-泛解酸内酯是通过D-泛解酸内酯水解酶选择性水解拆分D, L-泛解酸内酯成D-泛解酸,再经内酯化生成,留下的L-泛解酸内酯经化学消旋化为D, L-泛解酸内酯重新进入拆分循环[101]。最后,β-丙氨酸与D-泛解酸内酯通过酯化形成D-PA。尽管如此,这些方法过程复杂且对环境不友好,生物发酵法则相对简单且环境友好。
D-泛酸的生物发酵法已经取得了很大的进展且已经实现产业化。Huser等[102]通过敲除谷氨酸棒杆菌中的苏氨酸脱氨酶基因(threonine deaminase, ilvA)阻断异亮氨酸的合成,并大量表达ilvBNCD基因合成乙酰羟基酸合成酶(acetohydroxyacid synthase, AHAS)、乙酰羟酸异构还原酶(acetohydroxyacid isomeroreductase, AHAIR)和二羟基酸脱水酶(dihydroxy acid dehydratase, DHAD),增加panBC操纵子拷贝数过表达酮泛解酸羟甲基转移酶(ketopantoate hydroxymethyltransferase, panB)和泛酸合成酶(pantothenate synthetase, panC),增强酮异戊酸和D-泛酸的合成,通过分批补料发酵,最终D-PA的产量达到8 mmol/L。Yocum等[103]以枯草芽孢杆菌为底盘细胞,通过代谢工程构建D-PA生产菌株,并在此菌株的基础上,进一步强化编码丝氨酸羟甲基转移酶(glycine hydroxymethyltransferase, glyA)的表达水平,提高亚甲基四氢叶酸的供应,并通过外源添加β-丙氨酸,使D-PA的产量达到86 g/L。本课题组对大肠杆菌生产D-PA的研究也取得了较大的进展并与公司合作实现产业化。具体包括:Zhang等[104]在大肠杆菌中通过CRISPR-Cas9技术强化前体供应、减弱竞争途径等策略,实现D-PA的产量达28.45 g/L。Zou等[105]进一步利用统计优化技术等策略对D-PA的发酵条件进行优化,并加入异亮氨酸到5 L发酵罐中,D-泛酸的产量达到31.6 g/L。之后Qin等[106]对D-PA的发酵过程进行优化,包括使用pH反馈补料和β-丙氨酸的梯度流加等策略,在5 L发酵罐中发酵生产D-泛酸48.21 g/L,糖酸转化率达0.33 g/g DCW。
6 抗坏血酸的生物合成抗坏血酸(ascorbic acid,AsA)又被称为维生素C,具有美白、抗氧化以及促进胶原蛋白合成等功效,在生物体内有2种构型:L-型和D-型,其中L-型是一种常见的水溶性抗氧化剂。抗坏血酸在植物中可以合成,而在人体以及动物体内因缺乏合成AsA关键酶——L-古洛糖内酯氧化酶所以不能合成抗坏血酸,只能从外界摄取[107]。
目前AsA需求量在每年15万t以上,超过其他所有维生素类产品总和,且每年以10%左右的增速持续增长。由于其化学性质的不稳定性,工业上都是合成其前体物质2-酮基-L-古龙酸(2-keto-L-gulonic acid, 2-KLG),再酯化,实现AsA的大规模生产[108]。目前,KLG的生产首先通过高压加氢的方式将葡萄糖转化为山梨醇,再通过氧化葡萄糖酸杆菌将山梨醇转化为山梨糖,最后通过普通生酮基古龙酸菌(Ketogulonigenium vulgar)和巨大芽孢杆菌(Bacillus megaterium)混合发酵的方式将山梨糖转化为2-KLG[109]。从葡萄糖经2, 5-二酮基-D-葡萄糖酸(2, 5-diketo-D-gluconic acid, 2, 5-DKG)合成2-KLG,是合成维生素C的理想路径[110]。近期,氧化葡萄糖酸杆菌(Gluconobacter oxydans) ATCC9937被揭示可以直接合成2-KLG,而且新的DKG还原酶(DKG reductase, DKGR)、2, 5-DKG转运体和整个2-KLG合成途径被解析,最终在5 L发酵罐中2-KLG的产量达30.5 g/L[111]。
在酵母中虽然不能合成抗坏血酸,但是可以合成一种与抗坏血酸结构和功能特别相近的物质——D-赤藓抗坏血酸[112]。为提高酵母生产AsA的能力,许多研究都是通过导入外源基因进去使其获得生产AsA的作用。Sauer等[113]发现过表达芽殖酵母细胞内源性D-阿拉伯糖酸-1, 4-内酯氧化酶和异源表达来自拟南芥的L-半乳糖脱氢酶能够使其以L-半乳糖或者L-半乳糖-1, 4-内酯为底物生产L-抗坏血酸(L-ascorbic acid, L-AA),达100 mg/(L·OD)。Branduardi等[114]将来源于拟南芥的编码GDP-甘露糖-3, 5-差向异构酶(GDP-mannose-3′, 5′-epimerase, GME)的基因gme、GDP-L-半乳糖磷酸化酶(GDP-L-galactose phosphorylase, GGP)的基因vtc2和L-半乳糖1-磷酸磷酸酶(L-galactose-1-phosphate phosphatase, GPP)的基因vtc4在酿酒酵母中异源表达,同时将拟南芥来源的编码合成L-AA的最后两步反应酶的基因导入细胞,成功在酿酒酵母中重构植物合成L-AA路径,首次得到能以D-葡萄糖为底物合成L-AA的酵母菌株,产量达45 g/L。Rosa等[115]将来源于拟南芥的gme、vtc2和vtc4导入乳酸克鲁维酵母,使其能以D-半乳糖为底物生产达30 mg/L的L-AA。2-氧-D-吡喃型葡萄糖基-L-抗坏血酸(2-O-D-glucopyranosyl-L-ascorbic acid, AA-2G),是一种抗坏血酸的衍生物,环糊精糖基转移酶(cyclodextrin glucosetransferase, CGTase)是用于合成AA-2G的酶之一。Zhang等[116]首次用重组大肠杆菌表达来源于浸麻类芽胞杆菌(Paenibacillus macerans)的CGTase合成AA-2G,并对酶反应条件进行优化,AA-2G产量达到13 g/L,随后,用海藻酸钠固定后的CGTase合成AA-2G,产量达到21 g/L。
7 总结与展望随着现代生活水平的提高,人们对美容和健康的要求越来越高,护肤也已经从传统的表面护肤转向功效护肤。由于医美活性成分作用于皮肤,能够起到良好的保湿、修复、美白、抗衰、支撑等作用,因此其需求量越来越大。目前动植物提取和化学合成已无法满足当今人们对产品的要求和需求。微生物合成技术(代谢工程、系统生物学、合成生物技术和蛋白质工程等)和人工智能的发展,为医美活性成分生物合成提供了新思路,而且很多产品已经在工业上实现微生物发酵生产,如重组胶原蛋白、透明质酸、泛酸、红景天苷、角鲨烯等。但是随着社会的发展,尤其是对产品纯度、品质、种类、作用等要求的逐步提升,绝大多数的微生物工业化生产还在发展过程中。在微生物合成的过程中,通过菌种改良,生物发酵产品的产量和纯度可以实现显著提高;通过高通量挖掘和蛋白质工程改造催化剂的催化效率、适应性和多样性,酶催化产品的生产效率和种类可以实现显著提升;通过多组学分析联动系统生物学、代谢工程和合成生物学等,解析活性成分合成途径、创建人工合成途径、优化代谢调控,实现活性化合物的人工合成,活性成分产量可以实现显著提高,这些对于医美活性成分的产业化生产都具有巨大的推动作用。
尽管如此,在这些医美活性成分的合成应用过程中还存在一些问题亟待解决:(1) 活性成分的产量低、成本高是限制其产业化的关键因素。微生物合成产品过程中由于路线长、代谢途径调控多、修饰酶类活性低和适配性差等限制,在合成的过程中存在产物产量较低、异质性高等问题。因此,通过人工智能、多组学联合等技术探索高效合成路径,挖掘和改造特定修饰关键酶、建立特异的智能发酵工艺优化方法,推动成本低、产量高的活性成分的研发。(2) 活性成分的纯度和稳定性是影响其应用的关键。如透明质酸等多糖化合物以及植物源糖苷类化合物,因其在结构修饰和分子量上具有很大的差异而主要以混合物的形式存在,实现不同单一高纯度活性产品的生物合成至关重要。同时,挖掘和探究不同修饰酶,对活性基团进行修饰如交联、酯化等,使其具有更好的理化活性和抗酶解能力,以更好地适应环境,也是医美活性成分后期需要发展的方向之一。(3) 活性成分的种类仍有待开发。一方面可以开拓海洋、高山、极地等环境资源,挖掘更多的活性成分;此外,还可以通过计算生物学、定向进化、高通量筛选等拓宽底物的特异性和提高酶的活性,拓展合成化合物的种类。(4) 活性成分生产分离纯化工程一体化过程是影响其产业化的重要因素。在微生物合成过程中,如何实现产物的快速分离纯化,是影响产品质量和产业化率的关键。针对产品特征对产物分离纯化的整个过程甚至设备进行设计,既要将杂质与产物有效分开,同时又要避免产物在分离过程中失去生物活性,该过程也是决定活性成分生产产业化的关键。
随着生物科技和人工智能技术的发展,医美产品的生物制造将在医美活性成分种类、生产技术与设备以及分离纯化等方面实现智能一体化提升,与此同时,医美产品生物制造的标准化过程也需与时俱进、规范标准,使现代医美产品真正为人们的健康和美带来更多更优质的选择。
| [1] |
中国医疗美容行业研究报告; proceedings of the 2022艾瑞咨询11月研究报告会[C]. 上海, 2022.
|
| [2] |
夏天, 许文君. 护肤品未来技术路线之争[J]. 日用化学品科学, 2022, 45(4): 1-3. XIA T, XU WJ. Battle over the cosmetic technological route in future[J]. Detergent & Cosmetics, 2022, 45(4): 1-3 (in Chinese). DOI:10.3969/j.issn.1006-7264.2022.04.001 |
| [3] |
DHAPTE-PAWAR V, KADAM S, SAPTARSI S, KENJALE PP. Nanocosmeceuticals: facets and aspects[J]. Future Science OA, 2020, 6(10): FSO613. DOI:10.2144/fsoa-2019-0109
|
| [4] |
《2023年化妆品原料成分趋势报告》[M]. 用户说, 2023.
|
| [5] |
MARCHEV AS, DINKOVA-KOSTOVA AT, GYÖRGY Z, MIRMAZLOUM I, ANEVA IY, GEORGIEV MI. Rhodiola rosea L. : from golden root to green cell factories[J]. Phytochemistry Reviews, 2016, 15(4): 515-536. DOI:10.1007/s11101-016-9453-5
|
| [6] |
POPA O, BĂBEANU NE, POPA I, NI\U021BĂ S, DINU-PÂRVU CE. Methods for obtaining and determination of squalene from natural sources[J]. BioMed Research International, 2015, 2015: 367202.
|
| [7] |
AVILA RODRÍGUEZ MI, RODRÍGUEZ BARROSO LG, SÁNCHEZ ML. Collagen: a review on its sources and potential cosmetic applications[J]. Journal of Cosmetic Dermatology, 2018, 17(1): 20-26. DOI:10.1111/jocd.12450
|
| [8] |
SAXENA T, KARUMBAIAH L, VALMIKINATHAN CM. Proteins and poly(amino acids)[M]//Natural and Synthetic Biomedical Polymers. Amsterdam: Elsevier, 2014: 43-65.
|
| [9] |
SIONKOWSKA A, ADAMIAK K, MUSIAŁ K, GADOMSKA M. Collagen based materials in cosmetic applications: a review[J]. Materials, 2020, 13(19): 4217. DOI:10.3390/ma13194217
|
| [10] |
傅容湛, 范代娣, 杨婉娟, 陈亮, 曲词, 杨树林, 徐丽明. 重组胶原蛋白的产业发展历程和生物医学应用前景展望[J]. 生物工程学报, 2022, 38(9): 3228-3242. FU RZ, FAN DD, YANG WJ, CHEN L, QU C, YANG SL, XU LM. Industrial development and biomedical application prospect of recombinant collagen[J]. Chinese Journal of Biotechnology, 2022, 38(9): 3228-3242 (in Chinese). |
| [11] |
杨晶, 余洁莹, 王蒙, 吴少敏, 马毅, 王菊芳. 重组类人Ⅰ型胶原蛋白肽在大肠杆菌中的表达纯化及功能鉴定[J]. 现代食品科技, 2016, 32(2): 60-65. YANG J, YU JY, WANG M, WU SM, MA Y, WANG JF. Expression, purification, and functional characterization of recombinant human-like type Ⅰ collagen peptide in E. coli[J]. Modern Food Science and Technology, 2016, 32(2): 60-65 (in Chinese). |
| [12] |
LIU S, LI YM, WANG M, MA Y, WANG JF. Efficient coexpression of recombinant human fusion collagen with prolyl 4-hydroxylase from Bacillus anthracis in Escherichia coli[J]. Biotechnology and Applied Biochemistry, 2023, 70(2): 761-772. DOI:10.1002/bab.2396
|
| [13] |
VUORELA A, MYLLYHARJU J, NISSI R, PIHLAJANIEMI T, KIVIRIKKO KI. Assembly of human prolyl 4-hydroxylase and type III collagen in the yeast pichia pastoris: formation of a stable enzyme tetramer requires coexpression with collagen and assembly of a stable collagen requires coexpression with prolyl 4-hydroxylase[J]. The EMBO Journal, 1997, 16(22): 6702-6712. DOI:10.1093/emboj/16.22.6702
|
| [14] |
李伟娜, 尚子方, 段志广, 李林波, 贺婧, 范代娣. 毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能[J]. 生物工程学报, 2017, 33(4): 672-682. LI WN, SHANG ZF, DUAN ZG, LI LB, HE J, FAN DD. Production of gastric-mucosa protective collagen Ⅲ by Pichia pastoris[J]. Chinese Journal of Biotechnology, 2017, 33(4): 672-682 (in Chinese). |
| [15] |
侯增淼, 李晓颖, 李敏, 杨金芳, 杨小琳, 赵金礼. 重组人源性胶原蛋白的制备及表征[J]. 生物工程学报, 2019, 35(2): 319-326. HOU ZM, LI XY, LI M, YANG JF, YANG XL, ZHAO JL. Preparation and characterization of recombinant human-source collagen[J]. Chinese Journal of Biotechnology, 2019, 35(2): 319-326 (in Chinese). |
| [16] |
HUA C, ZHU Y, XU W, YE S, ZHANG RG, LU L, JIANG SB. Characterization by high-resolution crystal structure analysis of a triple-helix region of human collagen type III with potent cell adhesion activity[J]. Biochemical and Biophysical Research Communications, 2019, 508(4): 1018-1023. DOI:10.1016/j.bbrc.2018.12.018
|
| [17] |
GE Y, GUO GY, LIU KP, YANG F, YANG L, WANG YB, ZHANG XD. A strategy of functional crosslinking acellular matrix in blood-contacting implantable devices with recombinant humanized collagen type III (rhCOLIII)[J]. Composites Part B: Engineering, 2022, 234: 109667. DOI:10.1016/j.compositesb.2022.109667
|
| [18] |
ZHAO ZL, DENG JJ, FAN DD. Green biomanufacturing in recombinant collagen biosynthesis: trends and selection in various expression systems[J]. Biomaterials Science, 2023, 11(16): 5439-5461. DOI:10.1039/D3BM00724C
|
| [19] |
AGUILAR-TOALÁ JE, HERNÁNDEZ-MENDOZA A, GONZÁLEZ-CÓRDOVA AF, VALLEJO-CORDOBA B, LICEAGA AM. Potential role of natural bioactive peptides for development of cosmeceutical skin products[J]. Peptides, 2019, 122: 170170. DOI:10.1016/j.peptides.2019.170170
|
| [20] |
NGOC LTN, MOON JY, LEE YC. Insights into bioactive peptides in cosmetics[J]. Cosmetics, 2023, 10(4): 111. DOI:10.3390/cosmetics10040111
|
| [21] |
LIMA T, PEDRIALI MORAES C. Bioactive peptides: applications and relevance for cosmeceuticals[J]. Cosmetics, 2018, 5(1): 21. DOI:10.3390/cosmetics5010021
|
| [22] |
PICKART L, SCHAGEN S. New data of the cosmeceutical and tripeptide GHK[J]. SOFW-Journal, 2015, 141: 48-52.
|
| [23] |
SIMÉON A, EMONARD H, HORNEBECK W, MAQUART FX. The tripeptide-copper complex glycyl-L-histidyl-L-lysine-Cu2+ stimulates matrix metalloproteinase-2 expression by fibroblast cultures[J]. Life Sciences, 2000, 67(18): 2257-2265. DOI:10.1016/S0024-3205(00)00803-1
|
| [24] |
WANG Y, WANG M, XIAO SX, PAN P, LI P, HUO J. The anti-wrinkle efficacy of argireline, a synthetic hexapeptide, in Chinese subjects[J]. American Journal of Clinical Dermatology, 2013, 14(2): 147-153. DOI:10.1007/s40257-013-0009-9
|
| [25] |
CHASOVNIKOVA LV, FORMAZYUK VE, SERGIENKO VI, BOLDYREV AA, SEVERIN SE. The antioxidative properties of carnosine and other drugs[J]. Biochemistry International, 1990, 20(6): 1097-1103.
|
| [26] |
殷东亚, 潘江, 许建和. L-肌肽的酶法绿色合成[C]// 中国生物工程学会第十二届学术年会暨2018年全国生物技术大会论文集. 长沙, 2018: 92.
|
| [27] |
张扬, 杨倬, 喻子牛. 一种源于新型贝类的L-肌肽合成酶ATPGD及其应用: CN114196640A[P]. 2022-03-18.
|
| [28] |
HEYLAND J, ANTWEILER N, LUTZ J, HECK T, GEUEKE B, KOHLER HP E, BLANK LM, SCHMID A. Simple enzymatic procedure for L-carnosine synthesis: whole-cell biocatalysis and efficient biocatalyst recycling[J]. Microbial Biotechnology, 2010, 3(1): 74-83. DOI:10.1111/j.1751-7915.2009.00143.x
|
| [29] |
LIU YR, PAN XW, ZHANG HW, ZHAO ZQ, TENG ZX, RAO ZM. Combinatorial protein engineering and transporter engineering for efficient synthesis of L-Carnosine in Escherichia coli[J]. Bioresource Technology, 2023, 387: 129628. DOI:10.1016/j.biortech.2023.129628
|
| [30] |
HOVEMANN BT, RYSECK RP, WALLDORF U, STÖRTKUHL KF, DIETZEL ID, DESSEN E. The Drosophila ebony gene is closely related to microbial peptide synthetases and shows specific cuticle and nervous system expression[J]. Gene, 1998, 221(1): 1-9. DOI:10.1016/S0378-1119(98)00440-5
|
| [31] |
HARTWIG S, DOVENGERDS C, HERRMANN C, HOVEMANN BT. Drosophila Ebony: a novel type of nonribosomal peptide synthetase related enzyme with unusually fast peptide bond formation kinetics[J]. The FEBS Journal, 2014, 281(22): 5147-5158. DOI:10.1111/febs.13054
|
| [32] |
RICHARDT A, KEMME T, WAGNER S, SCHWARZER D, MARAHIEL MA, HOVEMANN BT. Ebony, a novel nonribosomal peptide synthetase for β-alanine conjugation with biogenic amines in Drosophila[J]. Journal of Biological Chemistry, 2003, 278(42): 41160-41166. DOI:10.1074/jbc.M304303200
|
| [33] |
ZHAO M, SONG XT, LIU W, QI FJ, ZHAO TT, XIA KK, LIU ZQ, ZHENG YG. Whole-cell biotransformation for large scale production of carcinine in Escherichia coli[J]. Journal of Biotechnology, 2022, 354: 45-52. DOI:10.1016/j.jbiotec.2022.06.003
|
| [34] |
郜娇娇, 杨树林. 微生物发酵法生产高分子量透明质酸的研究进展[J]. 中国生物工程杂志, 2017, 37(5): 118-125. GAO JJ, YANG SL. Advances in the production of high molecular weight hyaluronic acid by microbial fermentation[J]. China Biotechnology, 2017, 37(5): 118-125 (in Chinese). |
| [35] |
UCM R, AEM M, LHB Z, KUMAR V, TAHERZADEH MJ, GARLAPATI VK, CHANDEL AK. Comprehensive review on biotechnological production of hyaluronic acid: status, innovation, market and applications[J]. Bioengineered, 2022, 13(4): 9645-9661. DOI:10.1080/21655979.2022.2057760
|
| [36] |
SERRA M, CASAS A, TOUBARRO D, BARROS AN, TEIXEIRA JA. Microbial hyaluronic acid production: a review[J]. Molecules, 2023, 28(5): 2084. DOI:10.3390/molecules28052084
|
| [37] |
AMADO IR, VÁZQUEZ JA, PASTRANA L, TEIXEIRA JA. Cheese whey: a cost-effective alternative for hyaluronic acid production by Streptococcus zooepidemicus[J]. Food Chemistry, 2016, 198: 54-61. DOI:10.1016/j.foodchem.2015.11.062
|
| [38] |
AMADO IR, VÁZQUEZ JA, PASTRANA L, TEIXEIRA JA. Microbial production of hyaluronic acid from agro-industrial by-products: molasses and corn steep liquor[J]. Biochemical Engineering Journal, 2017, 117: 181-187. DOI:10.1016/j.bej.2016.09.017
|
| [39] |
ZHANG JF, DING X, YANG LY, KONG ZM. A serum-free medium for colony growth and hyaluronic acid production by Streptococcus zooepidemicus NJUST01[J]. Applied Microbiology and Biotechnology, 2006, 72(1): 168-172. DOI:10.1007/s00253-005-0253-x
|
| [40] |
DUFFECK HCBP, PAN NC, SAIKAWA GIA, Da ROCHA SPD, BALDO C, CELLIGOI MAPC. Biomedical potential of hyaluronic acid from Streptococcus zooepidemicus produced in sugarcane molasses[J]. Brazilian Journal of Development, 2020, 6(7): 49963-49980. DOI:10.34117/bjdv6n7-592
|
| [41] |
WOO JE, SEONG HJ, LEE SY, JANG YS. Metabolic engineering of Escherichia coli for the production of hyaluronic acid from glucose and galactose[J]. Frontiers in Bioengineering and Biotechnology, 2019, 7: 351. DOI:10.3389/fbioe.2019.00351
|
| [42] |
JEEVA P, SHANMUGA DOSS S, SUNDARAM V, JAYARAMAN G. Production of controlled molecular weight hyaluronic acid by glucostat strategy using recombinant Lactococcus lactis cultures[J]. Applied Microbiology and Biotechnology, 2019, 103(11): 4363-4375. DOI:10.1007/s00253-019-09769-0
|
| [43] |
CHENG FY, GONG QY, YU HM, STEPHANOPOULOS G. High-titer biosynthesis of hyaluronic acid by recombinant Corynebacterium glutamicum[J]. Biotechnology Journal, 2016, 11(4): 574-584. DOI:10.1002/biot.201500404
|
| [44] |
CHENG FY, LUOZHONG SJ, GUO ZG, YU HM, STEPHANOPOULOS G. Enhanced biosynthesis of hyaluronic acid using engineered Corynebacterium glutamicum via metabolic pathway regulation[J]. Biotechnology Journal, 2017, 12(10). DOI:10.1002/biot.201700191
|
| [45] |
DU Y, CHENG FY, WANG MM, XU CM, YU HM. Indirect pathway metabolic engineering strategies for enhanced biosynthesis of hyaluronic acid in engineered Corynebacterium glutamicum[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 768490. DOI:10.3389/fbioe.2021.768490
|
| [46] |
WANG Y, HU LT, HUANG H, WANG H, ZHANG TM, CHEN J, DU GC, KANG Z. Eliminating the capsule-like layer to promote glucose uptake for hyaluronan production by engineered Corynebacterium glutamicum[J]. Nature Communications, 2020, 11: 3120. DOI:10.1038/s41467-020-16962-7
|
| [47] |
MICHALAK M. Plant-derived antioxidants: significance in skin health and the ageing process[J]. International Journal of Molecular Sciences, 2022, 23(2): 585. DOI:10.3390/ijms23020585
|
| [48] |
QUIDEAU S, DEFFIEUX D, DOUAT-CASASSUS C, POUYSÉGU L. Plant polyphenols: chemical properties, biological activities, and synthesis[J]. Angewandte Chemie (International Ed in English), 2011, 50(3): 586-621. DOI:10.1002/anie.201000044
|
| [49] |
AVERESCH NJH, KRÖMER JO. Metabolic engineering of the shikimate pathway for production of aromatics and derived compounds-present and future strain construction strategies[J]. Frontiers in Bioengineering and Biotechnology, 2018, 6: 32. DOI:10.3389/fbioe.2018.00032
|
| [50] |
马晶波. 红景天甙对黑素细胞生物学作用的研究及美白中草药筛选过程中一些问题的探讨[D]. 上海: 复旦大学博士学位论文, 2003. MA JB. The biological effect of salidroside on melanocytes and the discussion about the selection processes of whitening Chinese herbal[D]. Shanghai: Doctoral Dissertation of Fudan University, 2003 (in Chinese). |
| [51] |
FAN B, CHEN TY, ZHANG S, WU B, HE BF. Mining of efficient microbial UDP-glycosyltransferases by motif evolution cross plant Kingdom for application in biosynthesis of salidroside[J]. Scientific Reports, 2017, 7: 463. DOI:10.1038/s41598-017-00568-z
|
| [52] |
GRECH-BARAN M, SYKŁOWSKA-BARANEK K, PIETROSIUK A. Biotechnological approaches to enhance salidroside, rosin and its derivatives production in selected Rhodiola spp. in vitro cultures[J]. Phytochemistry Reviews, 2015, 14(4): 657-674. DOI:10.1007/s11101-014-9368-y
|
| [53] |
TORRENS-SPENCE MP, GILLASPY G, ZHAO BY, HARICH K, WHITE RH, LI JY. Biochemical evaluation of a parsley tyrosine decarboxylase results in a novel 4-hydroxyphenylacetaldehyde synthase enzyme[J]. Biochemical and Biophysical Research Communications, 2012, 418(2): 211-216. DOI:10.1016/j.bbrc.2011.12.124
|
| [54] |
KAMINAGA Y, SCHNEPP J, PEEL G, KISH CM, BEN-NISSAN G, WEISS D, ORLOVA I, LAVIE O, RHODES D, WOOD K, PORTERFIELD DM, COOPER AJL, SCHLOSS JV, PICHERSKY E, VAINSTEIN A, DUDAREVA N. Plant phenylacetaldehyde synthase is a bifunctional homotetrameric enzyme that catalyzes phenylalanine decarboxylation and oxidation[J]. The Journal of Biological Chemistry, 2006, 281(33): 23357-23366. DOI:10.1074/jbc.M602708200
|
| [55] |
姜梦超. 代谢改造大肠杆菌生产红景天苷[M]. 杭州: 浙江工业大学硕士学位论文, 2023. JIANG MC. Metabolic modification of Escherichia coli for the production of salidroside[M]. Hangzhou: Master's Thesis of Zhejiang University of Technology, 2003 (in Chinese). |
| [56] |
LIU X, LI XB, JIANG JL, LIU ZN, QIAO B, LI FF, CHENG JS, SUN XC, YUAN YJ, QIAO JJ, ZHAO GR. Convergent engineering of syntrophic Escherichia coli coculture for efficient production of glycosides[J]. Metabolic Engineering, 2018, 47: 243-253. DOI:10.1016/j.ymben.2018.03.016
|
| [57] |
LIU HY, TIAN YJ, ZHOU Y, KAN YY, WU TT, XIAO WH, LUO YZ. Multi-modular engineering of Saccharomyces cerevisiae for high-titre production of tyrosol and salidroside[J]. Microbial Biotechnology, 2021, 14(6): 2605-2616. DOI:10.1111/1751-7915.13667
|
| [58] |
NAHAR L, AL-GROSHI A, KUMAR A, SARKER SD. Arbutin: occurrence in plants, and its potential as an anticancer agent[J]. Molecules, 2022, 27(24): 8786. DOI:10.3390/molecules27248786
|
| [59] |
SATO T, HASEGAWA N, SAITO J, UMEZAWA S, HONDA Y, KINO K, KIRIMURA K. Purification, characterization, and gene identification of an α-glucosyl transfer enzyme, a novel type α-glucosidase from Xanthomonas campestris WU-9701[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 80: 20-27. DOI:10.1016/j.molcatb.2012.04.014
|
| [60] |
YU SH, WANG YC, TIAN YQ, XU W, BAI YX, ZHANG T, MU WM. Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J]. Process Biochemistry, 2018, 68: 93-99. DOI:10.1016/j.procbio.2018.02.012
|
| [61] |
SHEN XL, WANG J, WANG J, CHEN ZY, YUAN QP, YAN YJ. High-level de novo biosynthesis of arbutin in engineered Escherichia coli[J]. Metabolic Engineering, 2017, 42: 52-58. DOI:10.1016/j.ymben.2017.06.001
|
| [62] |
AN N, XIE C, ZHOU SB, WANG J, SUN XX, YAN YJ, SHEN XL, YUAN QP. Establishing a growth-coupled mechanism for high-yield production of β-arbutin from glycerol in Escherichia coli[J]. Bioresource Technology, 2023, 369: 128491. DOI:10.1016/j.biortech.2022.128491
|
| [63] |
ZHOU Q, WU YK, DENG JY, LIU YF, LI JH, DU GC, LV XQ, LIU L. Combinatorial metabolic engineering enables high yield production of α-arbutin from sucrose by biocatalysis[J]. Applied Microbiology and Biotechnology, 2023, 107(9): 2897-2910. DOI:10.1007/s00253-023-12496-2
|
| [64] |
SGARBOSSA A, GIACOMAZZA D, Di CARLO M. Ferulic acid: a hope for Alzheimer's disease therapy from plants[J]. Nutrients, 2015, 7(7): 5764-5782. DOI:10.3390/nu7075246
|
| [65] |
KANG SY, CHOI O, LEE JK, HWANG BY, UHM TB, HONG YS. Artificial biosynthesis of phenylpropanoic acids in a tyrosine overproducing Escherichia coli strain[J]. Microbial Cell Factories, 2012, 11: 153. DOI:10.1186/1475-2859-11-153
|
| [66] |
CHOI O, WU CZ, KANG SY, AHN JS, UHM TB, HONG YS. Biosynthesis of plant-specific phenylpropanoids by construction of an artificial biosynthetic pathway in Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(10): 1657-1665.
|
| [67] |
LV HJ, ZHANG Y, SHAO J, LIU HL, WANG Y. Ferulic acid production by metabolically engineered Escherichia coli[J]. Bioresources and Bioprocessing, 2021, 8(1): 70. DOI:10.1186/s40643-021-00423-0
|
| [68] |
ZHOU Z, ZHANG XY, WU J, LI XL, LI WN, SUN XX, WANG J, YAN YJ, SHEN XL, YUAN QP. Targeting cofactors regeneration in methylation and hydroxylation for high level production of Ferulic acid[J]. Metabolic Engineering, 2022, 73: 247-255. DOI:10.1016/j.ymben.2022.08.007
|
| [69] |
CHUNG D, KIM SY, AHN JH. Production of three phenylethanoids, tyrosol, hydroxytyrosol, and salidroside, using plant genes expressing in Escherichia coli[J]. Scientific Reports, 2017, 7: 2578. DOI:10.1038/s41598-017-02042-2
|
| [70] |
LIU LX, LI WN, LI XL, SUN XX, YUAN QP. Constructing an efficient salicylate biosynthesis platform by Escherichia coli chromosome integration[J]. Journal of Biotechnology, 2019, 298: 5-10. DOI:10.1016/j.jbiotec.2019.04.004
|
| [71] |
ZHANG MQ, LIU C, XI DY, BI HP, CUI ZZ, ZHUANG YB, YIN H, LIU T. Metabolic engineering of Escherichia coli for high-level production of salicin[J]. ACS Omega, 2022, 7(37): 33147-33155. DOI:10.1021/acsomega.2c03347
|
| [72] |
李若松, 彭彦峰, 马龙, 王钦宏. 代谢工程改造大肠杆菌生产水杨酸葡萄糖苷[J]. 生物工程学报, 2023, 39(8): 3290-3301. LI RS, PENG YF, MA L, WANG QH. Metabolic engineering of Escherichia coli for production of salicylate 2-O-β-D-glucoside[J]. Chinese Journal of Biotechnology, 2023, 39(8): 3290-3301 (in Chinese). |
| [73] |
THOLL D. Terpene synthases and the regulation, diversity and biological roles of terpene metabolism[J]. Current Opinion in Plant Biology, 2006, 9(3): 297-304. DOI:10.1016/j.pbi.2006.03.014
|
| [74] |
SMITH TJ. Squalene: potential chemopreventive agent[J]. Expert Opinion on Investigational Drugs, 2000, 9(8): 1841-1848. DOI:10.1517/13543784.9.8.1841
|
| [75] |
CHEMLER JA, KOFFAS MAG. Metabolic engineering for plant natural product biosynthesis in microbes[J]. Current Opinion in Biotechnology, 2008, 19(6): 597-605. DOI:10.1016/j.copbio.2008.10.011
|
| [76] |
MARIENHAGEN J, BOTT M. Metabolic engineering of microorganisms for the synthesis of plant natural products[J]. Journal of Biotechnology, 2013, 163(2): 166-178. DOI:10.1016/j.jbiotec.2012.06.001
|
| [77] |
YANG LM, LIU H, JIN YH, LIU JF, DENG L, WANG F. Recent advances in multiple strategies for the synthesis of terpenes by engineered yeast[J]. Fermentation, 2022, 8(11): 615. DOI:10.3390/fermentation8110615
|
| [78] |
SÁNCHEZ-QUESADA C, LÓPEZ-BIEDMA A, TOLEDO E, GAFORIO JJ. Squalene stimulates a key innate immune cell to foster wound healing and tissue repair[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2018, 2018: 9473094. DOI:10.1155/2018/9473094
|
| [79] |
ROSALES-GARCIA T, JIMENEZ-MARTINEZ C, DAVILA-ORTIZ G. Squalene extraction: biological sources and extraction methods[J]. International Journal of Environment, Agriculture and Biotechnology, 2017, 2(4): 1662-1670. DOI:10.22161/ijeab/2.4.26
|
| [80] |
TANG WY, WANG DP, TIAN Y, FAN X, WANG C, LU XY, LI PW, JI XJ, LIU HH. Metabolic engineering of Yarrowia lipolytica for improving squalene production[J]. Bioresource Technology, 2021, 323: 124652. DOI:10.1016/j.biortech.2020.124652
|
| [81] |
PARAMASIVAN K, MUTTURI S. Regeneration of NADPH coupled with HMG-CoA reductase activity increases squalene synthesis in Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2017, 65(37): 8162-8170. DOI:10.1021/acs.jafc.7b02945
|
| [82] |
XU W, YAO J, LIU LJ, MA X, LI W, SUN XJ, WANG Y. Improving squalene production by enhancing the NADPH/NADP+ ratio, modifying the isoprenoid-feeding module and blocking the menaquinone pathway in Escherichia coli[J]. Biotechnology for Biofuels, 2019, 12: 68. DOI:10.1186/s13068-019-1415-x
|
| [83] |
LIU GS, LI T, ZHOU W, JIANG M, TAO XY, LIU M, ZHAO M, REN YH, GAO B, WANG FQ, WEI DZ. The yeast peroxisome: a dynamic storage depot and subcellular factory for squalene overproduction[J]. Metabolic Engineering, 2020, 57: 151-161. DOI:10.1016/j.ymben.2019.11.001
|
| [84] |
ZHU ZT, DU MM, GAO B, TAO XY, ZHAO M, REN YH, WANG FQ, WEI DZ. Metabolic compartmentalization in yeast mitochondria: burden and solution for squalene overproduction[J]. Metabolic Engineering, 2021, 68: 232-245. DOI:10.1016/j.ymben.2021.10.011
|
| [85] |
FISHER KJ, SHIRTCLIFF L, BUCHANAN G, THOMPSON AW, WOOLARD FX, LaMUNYON DH, MARSHALL JL, BARANOUSKAS MB, VOELKER RB, LUSK JS, WELLS CE, MOHAMATH R, KINSEY R, LYKINS WR, RAMER-DENISOFF G, FOX CB, PADDON CJ, McPHEE D. Kilo-scale GMP synthesis of renewable semisynthetic vaccine-grade squalene[J]. Organic Process Research & Development, 2023, 27(12): 2317-2328.
|
| [86] |
SUN L, KWAK S, JIN YS. Vitamin A production by engineered Saccharomyces cerevisiae from xylose via two-phase in situ extraction[J]. ACS Synthetic Biology, 2019, 8(9): 2131-2140. DOI:10.1021/acssynbio.9b00217
|
| [87] |
《2022–2026年中国视黄醇行业市场行情监测及未来发展前景研究报告》[EB/OL]. [2024-02-15]. http://www.newsijie.com/baogao/2022/0720/11320411.html.
|
| [88] |
JANG HJ, HA BK, ZHOU J, AHN J, YOON SH, KIM SW. Selective retinol production by modulating the composition of retinoids from metabolically engineered E. coli[J]. Biotechnology and Bioengineering, 2015, 112(8): 1604-1612. DOI:10.1002/bit.25577
|
| [89] |
JANG HJ, YOON SH, RYU HK, KIM JH, WANG CL, KIM JY, OH DK, KIM SW. Retinoid production using metabolically engineered Escherichia coli with a two-phase culture system[J]. Microbial Cell Factories, 2011, 10: 59. DOI:10.1186/1475-2859-10-59
|
| [90] |
LEE YG, KIM C, SUN L, LEE TH, JIN YS. Selective production of retinol by engineered Saccharomyces cerevisiae through the expression of retinol dehydrogenase[J]. Biotechnology and Bioengineering, 2022, 119(2): 399-410. DOI:10.1002/bit.28004
|
| [91] |
PARK H, LEE D, KIM JE, PARK S, PARK JH, HA CW, BAEK M, YOON SH, PARK KH, LEE P, HAHN JS. Efficient production of retinol in Yarrowia lipolytica by increasing stability using antioxidant and detergent extraction[J]. Metabolic Engineering, 2022, 73: 26-37. DOI:10.1016/j.ymben.2022.06.001
|
| [92] |
MA YS, LI JB, HUANG SW, STEPHANOPOULOS G. Targeting pathway expression to subcellular organelles improves astaxanthin synthesis in Yarrowia lipolytica[J]. Metabolic Engineering, 2021, 68: 152-161. DOI:10.1016/j.ymben.2021.10.004
|
| [93] |
JIA JP, LI FF, LUAN YF, LIU SR, CHEN ZT, BAO GL. Salicylic acid treatment and overexpression of a novel polyamine transporter gene for astaxanthin production in Phaffia rhodozyma[J]. Frontiers in Bioengineering and Biotechnology, 2023, 11: 1282315. DOI:10.3389/fbioe.2023.1282315
|
| [94] |
PAN XS, LI TG, WANG BB, QI SH, YANG DD, HUANG Z, GAO RF, LI JY, LING XP, LU YH. Metabolic mechanism of astaxanthin biosynthesis in Xanthophyllomyces dendrorhous in response to sodium citrate treatment[J]. Bioresources and Bioprocessing, 2023, 10(1): 29. DOI:10.1186/s40643-023-00650-7
|
| [95] |
LIU SJ, YI H, ZHAN HL, WANG L, WANG JH, LI Y, LIU BN. Gibberellic acid‐induced fatty acid metabolism and ABC transporters promote astaxanthin production in Phaffia rhodozyma[J]. Journal of Applied Microbiology, 2022, 132(1): 390-400. DOI:10.1111/jam.15187
|
| [96] |
杨延辉, 肖春玲. 泛酸的功能和生物合成[J]. 生命的化学, 2008, 28(4): 448-452. YANG YH, XIAO CL. The functions and biosynthesis of pantothenate[J]. Chemistry of Life, 2008, 28(4): 448-452 (in Chinese). DOI:10.3969/j.issn.1000-1336.2008.04.020 |
| [97] |
Di MEO I, CARECCHIO M, TIRANTI V. Inborn errors of coenzyme A metabolism and neurodegeneration[J]. Journal of Inherited Metabolic Disease, 2019, 42(1): 49-56. DOI:10.1002/jimd.12026
|
| [98] |
McCOY F, DARBANDI R, LEE HC, BHARATHAM K, MOLDOVEANU T, GRACE CR, DODD K, LIN WW, CHEN SI, TANGALLAPALLY RP, KUROKAWA M, LEE RE, SHELAT AA, CHEN TS, GREEN DR, HARRIS RA, LIN SH, FISSORE RA, COLBRAN RJ, NUTT LK. Metabolic activation of CaMKII by coenzyme A[J]. Molecular Cell, 2013, 52(3): 325-339. DOI:10.1016/j.molcel.2013.08.043
|
| [99] |
PASTOR-NIETO MA, GATICA-ORTEGA ME, SÁNCHEZ-HERREROS C, JIMÉNEZ-BLÁZQUEZ E, MARTÍN-FUENTES A, CHECA-RECIO I, COBO-RODRÍGUEZ P, RODRIGUES-FIGUEIRA Y, CUEVAS-SANTOS J, DE-EUSEBIO-MURILLO E. Calcium pantothenate is present in cosmetics and may cause allergic contact dermatitis[J]. Contact Dermatitis, 2021, 84(3): 201-203. DOI:10.1111/cod.13709
|
| [100] |
ST PAUL M, SAIBIL SD, HAN S, ISRANI-WINGER K, LIEN SC, LAISTER RC, SAYAD A, PENNY S, AMARIA RN, HAYDU LE, GARCIA-BATRES CR, KATES M, MULDER DT, ROBERT-TISSOT C, GOLD MJ, TRAN CW, ELFORD AR, NGUYEN LT, PUGH TJ, PINTO DM, WARGO JA, OHASHI PS. Coenzyme A fuels T cell anti-tumor immunity[J]. Cell Metabolism, 2021, 33(12): 2415-2427.e6. DOI:10.1016/j.cmet.2021.11.010
|
| [101] |
SAKAMOTO K, HONDA K, WADA K, KITA S, TSUZAKI K, NOSE H, KATAOKA M, SHIMIZU S. Practical resolution system for DL-pantoyl lactone using the lactonase from Fusarium oxysporum[J]. Journal of Biotechnology, 2005, 118(1): 99-106. DOI:10.1016/j.jbiotec.2005.03.015
|
| [102] |
HUSER A, CHASSAGNOLE C, LINDLEY N, MERKAMM M, GUYONVARCH A, ELISAKOVA V, PATEK M, KALINOWSKI J, BRUNE I, PUHLER A, TAUCH A. Rational design of a Corynebacterium glutamicum pantothenate production strain and its characterization by metabolic flux analysis and genome-wide transcriptional profiling[J]. Applied and Environmental Microbiology, 2005, 71: 3255-3268. DOI:10.1128/AEM.71.6.3255-3268.2005
|
| [103] |
YOCUM RR, PATTERSON TA, PERO JG, HERMANN T. Microorganisms and processes for enhanced production of pantothenate: US7244593[P]. 2007-07-17.
|
| [104] |
ZHANG B, ZHANG XM, WANG W, LIU ZQ, ZHENG YG. Metabolic engineering of Escherichia coli for D-pantothenic acid production[J]. Food Chemistry, 2019, 294: 267-275. DOI:10.1016/j.foodchem.2019.05.044
|
| [105] |
ZOU SP, ZHAO K, WANG ZJ, ZHANG B, LIU ZQ, ZHENG YG. Overproduction of D-pantothenic acid via fermentation conditions optimization and isoleucine feeding from recombinant Escherichia coli W3110[J]. 3 Biotech, 2021, 11(6): 295. DOI:10.1007/s13205-021-02773-0
|
| [106] |
QIN HB, ZHOU JP, ZHANG B, LIU ZQ, ZHENG YG. Combing with redox regulation via quorum-sensing system and fermentation strategies for improving D-pantothenic acid production[J]. Process Biochemistry, 2022, 121: 681-688. DOI:10.1016/j.procbio.2022.08.012
|
| [107] |
CHATTERJEE IB. Evolution and the biosynthesis of ascorbic acid[J]. Science, 1973, 182(4118): 1271-1272. DOI:10.1126/science.182.4118.1271
|
| [108] |
LI D, LIU L, QIN ZJ, YU SQ, ZHOU JW. Combined evolutionary and metabolic engineering improve 2-keto-L-gulonic acid production in Gluconobacter oxydans WSH-004[J]. Bioresource Technology, 2022, 354: 127107. DOI:10.1016/j.biortech.2022.127107
|
| [109] |
ZENG WZ, WANG PP, LI N, LI JH, CHEN J, ZHOU JW. Production of 2-keto-L-gulonic acid by metabolically engineered Escherichia coli[J]. Bioresource Technology, 2020, 318: 124069. DOI:10.1016/j.biortech.2020.124069
|
| [110] |
WANG PP, ZENG WZ, XU S, DU GC, ZHOU JW, CHEN J. Current challenges facing one-step production of L-ascorbic acid[J]. Biotechnology Advances, 2018, 36(7): 1882-1899. DOI:10.1016/j.biotechadv.2018.07.006
|
| [111] |
LI G, LI D, ZENG WZ, QIN ZJ, CHEN J, ZHOU JW. Efficient production of 2-keto-L-gulonic acid from D-glucose in Gluconobacter oxydans ATCC9937 by mining key enzyme and transporter[J]. Bioresource Technology, 2023, 384: 129316. DOI:10.1016/j.biortech.2023.129316
|
| [112] |
HUH WK, LEE BH, KIM ST, KIM YR, RHIE GE, BAEK YW, HWANG CS, LEE JS, KANG SO. D-erythroascorbic acid is an important antioxidant molecule in Saccharomyces cerevisiae[J]. Molecular Microbiology, 1998, 30(4): 895-903. DOI:10.1046/j.1365-2958.1998.01133.x
|
| [113] |
SAUER M, BRANDUARDI P, VALLI M, PORRO D. Production of L-ascorbic acid by metabolically engineered Saccharomyces cerevisiae and Zygosaccharomyces bailii[J]. Applied and Environmental Microbiology, 2004, 70(10): 6086-6091. DOI:10.1128/AEM.70.10.6086-6091.2004
|
| [114] |
BRANDUARDI P, FOSSATI T, SAUER M, PAGANI R, MATTANOVICH D, PORRO D. Biosynthesis of vitamin C by yeast leads to increased stress resistance[J]. PLoS One, 2007, 2(10): e1092. DOI:10.1371/journal.pone.0001092
|
| [115] |
ROSA JCC, COLOMBO LT, ALVIM MCT, AVONCE N, van DIJCK P, PASSOS FML. Metabolic engineering of Kluyveromyces lactis for L-ascorbic acid (vitamin C) biosynthesis[J]. Microbial Cell Factories, 2013, 12(1): 59. DOI:10.1186/1475-2859-12-59
|
| [116] |
ZHANG ZC, LI JH, LIU L, SUN J, HUA ZZ, DU GC, CHEN J. Enzymatic transformation of 2-O-α-D-glucopyranosyl-L-ascorbic acid (AA-2G) by immobilized α-cyclodextrin glucanotransferase from recombinant Escherichia coli[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 68(3/4): 223-229.
|