水溶性维生素的生物合成
张博
,
廖宇哲
,
余浩楠
,
王广豪
,
柳志强
,
郑裕国
生物工程学报  2024, Vol. 40 2024, Vol. 40 Issue (8): 2528-2551 Issue (8): 2528-2551 |

维生素是生物体维持正常生理功能所必需的一类微量有机物质,按其溶解性可分为水溶性维生素和脂溶性维生素两大类[1]。水溶性维生素主要由B族维生素与维生素C组成,其易溶于水而不溶于有机溶剂,因而人体吸收后在体内储存少、易排出。由于其难以在体内储存,因此需要经常补充,摄入需求较大。近年来,随着水溶性维生素在食品、医疗等领域的应用不断扩大,其市场需求也不断提高。据统计,维生素B族与维生素C分别占据了全球维生素市场33%和21%的份额,现如今我国已成为水溶性维生素的生产大国,产量位居全球第一[2]。因此,改进维生素生产工艺具有重要的意义。
水溶性维生素的生产历史悠久。天然水溶性维生素受原料和提取技术的限制,产量低、价格高,因此人工合成居主导地位,占总产量的80%左右[2]。水溶性维生素的人工合成方法可分为化学合成法与生物合成法。化学合成法现已广泛应用于多种维生素的生产,如通过直线法合成维生素B1[3]、氨氧化法生产维生素B3[4]等。同时,生物合成法(图 1)以其安全高效、绿色环保的特点成为了当下的研究热点。早期对水溶性维生素生物合成的研究主要集中在对维生素的天然生产菌进行理化诱变以筛选获得产量更高的菌株,但这种方法具有较大的不确定性,耗费的时间长且需要进行大量的筛选工作。同时诱变法很难实现有利突变的叠加,无法充分发挥菌体的维生素生产潜力。
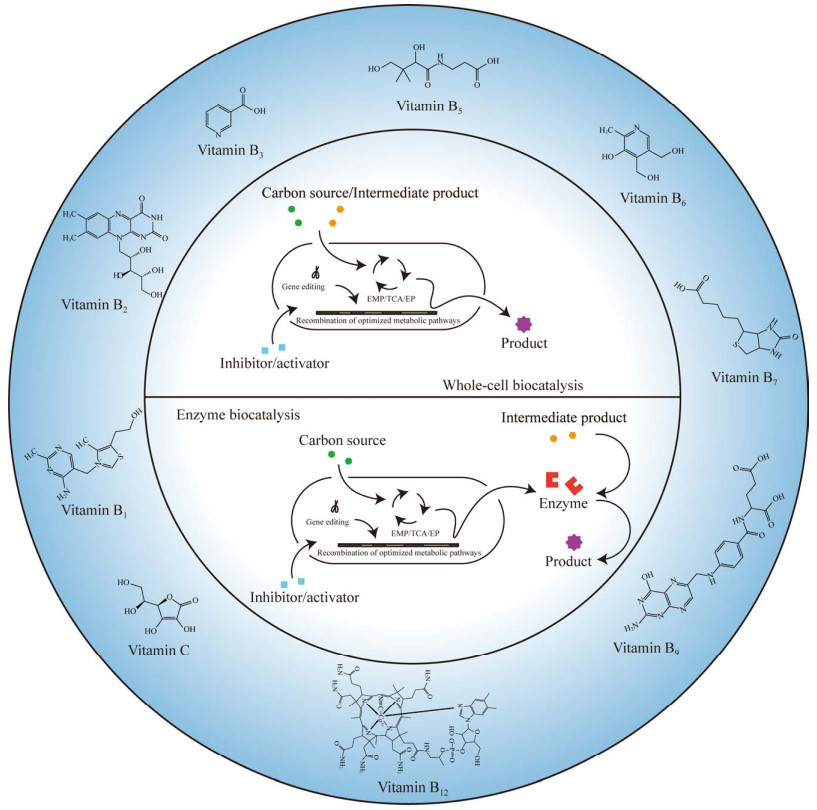
|
| 图 1 水溶性维生素与生物合成技术 Fig. 1 Water-soluble vitamins and biosynthesis techniques. |
| |
随着技术的进步,水溶性维生素的生物合成迅速发展。代谢工程基于生物的代谢网络,通过对底盘细胞的代谢网络进行优化,同时通过对关键代谢节点进行改造进而调控酶的活性,并对支路途径进行修饰,使菌株更多地将物质与能量代谢用于维生素合成途径中,显著地提高了维生素的产量[5-7];合成生物技术则是通过人工设计与构建新的生物学元件,进一步组成基因通路等生物系统,合成生物学将复杂的代谢通路构建过程简化为“编程式”的组件拼接。尽管该技术仍有许多尚未解决的问题(如对底盘中“必需基因”的认识尚浅,且简单拼接的体系很难兼顾基因的简并性与相互作用),但基于该思路的尝试也为菌株改造提供了许多参考[8-11]。
本文就近年来生物合成法生产水溶性维生素的研究进行了综述,列举了微生物发酵生产水溶性微生物的实例,希望能为生物法生产水溶性维生素提供参考。
1 B族维生素B族维生素是一类水溶性小分子化合物,在体内广泛参与各种生理过程,在人体内存留时间短,需要经常补充。B族维生素的结构各不相同,但普遍以辅酶的形式参与到体内糖、蛋白质和脂肪的代谢过程中。
1.1 维生素B1维生素B1又称硫胺素,是首个被发现的B族维生素,也是最早被提纯的水溶性维生素。维生素B1的生物活性形式为硫胺素焦磷酯(thiamine pyrophosphate, TPP),是催化丙酮酸发生脱羧反应的丙酮酸脱氢酶复合体E1亚基的辅因子,也是三羧酸循环中的α-酮戊二酸脱氢酶复合体的辅因子,同时还参与了磷酸戊糖途径中转酮醇酶催化的反应。
维生素B1由嘧啶环和噻唑环通过亚甲基结合而成,目前工业化生产由化学法进行生产,其化学合成可分为汇聚式[12](分别构建嘧啶环和噻唑环并结合)和直线式(先构建嘧啶环,在此基础上构建噻唑环)两种类型,但其汇聚式路线收率较低,因而常采用直线式路线。该路线可进一步按构建嘧啶环原料的不同分为丙二腈路线[13]和丙烯腈路线[3],前者较为简洁,但成本较高;后者成本低,但路线较长,收率也有所下降;后续通过“催化-缩合”两步构建噻唑环,获得维生素B1。
2022年全球与中国维生素B1市场总量分别为48.94亿元与18.92亿元,预计全球市场总量在2028年达70.32亿元;维生素B1主要应用于食品领域,目前亚太地区是其最大的销售市场,约占总市场份额的35%,其次是欧洲和北美市场,两者约占50%;主要生产厂商包括:天新药业(江西省)、兄弟科技(浙江省)、华中药业(湖北省)、DSM (荷兰)、新发药业(山东省)等[14-15]。
关于维生素B1的生物法合成研究主要集中于原核生物底盘细胞。维生素B1的生物合成过程与化学汇聚法类似,分别形成嘧啶环与噻唑环,由二者连接后得到。目前在原核生物中已鉴定出12个参与硫胺素生物合成的基因并进行了单基因过表达研究(图 2)。其中,6个基因涉及噻唑环的生物合成(thiF、thiS、thiG、thiH、thiI和dxs),1个参与嘧啶环的生物合成(thiC),1个是噻唑和嘧啶连接所需(thiE),另外4个激酶基因(thiD、pdxK、thiL和thiM)前两个涉及嘧啶合成,后两个分别涉及嘧啶噻唑环和合成与硫胺素补救途径[16]。对原核生物硫胺素代谢通路的研究瓶颈在于铁硫代谢与硫胺素代谢间的相互影响,同时由于关键酶ThiC活性不高影响了整体效率。众多研究在不同菌株内针对与硫胺素代谢途径中的嘧啶、噻唑环合成相关的基因进行了基因工程改造,不同程度上提高了硫胺素的产量。在枯草芽孢杆菌(Bacillus subtilis)中,Schyns等[17]对thiN、ykoD、yuaJ进行了敲除,使硫胺素产量提高到1.2 mg/L;在大肠杆菌(Escherichia coli)中,Cardinale等[18]经过遗传改造并结合天然thiFSGH、thiC、thiE和thiD或thiM基因的过表达,使硫胺素的产量提高到0.8 mg/L;E. coli的突变体PT-R1的硫胺素产量是野生型的3倍,达到了1.6 mg/L,该突变体中关键酶基因(thiM、thiD、thiE)不受硫胺素的抑制,而在野生型中硫胺素会阻遏对应酶的生成[19]。利用酵母生产维生素B1的研究仍处于起步阶段,酵母中的天然高产菌株硫胺素的产量为76.38 μg/L[20],远低于E. coli的产量,且硫胺素的反馈抑制作用在酵母中依然存在[21]。
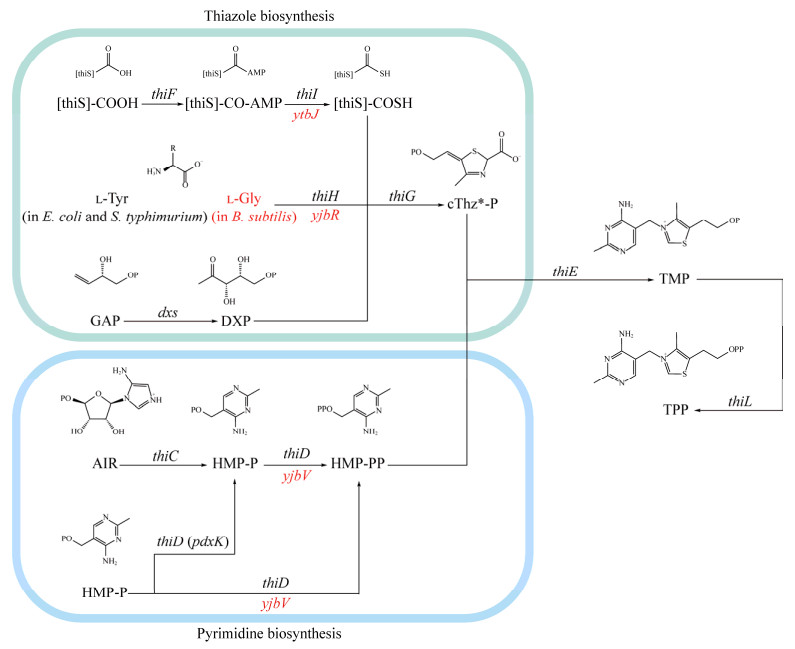
|
| 图 2 维生素B1生物合成路径 Fig. 2 Vitamin B1 biosynthesis pathway. Escherichia coli, Salmonella typhimurium genes are marked in black, and Bacillus subtilis genes are marked in red. thiS: Sulfur carrier protein; Tyr: Tyrosine; Gly: Glycine; GAP: D-glyceraldehyde 3-phosphate; DXP: 1-deoxy-D-xylulose 5-phosphate; cThz*-P: 2-[(2R, 5Z)-2-carboxy-4-methylthiazol-5(2H)-ylidene]ethyl phosphate; AIR: 5-amino-1-(5-phospho-β-D-ribosyl)imidazole; HMP-P: 4-amino-2-methyl-5-(phosphooxymethyl)pyrimidine; HMP-PP: 4-amino-2-methyl-5-(diphosphooxymethyl)pyrimidine; TMP: Thiamine phosphate; TPP: Thiamine diphosphate. |
| |
维生素B1也能够在植物中生产,Strobbe等[22]通过同时过表达thiE、thiI、thiC这3个基因,提高了植株的硫胺素产量,并且发现硫胺素产量的提高可以提高其胁迫抗性。同时,为解决谷物碾磨过程中的硫胺素损失,Minhas等[23]通过调控水稻中硫胺素的转运,提高水稻胚乳中硫胺素含量,实现了维生素B1在食物中较高量的积累。
1.2 维生素B2维生素B2又称核黄素,具有参与呼吸链能量产生,促进葡萄糖、脂肪和蛋白质的代谢以及保护细胞免受自由基的损伤等多种作用。
维生素B2的化学合成是以葡萄糖或化学合成的D-核糖为起始原料,经6–9个步骤合成核黄素[24-25],该过程步骤多、耗时长,且在成本与环保方面并不具备优势,因此后续出现了一种化学半合成法,即通过生物法发酵获得D-核糖作为原料再进行化学合成,但这种方法仍未解决全化学法存在的问题。
2023年,全球维生素B2总产能约10 000 t,生产企业主要有广济药业(湖北省)、DSM (荷兰)、巴斯夫(德国),三家企业总产能超过全球产能80%,呈现三寡头垄断格局;目前国内维生素B2的生产主要由广济药业和海嘉诺药业(原迪赛诺)主导,其他企业包括海嘉诺药业旗下内蒙古赤峰制药股份有限公司和山东恩贝[26]。
现阶段的维生素B2主要由生物法合成,早期的合成底盘是真核生物。使用核黄菌(Ashbya gosypii)这种天然产生核黄素的菌株发酵生产核黄素,野生型菌株核黄素产量可达5 g/L[27]。PARK等[28]利用随机差异诱变与筛选,获得了产量达14 g/L的菌株。无名假丝酵母(Candida famata)也表现出极大的核黄素生产潜力,其突变体核黄素产量高达20 g/L[29]。
在原核生物中,利用枯草芽孢杆菌(Bacillus subtilis)进行维生素B2生物合成的研究较多,Wu等[30]基于统计实验设计,首先在摇瓶培养中优化培养基组分,采用两级Plackett-Burman设计(PB设计,一种用于筛选关键因素的两水平试验设计方法)来筛选对核黄素生产有显著影响的培养基成分,在测试的15个变量中,葡萄糖、NaNO3、K2HPO4、ZnSO4和MnCl2被确定为影响核黄素产生的最显著因素,最佳培养基的核黄素摇瓶产量达到了6.65 g/L,在5 L发酵罐中48 h内B. subtilis RH44中的核黄素水平提高到了16.4 g/L。现有的商业化菌株B. subtilis KCCM 10445保存于韩国微生物资源中心(Korea Culture Center of Microorganisms, KCCM)。该菌株为 B. subtilis AS5突变体在含噻脯氨酸的培养基中培养筛选所得核黄素生产力最高的突变菌株,其核黄素产量达26.8 g/L[31]。同时,Koizumi等[32]利用产氨棒杆菌(Corynebacterium ammoniagenes),通过将启动子活性最强的DNA片段引入核黄素生物合成基因的上游区域,同时提高GTP环水解酶Ⅱ的活性,最终在72 h内积累了15.3 g/L的核黄素。Liu等[33]在E. coli LS31T中,通过敲除purR,下调guaC,过表达fbp、purF、prs、gmk、ndk (图 3)基因,结合对腺嘌呤二核苷酸磷酸/烟酰胺腺嘌呤二核苷酸比率和呼吸链活性的优化,最终获得的菌株E. coli LS72T在补料分批培养条件下产量达21 g/L。
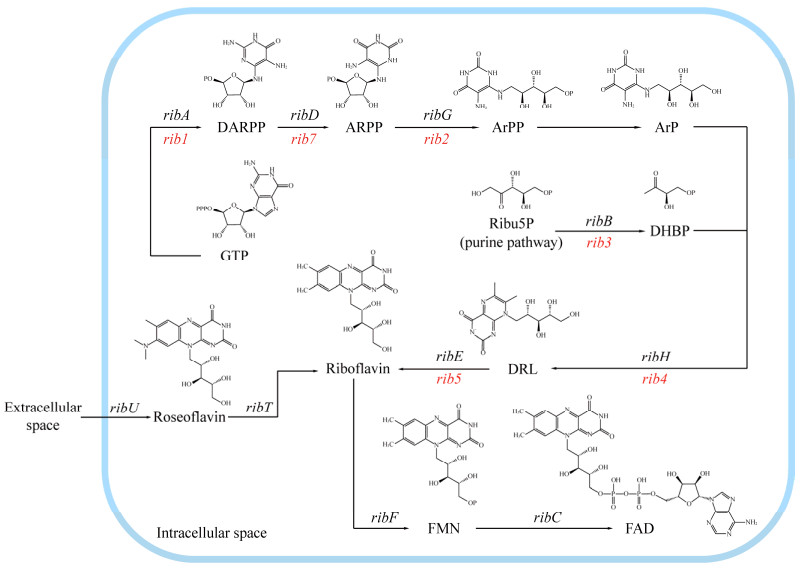
|
| 图 3 维生素B2生物合成路径 Fig. 3 Vitamin B2 biosynthetic pathway. Bacillus subtilis genes are marked in black, and Ashbya gossypii genes are marked in red. GTP: Guanosine 5′-triphosphate; DARP: 2,5-diamino-6-(5-phospho-D-ribosylamino)pyrimidin-4(3H)-one; ARPP: 5-amino-6-(ribosylamino)-2,4-(1H,3H)-pyrimidinedione 5′-phosphate; ArPP: 5-amino-6-(5-phospho-D-ribitylamino)uracil; ARP: 5-amino-6-(D-ribitylamino)uracil; Ribu5P: D-ribulose 5-phosphate; DHPB: 1-deoxy-L-glycero-tetrulose 4-phosphate; DRL: 6,7-dimethyl-8-(1-D-ribityl)lumazine; FMN: Riboflavin 5'-phosphate; FAD: Flavin adenine dinucleotide oxidized. |
| |
食品行业也尝试直接应用维生素B2生产菌株。Thakur等[34]论证了在发酵产品(如发酵乳、酸奶和奶酪)发酵过程中添加工程改造益生菌来提高产品中的核黄素浓度,并进一步通过摄入过程使宿主肠道菌群具备原位生产维生素B2能力的可行性;而对于益生菌合成维生素B2的研究也有所进展:植物乳杆菌(Lactiplantibacillus plantarum)和费氏丙酸杆菌(Propionibacterium freudennreichii)能够合成约0.6 mg/L和3 mg/L的维生素B2,这为通过食物途径补充核黄素提供了新思路[34]。
1.3 维生素B3维生素B3又称烟酸/尼克酸,包括3种形式:烟酸(nicotinic acid)、烟酰胺(nicotinamide)和烟酰胺核糖核苷(nicotinamide nucleotide),它们是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)和烟酰胺腺嘌呤二核苷酸磷酸酯(nicotinamide adenine dinucleotide phosphate, NADP)合成的重要前体物质。
维生素B3的工业生产方法主要为氨氧化法[4]和电解氧化法[35],前者生产成本高,但反应需要在300 ℃以上,后者生产成本低,但电解效率不高。
2022年全球维生素B3的市场营收达到了39.65亿元,市场规模达19.3亿元;预计2028年全球维生素B3市场规模将达到56.64亿元;维生素B3行业内主要竞争企业包括:Lonza (瑞士)、DSM (荷兰)、中瑞药业(天津市)、Lasons (印度)、兄弟科技(浙江省)、Aarti Drugs (印度)等[36]。
目前维生素B3的生物合成并未实现工业化生产,现阶段的研究主要集中于在3-取代基吡啶到维生素B3的酶法催化,该方向存在两个思路:其一是利用水解酶生产烟酸,其二是利用水合酶生产烟酰胺。Mathew等[37]利用紫红色红球菌(Rhodococcus rhodochrous) J1细胞内自带的腈水解酶将3-氰吡啶转化为烟酸,26 h烟酸转化量达172 g/L;Sharma等[38]则利用诺卡氏菌(Nocardia globerula) NHB-2自身自带的腈水解酶将3-氰吡啶转化为烟酸,9 h烟酸转化量达123 g/L,转化率达98.6%;Badoei-Dalfard等[39]使用嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia) AC21的腈水解酶生产烟酸,10 h产量达116.2 g/L;Pai等[40]将来自粪产碱杆菌(Alcaligenes faecalis) MTCC 126的腈水解酶加入到E. coli JM109中,使得重组的E. coli JM109可以直接将3-氰吡啶转化为烟酸,5 h烟酸转化量达123 g/L,转化率达100%。但腈水解酶应用于大规模合成烟酸仍存在一系列问题,如通过发酵培养生产腈水解酶的菌株生物量较低、烟酸合成的整体生产效率较低、腈酶的表达过程需要应用的诱导剂如异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)会提高发酵成本等。为解决这些问题,Dong等[41-42]将恶臭假单胞菌(Pseudomonas putida)的腈水解酶基因在E. coli中进行了异源表达,实现了无诱导条件下的高密度发酵,将烟酸产量由P. putida诱变株最高纪录的189 g/L提高到重组E. coli的541 g/L,且大大降低了转化时间,避免了诱导剂的毒性与成本问题对发酵的影响。
除了酶法合成维生素B3,生物发酵法合成维生素B3近年来也有报道。Belenky等[43]发现酵母细胞中烟酰胺核苷(nicotinamide riboside, NR)转运蛋白的缺失有助于其胞外分泌,且该蛋白缺失同样有助于烟酸的增加;他们通过在酵母细胞中平衡NAD+的前体调节细胞内NAD+代谢过程(图 4),使烟酰胺核糖核苷产量达到8 mg/L。
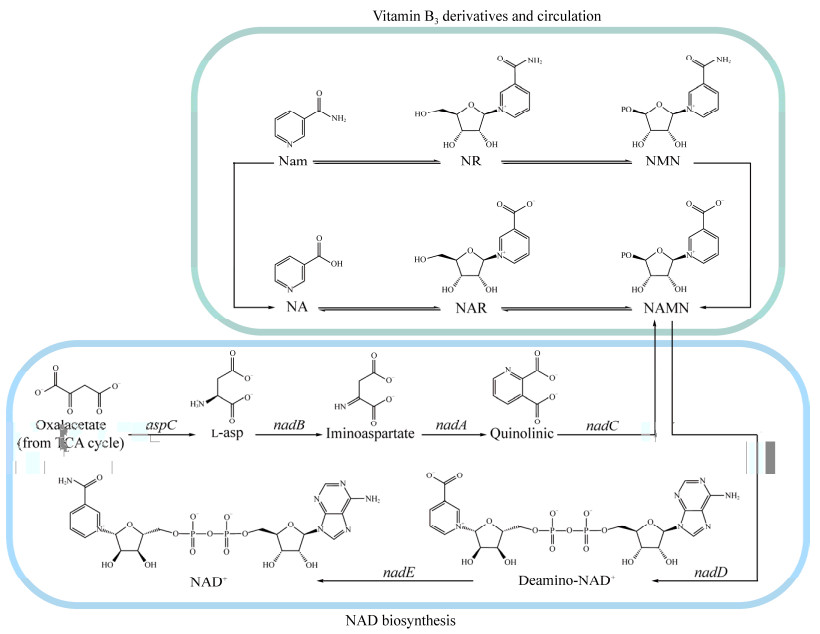
|
| 图 4 维生素B3生物合成路径 Fig. 4 Vitamin B3 Biosynthetic pathway. asp: Aspartate; Iminoaspartate: 2-iminobutanedioate; Quinolinate: 2,3-pyridinedicarboxylic acid; NaMN: β-nicotinate D-ribonucleotide; NAR: Niacin nucleoside; NA: Nicotinic acid; Nam: Niacinamide; NR: Nicotinamide nucleoside; NMN: Nicotinamide mononucleotide. |
| |
维生素B5又称泛酸,因广泛存在于动植物中而得名。是辅酶A和酰基载体蛋白生物合成的重要前体物质,在脂肪酸代谢方面起着重要的作用。
维生素B5仅d型具有生物活性,第一代生产技术是通过化学法合成获得泛酸,但其成本昂贵、环保压力较大(尤其是拆分过程耗时耗力);现阶段市场上主要使用的是第二代化学酶法生产技术,先通过化学合成DL-泛解酸内酯,再经过酶法拆分得到D-泛酸;目前以微生物作为底盘细胞发酵维生素B5的第三代生产技术已成为研究热点,常用的底盘有谷氨酸棒杆菌(Corynebacterium glutamicum)和E. coli;随着微生物底盘细胞各项技术指标的不断提升,有望实现大规模应用[44]。
2022年,我国维生素B5市场规模为73.1亿元,同比增长7.82%;国外维生素B5生产企业主要有巴斯夫(德国)、罗氏制药(美国)、DSM (荷兰)等,国内规模较大的维生素B5生产企业主要有亿帆医药、华恒生物、兄弟科技、新发药业、天新药业、新和成、华辰制药等;其中,亿帆医药市场占比较大,达到27.84%;其次为新发药业,市场占比为21.43%[45-46]。
现有的泛酸工业化生产方法中,化学酶法占主要地位。该方法首先通过化学法合成D-、L-泛解酸内酯。由于只有D-泛酸具有生物活性,因此需要利用D-泛解酸内酯水解酶进行DL-泛解酸内酯的立体专一拆分。Liu等[47-48]通过在酵母细胞中异源表达串珠镰刀菌(Fusarium moniliforme)的泛解酸内酯水解酶,同时通过对该酶的定向进化,获得了活性达野生型的10.5倍,且可在酸性条件下催化的新酶。通过全生物发酵法获得泛酸的方法也有报道,巴斯夫公司公布了无3-(2-羟基-3-甲基-丁酰氨基)-丙酸[3-(2-hydroxy-3-methylbutyrylamino-)-propionic acid, HMBPA]的泛酸组合物的制备方法,通过敲除panE2,减少泛酸激酶的量,适当增加丝氨酸,降低HMBPA的合成,从而提高泛酸的产量,其48 h产量达63 g/L[49]。
E. coli中,泛酸由β-丙氨酸和泛解酸缩合而成。天冬氨酸经天冬氨酸脱羧酶(PanD)脱羧生成β-丙氨酸;泛解酸前体丙酮酸先转化为磷酸烯醇式丙酮酸,然后在乙酰乳酸合酶(IlvBN)、乙酰羟基酸还原异构酶(IlvC)、酮泛酸羟甲基转移酶(PanB)和酮泛酸还原酶(PanE)等一系列泛酸合成关键酶依次作用下形成泛解酸,最终泛解酸和β-丙氨酸在泛酸合成酶(PanC)的作用下缩合形成泛酸(图 5),因此D-泛酸的生产方案有以下改进。

|
| 图 5 维生素B5生物合成路径 Fig. 5 Vitamin B5 Biosynthetic pathway. Glu: Glucose; PEP: Phosphoenolpyruvic acid; PYK: Pyruvate; α-KIV: 3-methyl-2-oxobutanoic acid; Asp: Aspartic acid; Ala: Alanine. |
| |
基于前体D-泛解酸和β-丙氨酸,通过补充两种前体可实现D-泛酸部分途径的酶法生产。Tigu等[50]通过在E. coli中异源表达来自C. glutamicum的泛酸合成酶PanC,泛酸产率达97.1 g/L。但该方法的前体泛解酸价格较高,制约了该路线的应用。
进一步的研究大多基于外源添加β-丙氨酸,强化菌体自身通路合成泛解酸并最终生产泛酸的思路进行构建。Moriya等[51-52]通过对E. coli诱变育种和相关基因的过表达获得了D-泛酸产菌株FV5069/pFV31,外源添加β-丙氨酸后,D-泛酸产量达到65.4 g/L。但该菌株采取的诱变方法缺乏对有益突变机制的阐述,对后续的修饰不利,对泛酸的过量生产机制研究的帮助较少。
Chassagnole等[53]对C. glutamicum进行代谢修饰,D-泛酸累积量小于2 g/L。Zhang等[54-55]通过E. coli的系统代谢分析增强泛酸通路,削弱旁路通路,使得泛酸产量达32.32 g/L。Zou等[44]将烟酰胺和烟酸(NADPH的前体)添加到野生型E. coli DPA11A01的生长培养基中,D-泛酸产量显著升高。此外,选择和过表达NADPH从头合成的必需基因(zwf、icd、maeB、pntAB、sthA、yfjB、ppnk和pos5)以增加细胞内的NADPH库;携带pos5和ppnk共表达质粒的重组菌DPA11A14在5 L生物反应器中,采用补料分批发酵,可生产63.58 g/L的泛酸。
1.5 维生素B6维生素B6又称吡哆素,包括吡哆醇、吡哆醛及吡哆胺,在体内以磷酸酯的形式存在,能够作为辅酶参与蛋白质、碳水化合物、某些神经介质、核酸和DNA、维生素B12、维生素B2、脂类的合成或代谢作用。
当前维生素B6在工业上主要采用噁唑法合成[56],且目前的研究也多集中于噁唑法合成工艺的改进[57],虽然这种方法具有原料易得、收率高、成本低等特点,但是合成过程产生的中间体具有一定毒性,且腐蚀性强,因此亟须使用生物法取代。
2022年全球维生素B6产能约19 700 t,国内占比超过90%;需求方面,国内维生素B6以出口为主,近几年维生素B6出口量约占总产量的70%–80%;据统计,2022年全球维生素B6产能约19 700 t,其中天新药业以6 500 t居行业第一,新和成22年投产6 000 t居行业第二,这两者产能占比超过60%;从产量来看,2022年全球维生素B6产量约8 900 t,其中天新药业(江西省)、新和成(浙江省)、帝斯曼(荷兰)占比分别为67.4%、10.1%、9.0%[58]。
维生素B6的生物合成分为从头合成途径和补救途径。从头合成途径,又称DXP (deoxyxylulose 5-phosphate,1-脱氧-D-木酮糖5-磷酸)依赖途径,可以分为两条线路:一条是两种底物分别在D-赤藓糖-4-磷酸脱氢酶(Epd)、赤藓酸-4-磷酸脱氢酶(PdxB)、酶磷酸丝氨酸氨基转移酶(PdxF/SerC)、4-羟基苏氨酸-4-磷酸脱氢酶(PdxA)、1-脱氧木酮糖-5-磷酸合酶(Dxs)、吡哆醇5′-磷酸合酶(PdxJ)、吡哆醇酶5′-磷酸氧化酶(PdxH)这7种酶(图 6)的作用下产生维生素B6[59]。Yocum等[60]通过在E. coli中引入B. subtilis的pdxST基因,使得维生素B6产量达60 mg/L。Hoshino等[61]在E. coli中过表达自身的epd、pdxJ和dxs基因,产量达78 mg/L。苜蓿中华根瘤菌(Sinorhizobium meliloti) IFO14782是维生素B6的天然过量生产者,野生型产量可达100 mg/L,Hoshino等[62]在该菌株中过表达dxs基因,同时引入并过表达大肠杆菌的epd基因,维生素B6的产量增加到1.3 g/L。Commichau等[63]将来源于S. meliloti IFO14782的pdxR、serC、pdxA和pdxJ基因和来自E. coli的epd基因进行密码子优化、组装并在B. subtilis中进行了异源表达,维生素B6的产量达41 mg/L,但该异源表达体系存在途径酶表达不平衡问题,有毒中间体4HTP (4-phosphohydroxy-L-threonine,4-磷酸-L-苏糖醇)积累显著影响细胞的正常生长(抑制苏氨酸合成)。另一条是来源于磷酸戊糖途径的4-羟基-L-苏氨酸(4-hydroxy-L-threonine, 4HT)转化为4HTP进入代谢路径。Commichau等[64]发现枯草芽孢杆菌(B. subtilis)的突变体对4HT (同样抑制苏氨酸合成)具有内源性抗性,通过引入E. coli的pdxA基因和S. meliloti的pdxJ、thrB基因,维生素B6产量达65 mg/L,但4TH到维生素B6的转化率较低,说明有部分底物流入了尚未明确的宿主途径中,需要通过进一步研究削弱相关代谢途径以提高转化率。
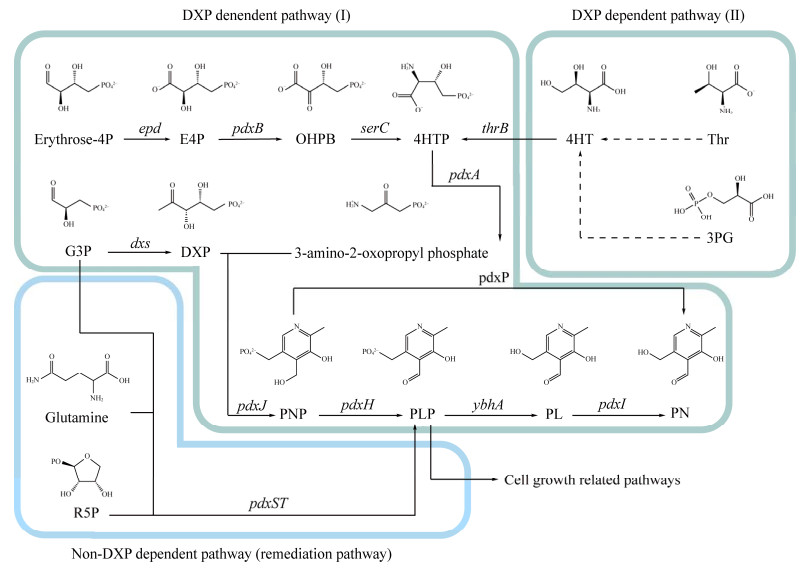
|
| 图 6 维生素B6生物合成路径 Fig. 6 Vitamin B6 Biosynthetic pathway. 3PG: 3-phospho-glycerate; Thr: Threonine; 4HT: 4-hydroxy-L-threonine; Erythrose-4P: Erythrose-4-phosphate; E4P: 4-phosphoerythronate; OHPB: 3-phospho-4-hydroxy-phospho-α-ketobutyrate; 4HTP: 4-phosphohydroxy-L-threonine; G3P: Glyceraldehyde-3-phosphate; DXP: Deoxyxylulose 5-phosphate; R5P: Ribose-5-phosphate; PNP: 5′-phosphopyridoxine; PLP: Phosphopyridoxal; PL: Pyridoxal; PN: Pyridoxine. |
| |
补救途径,又称非DXP依赖途径,谷氨酰胺在基因pdxST作用下与甘油醛3-磷酸、D-核糖5-磷酸缩合形成维生素B6[59]。该途径的通量不高,因此并不适合作为维生素B6的主要合成途径,但最近的研究发现该途径被作为解耦合成与生长的回补路径显著提升了维生素B6的合成:Liu等[65]在E. coli中为了解耦大肠杆菌中维生素B6生产与自身代谢,敲除了pdxH基因阻断5′-磷酸吡哆醇(pyridoxine 5′-phosphate, PNP)向5′-磷酸吡哆醛(pyridoxal 5′-phosphate, PLP)转化,将其引入到吡哆醇(pyridoxine, PN)生产途径中;同时为了补偿细胞生长所需的PLP,引入了B. subtilis的pdxST基因并结合启动子微调,通过非DXP依赖型途径产生少量PLP以满足生长需要。在整体优化方面,Liu等[65]将维生素B6合成途径以有毒中间体4HTP为标志分为上游推送与下游拉取两部分进行改造:上游推送模块中,对反应初始处的Epd和Dxs酶分别进行了同源基因挖掘与异源替换,并将中间酶SerC在上游酶PdxB附近过表达,有效提高了目标产物合成途径的代谢通量,产生了足够的前体4HTP与DXP;下游拉取模块中,对反应瓶颈处的PdxA和PdxJ酶进行重新设计与编码序列的密码子优化,提高了催化效率并降低了有毒中间体4HTP的积累,最终维生素B6补料分批发酵产量达1 409 mg/L。
1.6 维生素B7维生素B7又称为维生素H或生物素,是脂肪和蛋白质正常代谢中不可或缺的物质。
维生素B7的化学合成采取Sternbach合成路线[66]。由于生物素具有3个手性中心,分子结构复杂,因此化学合成属不对称合成,且需要进行光学拆分。该方法技术要求较高、生产时间较长,但其成本较低,因此仍是当前工业化生产维生素B7的主流方法。
2022年全球维生素B7市场规模达2.6亿美元,预计2026年市场规模将达到3.8亿美元;同年,维生素B7市场销售额达到了1.7亿美元,预计2029年将达到2.1亿美元;现阶段,我国已成为全球维生素B7生产和出口大国,国内企业在国际市场上占据的地位越来越高,其供应商主要有新和成(浙江省)、圣达生物(山东省)、泰格(安徽省)、科兴生物(济南市)、海嘉诺(上海市)、浙江医药(浙江省)等,六大企业合计市场占比超9成。亚太是全球最大的市场,占有大约33%的市场份额,之后是欧洲和北美,分别占比30%和25%[67]。
维生素B7的生物合成研究早期是基于生物素天然生产菌种如百脉根中间根瘤菌(Mesorhizobium loti)、球形芽孢杆菌(Bacillus sphaerieus)、酿酒酵母(Saccharomyces cerevisiae)等,通过调节启动子、解除反馈抑制等方法,提高生物素的产量。Streit等[68]在土壤杆菌(Agrobacterium)和根瘤菌(Rhizobium) HK40中过表达来源于E. coli的启动子tac,并向BioB (生物素合成酶)引入修饰后的核糖体结合位点(ribosome binding site, RBS),使生物素产量达110 mg/L。
对常见底盘的经典诱变结合代谢改造的研究也取得了一定的成果,Kanzaki等[69]对E. coli的诱变与改造使生物素产量达970 mg/L,Bower等[70]在B. subtilis中的诱变及对生物素操纵子基因的调控则使生物素产量超过1 g/L。
对生物素合成途径的研究发现,其限速步骤以及全过程的过表达可以显著增强生物素积累。Ifuku等[71]与Chakravartty等[72]分别就E. coli的bioB基因操纵子与briA基因对应的酶活性位点进行了研究,确定了生物素合成中的限速步骤。Lin等[73]和Ikeda等[74]分别就E. coli、C. glutamicum、P. mutans的生物素合成限速步骤进行了研究,发现在E. coli和P. mutans中生物素合成依赖于bioC-bioH通路(图 7),而C. glutamicum中则存在bioI-bioW通路。Xiao等[75]基于此对P. mutans采取了以下4个举措:通过启动子和核糖体结合位点工程,过表达bioC-bioH路径的限速酶;同时删除负调节因子和生物素输入基因以解除生物素生物合成的调节;加强生物素生物合成辅助因子(S-腺苷-L-蛋氨酸和[Fe-S]簇)的供应;从B. subtilis引入BioI-BioW途径,使生物素产量达271.88 mg/L。Wei等[76]以E. coli为底盘,引入了来自P. putida的生物素操纵子基因(bioBFHCD集群和1个bioA基因)、来自B. subtilis的bioW基因(编码pimeloyl-CoA合酶)和来自S. cerevisiae的sam2基因(编码S-腺苷-L-甲硫氨酸合酶),以促进生物素的生产。在补加前体庚二酸和L-甲硫氨酸的条件下生物素产量达208.7 mg/L。但来自Manandhar等[77]的研究表明过表达生物素合成途径基因会导致其中间代谢产物量下降,对菌体的生长产生不利的影响。

|
| 图 7 维生素B7生物合成路径 Fig. 7 Vitamin B7 Biosynthetic pathway. Pseudomonas putida genes are marked in black, and Bacillus subtilis genes are marked in red. ACP: Acyl carrier protein. |
| |
维生素B9又称叶酸,是一组化学结构相似,生化特征相近的化合物的统称,由蝶啶、对氨基苯甲酸与一个或多个谷氨酸结合而成,参与核苷酸和氨基酸的合成。
维生素B9的化学生产合成方法成本低、产能高,是现阶段工业生产的主流方法,但由于涉及不对称中心的拆分,该过程中5-MeTHF易失活,故而收率不理想。
2021年全球维生素B9原料药市场规模达到了7 244万美元,预计2028年将达到10 457万美元;中国占据了全球将近90%的产量,2021年市场产量规模为5 770万美元,约占全球的87.9%,预计2028年将达到8 190万美元,届时全球占比将达到88.0%;中国的维生素B9大部分用来出口,出口比例接近60%,国内消费量较小;2021年,中国国内销售收入约为1 990万美元,约占全球的27.5%,到2028年国内销售收入将达到2 820万美元;目前全球维生素B9主要生产厂商包括江西天新药业、帝斯曼(DSM)、常州制药、常州牛塘化工、河北冀衡药业、浙江圣达生物、常州新鸿医药等,2021年前7大主要厂商份额占比超过74%[78]。
维生素B9的生物法合成主要采用以下几种底盘:在原核生物中,利用乳酸杆菌(Lactobacillus)和嗜热链球菌(Streptococcus thermophilus)等乳酸菌可从头生产叶酸[79],该方法常用于乳制品生产中,通过乳酸菌直接增加产品的维生素B9含量[80],但乳酸菌用于大规模工业化生产时需要复杂的营养培养基,且过程的优化和控制相对困难[81]。Jägerstad等[82]在B. subtilis中,通过增加前体物质供应,并阻断5-甲基四氢叶酸的分解代谢途径(图 8),5-MeTHF (5-methyltetrahydrofolate,5-甲基四氢叶酸)产量达到952.05 μg/L。
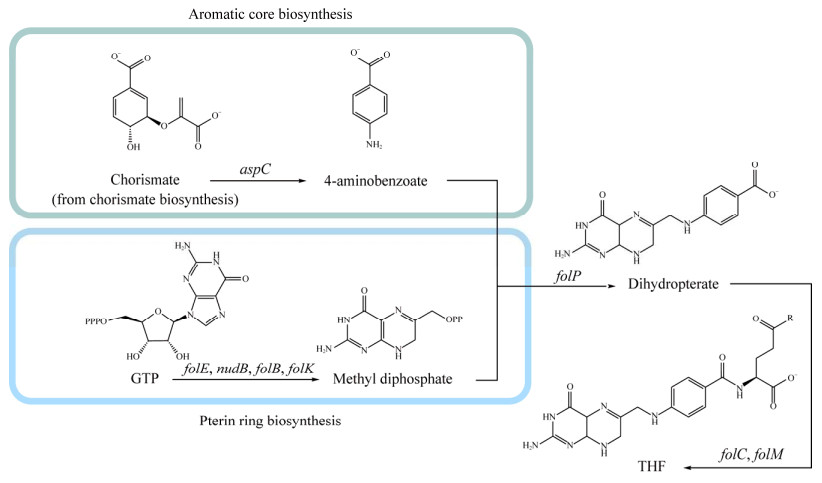
|
| 图 8 维生素B9生物合成路径 Fig. 8 Vitamin B9 Biosynthetic pathway. GTP: Guanosine triphosphate; THF: Tetrahydrogen folic acid. |
| |
近年来,以真核生物为底盘进行叶酸发酵研究取得了一定进展[83-84]。酿酒酵母菌株和其他酵母菌,如洛氏梅奇酵母(Metschnikowia lochheadii)、嗜蜜德巴氏酵母菌(Debaryomyces melissophilus)和万氏德巴氏酵母菌(Debaryomyces vanrijii)是天然的叶酸生产者,其叶酸产量相对于细胞干重可达40–140 μg/g[85]。毕赤酵母(Scheffersomyces stipitis)作为一种Crabtree阴性酵母(Crabtree效应,克勒勃屈利效应,也称葡萄糖效应,指的是高浓度葡萄糖培养基和有氧条件下细胞生长受到抑制且生成乙醇,而毕赤酵母不受该效应影响)[86],且其代谢途径中存在磷酸戊糖途径[87],较高的戊糖途径通量有助于中间产物赤藓糖4-磷酸积累并协助叶酸合成[88],因此被视为生产叶酸的优良底盘。Mastella等[89]利用S. stipitis发酵生产叶酸,通过向培养基中加入木糖,向磷酸戊糖途径补充戊糖以增加代谢通量,有效提高了叶酸的产量,其野生型叶酸产量达3.72 mg/L。棉阿舒囊霉(Ashbya gossypii)野生型叶酸产量达40 μg/L,经FOL基因的过表达、GTP环水解酶限制步骤的解除与竞争路径代谢通量的重定向,产量达6 595 μg/L[90]。
1.8 维生素B12维生素B12又称钴胺素,是一种含有3价钴的多环系化合物。氰钴胺和羟钴胺是钴胺素的合成形式,而腺苷钴胺素和甲基钴胺素作为辅因子参与酶反应过程。
Eschenmoser等[91]研究出了维生素B12的化学合成方法,但该过程由70多个合成步骤组成,复杂程度高。因此现阶段的维生素B12工业生产方法为发酵法。
2022年中国维生素B12市场规模达到4.15亿元,全球市场规模为15.18亿元,其中国内维生素B12市场容量为4.15亿元,全球维生素B12市场规模将以7.05%的平均增速增长, 预计在2028年达到23.01亿元;目前,维生素B12行业内重点企业有华北制药(中国)、Sanofi (法国)、华荣制药(中国)、金维制药(中国)[92]。
微生物从头合成维生素B12主要通过两种途径进行,即需要氧(有氧)和氧敏感(厌氧)途径,每种途径都涉及20多个酶促步骤和大约30个基因。此外,一些菌株还可以通过补救途径吸收类钴胺素来合成钴胺素。
天然生产维生素B12的微生物有丙酸杆菌(Propionibacterium)、脱氮假单胞菌(Pseudomonas denitrificans)、巨大芽孢杆菌(Bacillus megaterium)和诺卡氏菌(Nocardia)等[94]。其中丙酸杆菌(包括P. shermanii和P. freudenreichii两种)和脱氮假单胞菌被用于工业生产。其中丙酸杆菌产量略低,但菌体具有不产生内外毒素的优势;而脱氮假单胞菌产量更高。早期的维生素B12生物法合成研究主要集中于诱变的方法[93]。Martens等[94]将随机诱变与基因工程方法相结合,提高了维生素B12的产量。
近年来,许多代谢工程策略也被应用于维生素B12的生产中。Kiatpapan等[95-96]在丙酸杆菌中更换了链霉菌(Streptomyces)基因choA、球形红细菌(Rhodobacter sphaeroides)基因hemA的启动子并进行了异源表达,两者对应的酶活均提升了2倍左右。基于此,Piao等[97]进一步尝试了在P. freudenreichii IFO1242中表达了hem、cob、cbi这3个与维生素B12合成相关的基因家族,其中cobA过表达使维生素B12产量相较于野生型提高了1.7倍。通过进一步整合hemAB与cobA,产量达1.7 mg/L。
维生素B12核糖开关对维生素B12的生物合成影响也有报道,Cai等[98]在S. meliloti中通过构建核糖开关文库,选取来自鼠伤寒沙门菌(Salmonella typhimurium)的btuB为调控元件,将产量提升至156 mg/L,但发酵周期长达1周,无法应用于实际生产。Moore等[99]开发了一种基于质粒的表达策略,克隆了不含调节元件的cbi操纵子以绕过钴胺素对核糖开关的影响;这些菌株在以甘油作为碳源的最小培养基上生长,产量达200 mg/L,是当前报道的最大值,且业界普遍认为,通过优化发酵条件,钴胺素的产量可被提升至300 mg/L。
维生素B12的无细胞体系酶法催化也有新的进展。Fang等[100]以5-氨基乙酰丙酸(5-aminolevulinic acid, 5-ALA)为原料,通过无细胞反应体系进行级联催化反应合成AdoCbl的方法;整合并优化了30多个生物催化反应,克服了反馈抑制、检测复杂、中间产物不稳定、辅因子不平衡与竞争等问题,实现了维生素B12的无细胞合成,其以5-氨基乙酰丙酸(5-ALA)为底物时的产量达417.41 μg/L。
2 维生素C维生素C又称抗坏血酸,是体内多种酶促反应途径的重要辅助因子,其还原性在清除氧化自由基上发挥重要作用。维生素C是全球产销规模最大的维生素品种之一,其生产商主要集中于中国,70%以上的产品主要用于出口,2021年山东省维生素C出口额完成26 539.94万美元,占全国维生素C出口总额的28.17%,全国排名第一;河北省维生素C出口额完成24 464.13万美元,占全国维生素C出口总额的25.96%,全国排名第二;江苏省维生素C出口额完成15 298.43万美元,占全国维生素C出口总额的16.24%,全国排名第三[101]。主要出口地为美国、德国、荷兰、日本,其中美国占比第一,占比20.17%,德国占比第二,占比9.57%,荷兰占比8%,日本占比6.35%,其他国家占比51.03%。目前维生素C主要产商有石药集团、山东鲁维、江山制药(2015年被帝斯曼收购)、山东天力、东北制药、新和成等企业[101]。
维生素C的工业合成一般是首先合成中间体2-酮-L-古洛糖酸(L-xylo-hex-2-ulosonic acid, 2-KLG),再将该中间体经盐酸酸化即可获得维生素C。最经典的中间体工业生产方法是莱氏法,一种混合发酵法。该方法使用低聚酮酸钾和氧化葡萄糖酸杆菌(Gluconobacter oxydans)共同生产2-KLG[102],但该方法需要用到有毒试剂,且成本相对较高。我国科学家尹光琳等[103]基于莱氏法作出了改进,发明了由G. oxydans、巨大芽孢杆菌(Bacillus megaterium)和普通生酮基古龙酸菌(Ketogulonicigenium vulgare)组成的三菌二步发酵法,D-山梨糖醇首先通过G. oxydans转化为山梨糖,山梨糖由混菌体系:大菌(伴生菌,负责促进小菌生长及产酸) B. megaterium和小菌(产酸菌,负责将山梨糖转化为2-KLG) K. vulgare转化为2-KLG,该方法不使用有毒化学试剂,而且成本更低。但混菌发酵技术相较于单菌发酵存在稳定性差、效率低的问题,制约了其大规模标准化生产。为了消除混菌体系的影响,研究者提出了以下两个思路:(1) 用活性物质替代伴生菌,保证产酸菌正常生长。满都拉等[104]应用蛋白作为伴生活性物质取代伴生菌,单菌发酵有效提高了维生素C的收率,同时缩短了发酵周期。在产酸菌方面,Wang等[105]向传统产酸菌K. vulgare引入磷酸酮酶(xfp)和磷酸转乙酰酶(pta)基因构成的糖代谢途径(涉及乙酰CoA生物合成),使得2-KLG产量增加了22.27%。(2) 选育无须伴生菌的产酸菌。Wang等[106]发现新菌株产酮古洛糖酸菌(Ketogulonicigenium robustum) SPU_B003的单菌发酵产率高于K. vulgare,并根据两者的基因组差异推测完整的生物合成途径有助于提高产酸菌2-KLG产量。Sugisawa等[107]利用K. vulgare DSM 4025单菌发酵L-山梨醇,不再生成中间体而直接生成1.37 g/L抗坏血酸,简化了流程。Sauer等[108]利用过表达内源性D-阿拉伯糖基-1,4-内酯氧化酶以及L-半乳糖脱氢酶的出芽酵母细胞,以半乳糖为前体产生100 mg/L的抗坏血酸。Zeng等[109]在大肠杆菌中表达山梨糖/山梨醇脱氢酶,优化催化条件重组表达吡咯喹啉醌(pyrroloquinoline quinone, PQQ),以L-山梨糖为底物全细胞催化生产2-KGA产量达72.4 g/L。在以G. oxydans为底盘的实验中,Li等[110-111]通过平衡细胞内和细胞外D-葡萄糖代谢通量,同时引入山梨酮脱氢酶与山梨糖脱氢酶,系统地增强了整个2-KLG生物合成途径,成功实现了“一菌一步法”的维生素C合成。工程菌株产生30.5 g/L 2-KLG,转化率达39.0%。
3 总结与展望水溶性维生素广泛参与生物体的各类生理活动,对生物体正常生长发育起着不可或缺的作用。生物法合成水溶性维生素以其安全高效、绿色环保的优势,对于工业合成水溶性维生素有着重要的研究意义与应用价值。早期研究主要通过诱变手段来选育具有较高水溶性维生素生产潜力的菌株,并获得了一定成果。但诱变法本身的不可控性极大提高了工作量,且无法明确菌株高产机理以供进一步修饰。随着基因测序、基因编辑、高通量筛选技术的发展,生物法生产水溶性维生素进入了新的阶段。采用代谢工程对维生素的生物合成路径进行改造,向底盘菌株中引入新的代谢通路或调整原有的代谢通路,在保证菌株正常生理活动的前提下,尽可能多地将物质与能量引入水溶性维生素的代谢途径中,实现菌株正常生长与高产水溶性维生素之间的平衡。
在B族维生素中,迄今为止只有维生素B2的全途径生物合成技术相对成熟并用于实际生产(商业化菌株),其未来研究方向可采用鲁棒性更强的菌株(如耐高温酵母)作为底盘以提高工程菌抗逆性能。其余维生素的生物合成中,维生素B5、维生素B12已经实现用发酵法进行工业化生产,但仍有较大的提升空间,而维生素B1、维生素B6、维生素B7、维生素B9的生物合成仍处于研究阶段。这些维生素的生物合成研究思路与维生素B2较为类似,都是在底盘中构建以葡萄糖等简单底物为原料合成对应水溶性维生素的代谢途径。以维生素B5为例,作为一种双前体(D-泛解酸与β-丙氨酸)合成的水溶性维生素,现有主流的研究思路是“合成D-泛解酸,补充β-丙氨酸”以降低维生素B5的合成对底盘菌造成的压力,研究者通过过表达等方式对维生素B5代谢通路进行增强,同时通过对相关通路进行调整,通过削弱非必要的途径,将更多的代谢通量引入维生素B5的代谢通路中。维生素B3合成技术的研究思路则是获取转化速率高、原料利用率高的水解/水合酶用于中间产物3-取代吡啶至烟酸或烟酰胺的酶法催化[37-41],这一思路在维生素B5的酶法拆分、维生素B12的全酶法合成中也有体现。其余B族维生素的合成只实现了部分途径的生物合成,全合成途径还存在着代谢通量失衡、中间产物损失、次生代谢物存在毒性造成目标产物产量低等通性问题需要研究者进一步解决。维生素C的合成目前已有较为成熟的“三菌两步”生物合成方法,但第二步中的混菌发酵对发酵控制提出了较高的要求,因此现有的研究方向为将伴生菌替换为生物活性物质或构建无须伴生菌的工程产酸菌株,实现单菌发酵[104-105]。同时,提高产酸菌的转化效率也是研究方向之一。周景文团队[109]目前已经实现了“一菌一步”生物合成方法,解决了目前“三菌两步”生物合成法步骤繁琐、周转发酵液费时费力的问题,但生产效率低,未能实现工业化,还需研究者们进一步深入研究。
现如今,通过对细胞内代谢流的重新分配以实现水溶性维生素的增产的研究取得了一定成果(表 1)。但传统的代谢工程方法在实践过程中遇到了一些问题:在将代谢通量引入水溶性维生素合成途径后,产量提高不及预期乃至降低。这是由于目前对生物体代谢的认识仍处于较为浅显的阶段,对基因间相互作用与细胞资源平衡等方面的了解并不深入,许多调整代谢通路的操作并未考虑该过程对相关基因及代谢平衡的影响。基于此,合成生物学方法通过对代谢途径“由个体到整体的重新设计”,为优化代谢途径以及代谢途径与细胞的适配提供了新的思路与方法[112]。除了对生物底盘的理性认知,最难也是急需的一点则是对预测合理编辑和合成生物底盘的软件工具的开发和应用。近期“新质生产力”作为最大的焦点之一在国内引起了广泛关注。目前世界正处于第四次工业革命的窗口期,合成生物产业作为新时代创新的主力军,必将为我国高质量发展作出不可或缺的贡献。随着新技术的不断涌现以及对生物体代谢途径研究的不断深入,相信水溶性维生素的生物合成将为工业生产提供更好的方案。
| Vitamin | Species | Method | Yield (mg/L) | References |
| VB1 | E. coli | Mutant PT-R1 | 1.6 | [18] |
| thiFSGHOE, thiCOE, thiEOE, thiDOE, thiMOE | 0.8 | [18] | ||
| B. subtilis | ΔthiN, ΔykoD, ΔyuaJ | 1.2 | [17] | |
| VB2 | A. gosypii | Wide-type | 5 000 | [27] |
| W122032, Mutant | 13 700 | [28] | ||
| C. famata | ATCC 20849; 20850, mutated | 20 000 | [29] | |
| B. subtilis | RH44, media optimization | 16 400 | [30] | |
| KCCM 10445, Mutant | 26 800 | [31] | ||
| C. ammoniagenes | GTP cyclohydrolase Ⅱ modification | 15 300 | [32] | |
| E. coli | ΔpurR, guaCGD, fbpOE, purF OE, prs OE, gmk OE, ndk OE | 21 000 | [33] | |
| L. plantarum | Wide-type | 0.6 | [34] | |
| P. freudenreichii | Wide-type | 3 | [34] | |
| VB3 | S. cerevisiae | Δnrt1, Δnrkl, Δurhl, Δpmpl | 8 | [43] |
| VB5 | C. glutamicum | ΔilvA, ilvBNCDOE, panBCOE | 1 000 | [53] |
| B. subtilis | ilvBHCDOE, panBCDEOE, serAOE, glyAOE | 63 000 | [49] | |
| E. coli | zwfOE, icdOE, maeBOE, pntABOE, sthAOE, yfjBOE, ppnkOE, pos5OE | 63 580 | [44] | |
| epdOE, pdxJOE, dxsOE | ||||
| VB6 | E. coli | dxsOE, E. coli epdOE | 78 | [61] |
| S. meliloti | E. coli pdxAOE, S. meliloti pdxJOE, thrBOE | 1 300 | [62] | |
| B. subtilis | epdGR, dxsGR, pdxAGR, pdxJGR, SerCOE, ΔpdxH, B. subtilis pdxSTOE | 65 | [64] | |
| E. coli | Modified biotinoperonOE, BioBOE | 1 409 | [65] | |
| Agrobacterium | Mutant | 110 | [68] | |
| VB7 | E. coli | P. putida bioABFHCDOE, B. subtilis | 970 | [69] |
| bioW OE, yeast sam2OE | 209 | [76] | ||
| B. subtilis | Mutant | > 1 000 | [70] | |
| P. mutans | bioC-bioHOE, B. subtilis BioW-BioIOE | 272 | [73-75] | |
| VB9 | B. subtilis | Block 5-methyltetrahydrofolate catabolic pathway | 0.95 | [82] |
| S. stipitis | Wide-type | 3.7 | [89] | |
| A. gossypii | Δmet7; Δade12; Δrib1; folOE | 6.6 | [90] | |
| VB12 | S. meliloti | hemEOE, ΔcobI | 156 | [98] |
| P. freudenreichii | hemOE, cobOE, cbiOE | 1.7 | [97] | |
| P. denitrificans | cobFOE-cobMOE, cogAOE, cobEOE | 214 | [99] | |
| P. shermanii | Overexpression of related biosynthetic genes | 206 | [99] | |
| VC | G. oxydans | Overexpression of related biosynthetic genes | 30 500 | [110-111] |
| E. coli, G. oxydans | E. coli: expression of different sorbide/sorbitol dehydrogenase | 72 400 | [109] |
| [1] |
王宏亮. 维生素的概述及研究进展[J]. 临床药物治疗杂志, 2022, 20(12): 40-45. WANG HL. Overview and research progress of vitamins[J]. Clinical Medication Journal, 2022, 20(12): 40-45 (in Chinese). DOI:10.3969/j.issn.1672-3384.2022.12.008 |
| [2] |
张莲玮. 维生素行业深度报告: 13个主要维生素品种生产工艺与市场格局解析[EB/OL]. [2024-02-28]. http://stock.finance.sina.com.cn/stock/go.php/vReport_Show/kind/lastest/rptid/641126651806/index.phtml.
|
| [3] |
NISHIHIRA K, NAKAI MJKK. New process for vitamin B1 intermediate[J]. 1991, 55: 433.
|
| [4] |
CHUCK RJ, ZACHER U. Process for the preparation of nicotinic acid: US6077957A[P]. 2000-06-20.
|
| [5] |
NIELSEN J. Metabolic engineering[J]. Applied Microbiology and Biotechnology, 2001, 55(3): 263-283. DOI:10.1007/s002530000511
|
| [6] |
STEPHANOPOULOS G, VALLINO JJ. Network rigidity and metabolic engineering in metabolite overproduction[J]. Science, 1991, 252(5013): 1675-1681. DOI:10.1126/science.1904627
|
| [7] |
BAILEY JE. Toward a science of metabolic engineering[J]. Science, 1991, 252(5013): 1668-1675. DOI:10.1126/science.2047876
|
| [8] |
BENNER SA, SISMOUR AM. Synthetic biology[J]. Nature Reviews Genetics, 2005, 6: 533-543.
|
| [9] |
KEASLING JD. Synthetic biology for synthetic chemistry[J]. ACS Chemical Biology, 2008, 3(1): 64-76. DOI:10.1021/cb7002434
|
| [10] |
ANDRIANANTOANDRO E, BASU S, KARIG DK, WEISS R. Synthetic biology: new engineering rules for an emerging discipline[J]. Molecular Systems Biology, 2006, 2: 2006.0028. DOI:10.1038/msb4100073
|
| [11] |
TYO KE, ALPER HS, STEPHANOPOULOS GN. Expanding the metabolic engineering toolbox: more options to engineer cells[J]. Trends in Biotechnology, 2007, 25(3): 132-137. DOI:10.1016/j.tibtech.2007.01.003
|
| [12] |
CLINE JK, WILLIAMS RR, FINKELSTEIN J. Studies of crystalline vitamin B1. XVII. synthesis of vitamin B1[J]. Journal of the American Chemical Society, 1937, 59(6): 1052-1054. DOI:10.1021/ja01285a026
|
| [13] |
HROMATKA O. Process of preparing Derivatives of pyrimidine: US2235638A[P]. 1941-03-18.
|
| [14] |
中国维生素B1 (单硝酸硫胺素)行业规模及市场格局分析报告[EB/OL]. [2024-02-28]. https://www.sohu.com/a/758568194_121825642.
|
| [15] |
2022–2028全球及中国维生素B1 (食品应用)行业研究及"十四五规划"分析报告[EB/OL]. [2024-02-28]. https://www.qyresearch.com.cn/reports/vitamin-b1-food-application-p940752.html.
|
| [16] |
BEGLEY TP, DOWNS DM, EALICK SE, McLAFFERTY FW, van LOON APGM, TAYLOR S, CAMPOBASSO N, CHIU HJ, KINSLAND C, REDDICK JJ, XI J. Thiamin biosynthesis in prokaryotes[J]. Archives of Microbiology, 1999, 171(5): 293-300. DOI:10.1007/s002030050713
|
| [17] |
SCHYNS G, POTOT S, GENG Y, BARBOSA TM, HENRIQUES A, PERKINS JB. Isolation and characterization of new thiamine-deregulated mutants of Bacillus subtilis[J]. Journal of Bacteriology, 2005, 187(23): 8127-36. DOI:10.1128/JB.187.23.8127-8136.2005
|
| [18] |
CARDINALE S, TUEROS FG, SOMMER MOA. Genetic-metabolic coupling for targeted metabolic engineering[J]. Cell Reports, 2017, 20(5): 1029-1037. DOI:10.1016/j.celrep.2017.07.015
|
| [19] |
KAWASAKI T, IWASHIMA A, NOSE Y. Regulation of thiamine biosynthesis in Escherichia coli[J]. The Journal of Biochemistry, 1969, 65(3): 407-416. DOI:10.1093/oxfordjournals.jbchem.a129028
|
| [20] |
ROCCHI R, WOLKERS-ROOIJACKERS JCM, LIAO ZT, TEMPELAARS MH, SMID EJ. Strain diversity in Saccharomyces cerevisiae thiamine production capacity[J]. Yeast, 2023, 40(12): 628-639. DOI:10.1002/yea.3906
|
| [21] |
KAWASAKI Y, NOSAKA K, KANEKO Y, NISHIMURA H, IWASHIMA A. Regulation of thiamine biosynthesis in Saccharomyces cerevisiae[J]. Journal of Bacteriology, 1990, 172(10): 6145-6147. DOI:10.1128/jb.172.10.6145-6147.1990
|
| [22] |
STROBBE S, VERSTRAETE J, STOVE C, van der STRAETEN D. Metabolic engineering provides insight into the regulation of thiamin biosynthesis in plants[J]. Plant Physiology, 2021, 186(4): 1832-1847. DOI:10.1093/plphys/kiab198
|
| [23] |
MINHAS AP, TULI R, PURI S. Pathway editing targets for thiamine biofortification in rice grains[J]. Frontiers in Plant Science, 2018, 9: 975. DOI:10.3389/fpls.2018.00975
|
| [24] |
ERNST H, SCHMIDT W, PAUST J. Preparation of riboflavin: US4567261A[P]. 1986-01-28.
|
| [25] |
ERNST H, ECKHARDT H, PAUST J. Preparation of riboflavin, and 4,5-dimethyl-N-(D)-ribityl-2-(O-alkoxyphenylazo)-aniline intermediates: US4656275A[P]. 1987-04-07.
|
| [26] |
新用途加持维生素B2销量破纪录[EB/OL]. [2024-02-28]. https://www.yyjjb.com.cn/yyjjb/202108/20210823153308338_10868.shtml.
|
| [27] |
SZCZEŚNIAK T, KARABIN L, SZCZEPANKOWSKA M, WITUCH K. Biosynthesis of riboflavin by Ashbya gossypii. Ⅰ. The influence of fats of the animal origin on the riboflavin production[J]. Acta Microbiologica Polonica Series B: Microbiologia Applicata, 1971, 3(1): 29-34.
|
| [28] |
PARK EY, ITO Y, NARIYAMA M, SUGIMOTO T, LIES D, KATO T. The improvement of riboflavin production in Ashbya gossypii via disparity mutagenesis and DNA microarray analysis[J]. Applied Microbiology and Biotechnology, 2011, 91(5): 1315-1326. DOI:10.1007/s00253-011-3325-0
|
| [29] |
DONALD LH, CRAIG AW, MICHAEL JY, LINDA AB. Method for producing riboflavin with Candida famata: US5164303A[P]. 1992-11-17.
|
| [30] |
WU QL, CHEN T, GAN Y, CHEN X, ZHAO XM. Optimization of riboflavin production by recombinant Bacillus subtilis RH44 using statistical designs[J]. Applied Microbiology and Biotechnology, 2007, 76(4): 783-794. DOI:10.1007/s00253-007-1049-y
|
| [31] |
HAN LK, HYANG C, HO LK, APT. KS, KWON HJ, HOON PY, HEE PJ. Microorganisms and process for the production of riboflavin by fermentation: EP1426450A1[P]. 2004-06-09.
|
| [32] |
KOIZUMI S, YONETANI Y, MARUYAMA A, TESHIBA S. Production of riboflavin by metabolically engineered Corynebacterium ammoniagenes[J]. Applied Microbiology and Biotechnology, 2000, 53(6): 674-679. DOI:10.1007/s002539900295
|
| [33] |
LIU S, HU WY, WANG ZW, CHEN T. Rational engineering of Escherichia coli for high-level production of riboflavin[J]. Journal of Agricultural and Food Chemistry, 2021, 69(41): 12241-12249. DOI:10.1021/acs.jafc.1c04471
|
| [34] |
THAKUR K, TOMAR SK, DE S. Lactic acid bacteria as a cell factory for riboflavin production[J]. Microbial Biotechnology, 2016, 9(4): 441-451. DOI:10.1111/1751-7915.12335
|
| [35] |
KULKA M. Electrolytic oxidation of quinoline and 3-picoline[J]. Journal of the American Chemical Society, 1946, 68(12): 2472. DOI:10.1021/ja01216a008
|
| [36] |
烟酸(维生素B3)市场出货量及增长分析[EB/OL]. [2024-02-18]. https://www.shangyexinzhi.com/article/10495614.html.
|
| [37] |
MATHEW CD, NAGASAWA T, KOBAYASHI M, YAMADA H. Nitrilase-catalyzed production of nicotinic acid from 3-cyanopyridine in Rhodococcus rhodochrous J1[J]. Applied and Environmental Microbiology, 1988, 54(4): 1030-1032. DOI:10.1128/aem.54.4.1030-1032.1988
|
| [38] |
SHARMA NN, SHARMA M, KUMAR H, BHALLA TC. Nocardia globerula NHB-2: bench scale production of nicotinic acid[J]. Process Biochemistry, 2006, 41(9): 2078-2081. DOI:10.1016/j.procbio.2006.04.007
|
| [39] |
BADOEI-DALFARD A, KARAMI Z, RAMEZANI-POUR N. Bench scale production of nicotinic acid using a newly isolated Stenotrophomonas maltophilia AC21 producing highly-inducible and versatile nitrilase[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: S552-S559. DOI:10.1016/j.molcatb.2016.11.019
|
| [40] |
PAI O, BANOTH L, GHOSH S, CHISTI Y, BANERJEE UC. Biotransformation of 3-cyanopyridine to nicotinic acid by free and immobilized cells of recombinant Escherichia coli[J]. Process Biochemistry, 2014, 49(4): 655-659. DOI:10.1016/j.procbio.2014.01.023
|
| [41] |
DONG TT, GONG JS, GU BC, ZHANG Q, LI H, LU ZM, LU ML, SHI JS, XU ZH. Significantly enhanced substrate tolerance of Pseudomonas putida nitrilase via atmospheric and room temperature plasma and cell immobilization[J]. Bioresource Technology, 2017, 244(Pt 1): 1104-1110.
|
| [42] |
GONG JS, ZHANG Q, GU BC, DONG TT, LI H, LI H, LU ZM, SHI JS, XU ZH. Efficient biocatalytic synthesis of nicotinic acid by recombinant nitrilase via high density culture[J]. Bioresource Technology, 2018, 260: 427-431. DOI:10.1016/j.biortech.2018.03.109
|
| [43] |
BELENKY P, STEBBINS R, BOGAN KL, EVANS CR, BRENNER C. Nrt1 and Tna1-independent export of NAD+ precursor vitamins promotes NAD+ homeostasis and allows engineering of vitamin production[J]. PLoS One, 2011, 6(5): e19710. DOI:10.1371/journal.pone.0019710
|
| [44] |
ZOU SP, ZHANG Z, ZHAO K, LIU ZQ, ZHENG YG. Metabolic engineering of Escherichia coli for improved D-pantothenic acid biosynthesis by enhancing NADPH availability[J]. Biochemical Engineering Journal, 2022, 187: 108603. DOI:10.1016/j.bej.2022.108603
|
| [45] |
我国维生素B5市场规模逐渐扩大龙头企业已经显现[EB/OL]. [2024-02-18]. http://www.newsijie.com/chanye/yiyao/jujiao/2023/0612/11331477.html.
|
| [46] |
2022年中国维生素B5 (泛酸钙)行业现状及竞争格局分析, 价格回暖, 市场竞争加剧[EB/OL]. [2024-07-18]. https://www.huaon.com/channel/trend/902287.html.
|
| [47] |
LIU ZQ, SUN ZH. Cloning and expression of D-lactonohydrolase cDNA from Fusarium moniliforme in Saccharomyces cerevisiae[J]. Biotechnology Letters, 2004, 26(24): 1861-1865. DOI:10.1007/s10529-004-5320-3
|
| [48] |
LIU ZQ, SUN ZH, LENG Y. Directed evolution and characterization of a novel D-pantonohydrolase from Fusarium moniliforme[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 5823-5830. DOI:10.1021/jf060794m
|
| [49] |
HERMANN T, PATTERSON TA, PERO JG, YOCUM RR, BALDENIUS KU, BECK C, YOCUM RR. Processes for enhanced production of pantothenate: US7220561B2[P]. 2003-07-18.
|
| [50] |
TIGU F, ZHANG JL, LIU GX, CAI Z, LI Y. A highly active pantothenate synthetase from Corynebacterium glutamicum enables the production of D-pantothenic acid with high productivity[J]. Applied Microbiology and Biotechnology, 2018, 102(14): 6039-6046. DOI:10.1007/s00253-018-9017-2
|
| [51] |
HIKICHI Y, MORIYA T, MIKI H, YAMAGUCHI T, NOGAMI I. Production of D-pantoic acid and D-pantothenic acid: US5518906A[P]. 1996-05-21.
|
| [52] |
MORIYA T, HIKICHI Y, MORIYA Y, YAMAGUCHI T. Process for producing D-pantoic acid and D-pantothenic acid or salts thereof: US5932457A[P]. 1997-01-08.
|
| [53] |
CHASSAGNOLE C, DIANO A, LÉTISSE F, LINDLEY ND. Metabolic network analysis during fed-batch cultivation of Corynebacterium glutamicum for pantothenic acid production: first quantitative data and analysis of by-product formation[J]. Journal of Biotechnology, 2003, 104(1/2/3): 261-272.
|
| [54] |
ZHANG B, CHEN L, JIN JY, ZHONG N, CAI X, ZOU SP, ZHOU HY, LIU ZQ, ZHENG YG. Strengthening the (R)-pantoate pathway to produce D-pantothenic acid based on systematic metabolic analysis[J]. Food Bioscience, 2021, 43: 101283. DOI:10.1016/j.fbio.2021.101283
|
| [55] |
ZHANG B, ZHANG XM, WANG W, LIU ZQ, ZHENG YG. Metabolic engineering of Escherichia coli for D-pantothenic acid production[J]. Food Chemistry, 2019, 294: 267-275. DOI:10.1016/j.foodchem.2019.05.044
|
| [56] |
ABOUL-ENEIN HY, LOUTFY MA. Pyridoxine Hydrochloride[M]//FLOREY K. Analytical Profiles of Drug Substances. London: Academic Press. 1984: 447-86.
|
| [57] |
ZOU Y, SHI XJ, ZHANG GB, LI ZH, JIN C, SU WK. Improved "oxazole" method for the practical and efficient preparation of pyridoxine hydrochloride (vitamin B6)[J]. Organic Process Research & Development, 2013, 17(12): 1498-1502.
|
| [58] |
2023年中国维生素B6行业市场研究报告[EB/OL]. [2024-02-18]. https://www.sohu.com/a/685270688_120928700.
|
| [59] |
MUKHERJEE T, HANES J, TEWS I, EALICK SE, BEGLEY TP. Pyridoxal phosphate: biosynthesis and catabolism[J]. Biochimica et Biophysica Acta, 2011, 1814(11): 1585-1596.
|
| [60] |
YOCUM RR, WILLIAMS MK, PERO JG. Methods and organisms for production of B6 vitamers: US20050164335A1[P]. 2005-07-28.
|
| [61] |
HOSHINO T, ICHIKAWA K, TAZOE M. Recombinant microorganism for the production of vitamin B6: US20060228785[P]. 2006-10-12.
|
| [62] |
HOSHINO T, ICHIKAWA K, NAGAHASHI Y, TAZOE M. Microorganism and process for preparing vitamin B6: US20060127992A1[P]. 2006-06-15.
|
| [63] |
COMMICHAU FM, ALZINGER A, SANDE R, BRETZEL W, MEYER FM, CHEVREUX B, WYSS M, HOHMANN HP, PRÁGAI Z. Overexpression of a non-native deoxyxylulose-dependent vitamin B6 pathway in Bacillus subtilis for the production of pyridoxine[J]. Metabolic Engineering, 2014, 25: 38-49. DOI:10.1016/j.ymben.2014.06.007
|
| [64] |
COMMICHAU FM, ALZINGER A, SANDE R, BRETZEL W, REUß DR, DORMEYER M, CHEVREUX B, SCHULDES J, DANIEL R, AKEROYD M, WYSS M, HOHMANN HP, PRÁGAI Z. Engineering Bacillus subtilis for the conversion of the antimetabolite 4-hydroxy-L-threonine to pyridoxine[J]. Metabolic Engineering, 2015, 29: 196-207. DOI:10.1016/j.ymben.2015.03.007
|
| [65] |
LIU LX, LI JL, GAI YM, TIAN ZZ, WANG YY, WANG TH, LIU P, YUAN QQ, MA HW, LEE SY, ZHANG DW. Protein engineering and iterative multimodule optimization for vitamin B6 production in Escherichia coli[J]. Nature Communications, 2023, 14: 5304. DOI:10.1038/s41467-023-40928-0
|
| [66] |
STERNBACH LH, WOLF GM. Synthesis of biotin: US2489235A[P]. 1949-11-22.
|
| [67] |
2023–2029全球与中国维生素B7 (生物素)市场现状及未来发展趋势[EB/OL]. [2024-02-18]. https://www.qyresearch.com.cn/reports/vitamin-b7-biotin-p2058807.html.
|
| [68] |
STREIT WR, ENTCHEVA P. Biotin in microbes, the genes involved in its biosynthesis, its biochemical role and perspectives for biotechnological production[J]. Applied Microbiology and Biotechnology, 2003, 61(1): 21-31. DOI:10.1007/s00253-002-1186-2
|
| [69] |
KANZAKI N, KAWAMOTO T, MATSUI J, NAKAHAMA K, IFUKU O. Microorganism resistant to threonine analogue and production of biotin: US6284500B1[P]. 2001-09-04.
|
| [70] |
BOWER SG, PERKINS JB, YOCUM RR, PERO JG. Biotin biosynthesis in Bacillus subtilis: US6057136A[P]. 2000-05-02.
|
| [71] |
IFUKU O, HAZE S, KISHIMOTO J, KOGA N, YANAGI M, FUKUSHIMA S. Sequencing analysis of mutation points in the biotin operon of biotin-overproducing Escherichia coli mutants[J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(5): 760-765. DOI:10.1271/bbb.57.760
|
| [72] |
CHAKRAVARTTY V, CRONAN JE. The wing of a winged helix-turn-helix transcription factor organizes the active site of BirA, a bifunctional repressor/ligase[J]. The Journal of Biological Chemistry, 2013, 288(50): 36029-36039. DOI:10.1074/jbc.M113.525618
|
| [73] |
LIN S, CRONAN JE. Closing in on complete pathways of biotin biosynthesis[J]. Molecular BioSystems, 2011, 7(6): 1811-1821. DOI:10.1039/c1mb05022b
|
| [74] |
IKEDA M, NAGASHIMA T, NAKAMURA E, KATO R, OHSHITA M, HAYASHI M, TAKENO S. In vivo roles of fatty acid biosynthesis enzymes in biosynthesis of biotin and α-lipoic acid in Corynebacterium glutamicum[J]. Applied and Environmental Microbiology, 2017, 83(19): e01322-17.
|
| [75] |
XIAO F, WANG HJ, SHI ZW, HUANG QY, HUANG L, LIAN JZ, CAI J, XU ZN. Multi-level metabolic engineering of Pseudomonas mutabilis ATCC31014 for efficient production of biotin[J]. Metabolic Engineering, 2020, 61: 406-415. DOI:10.1016/j.ymben.2019.05.005
|
| [76] |
WEI PP, ZHU FC, CHEN CW, LI GS. Engineering a heterologous synthetic pathway in Escherichia coli for efficient production of biotin[J]. Biotechnology Letters, 2021, 43(6): 1221-1228. DOI:10.1007/s10529-021-03108-y
|
| [77] |
MANANDHAR M, CRONAN JE. Pimelic acid, the first precursor of the Bacillus subtilis biotin synthesis pathway, exists as the free acid and is assembled by fatty acid synthesis[J]. Molecular Microbiology, 2017, 104(4): 595-607. DOI:10.1111/mmi.13648
|
| [78] |
行业报告: 全球叶酸原料药市场规模分析[EB/OL]. [2024-02-18]. https://zhuanlan.zhihu.com/p/575981001.
|
| [79] |
LEBLANC J, GIORI G, SMID E, HUGENHOLTZ J, SESMA F. Folate production by lactic acid bacteria and other food-grade microorganisms[J]. Communicating Current Research and Educational Topics and Trends in Applied Microbiolog, 2007, 1: 329-39.
|
| [80] |
HUGENHOLTZ J, SMID EJ. Nutraceutical production with food-grade microorganisms[J]. Current Opinion in Biotechnology, 2002, 13(5): 497-507. DOI:10.1016/S0958-1669(02)00367-1
|
| [81] |
HAYEK SA, IBRAHIM SA. Current limitations and challenges with lactic acid bacteria: a review[J]. Food and Nutrition Sciences, 2013, 4(11): 73-87. DOI:10.4236/fns.2013.411A010
|
| [82] |
JÄGERSTAD M, JASTREBOVA J. Occurrence, stability, and determination of formyl folates in foods[J]. Journal of Agricultural and Food Chemistry, 2013, 61(41): 9758-9768. DOI:10.1021/jf4028427
|
| [83] |
CURRAN KA, LEAVITT JM, KARIM AS, ALPER HS. Metabolic engineering of muconic acid production in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2013, 15: 55-66. DOI:10.1016/j.ymben.2012.10.003
|
| [84] |
ZHU LH, WANG JH, XU S, SHI GY. Improved aromatic alcohol production by strengthening the shikimate pathway in Saccharomyces cerevisiae[J]. Process Biochemistry, 2021, 103: 18-30. DOI:10.1016/j.procbio.2021.01.025
|
| [85] |
HJORTMO S, PATRING J, JASTREBOVA J, ANDLID T. Inherent biodiversity of folate content and composition in yeasts[J]. Trends in Food Science & Technology, 2005, 16(6/7): 311-316.
|
| [86] |
SU YK, WILLIS LB, JEFFRIES TW. Effects of aeration on growth, ethanol and polyol accumulation by Spathaspora passalidarum NRRL Y-27907 and Scheffersomyces stipitis NRRL Y-7124[J]. Biotechnology and Bioengineering, 2015, 112(3): 457-469. DOI:10.1002/bit.25445
|
| [87] |
JEFFRIES TW, van VLEET JRH. Pichia stipitis genomics, transcriptomics, and gene clusters[J]. FEMS Yeast Research, 2009, 9(6): 793-807. DOI:10.1111/j.1567-1364.2009.00525.x
|
| [88] |
SHIN M, KIM JW, YE SJ, KIM S, JEONG D, LEE DY, KIM JN, JIN YS, KIM KH, KIM SR. Comparative global metabolite profiling of xylose-fermenting Saccharomyces cerevisiae SR8 and Scheffersomyces stipitis[J]. Applied Microbiology and Biotechnology, 2019, 103(13): 5435-5446. DOI:10.1007/s00253-019-09829-5
|
| [89] |
MASTELLA L, SENATORE VG, GUZZETTI L, COPPOLINO M, CAMPONE L, LABRA M, BELTRANI T, BRANDUARDI P. First report on Vitamin B9 production including quantitative analysis of its vitamers in the yeast Scheffersomyces stipitis[J]. Biotechnology for Biofuels and Bioproducts, 2022, 15(1): 98. DOI:10.1186/s13068-022-02194-y
|
| [90] |
SERRANO-AMATRIAIN C, LEDESMA-AMARO R, LÓPEZ-NICOLÁS R, ROS G, JIMÉNEZ A, REVUELTA JL. Folic acid production by engineered Ashbya gossypii[J]. Metabolic Engineering, 2016, 38: 473-482. DOI:10.1016/j.ymben.2016.10.011
|
| [91] |
ESCHENMOSER A. Organische naturstoffsynthese heute vitamin B12 als beispiel[J]. Naturwissenschaften, 1974, 61(12): 513-525. DOI:10.1007/BF00606511
|
| [92] |
2023年维生素B12市场需求分析: 中国维生素B12市场规模为4.15亿元[EB/OL]. [2024-02-18]. https://www.chinabgao.com/info/1248065.html.
|
| [93] |
KANG Z, ZHANG JL, ZHOU JW, QI QS, DU GC, CHEN J. Recent advances in microbial production of δ-aminolevulinic acid and vitamin B12[J]. Biotechnology Advances, 2012, 30(6): 1533-1542. DOI:10.1016/j.biotechadv.2012.04.003
|
| [94] |
MARTENS JH, BARG H, WARREN MJ, JAHN D. Microbial production of vitamin B12[J]. Applied Microbiology and Biotechnology, 2002, 58(3): 275-285. DOI:10.1007/s00253-001-0902-7
|
| [95] |
KIATPAPAN P, YAMASHITA M, KAWARAICHI N, YASUDA T, MUROOKA Y. Heterologous expression of a gene encoding cholesterol oxidase in probiotic strains of Lactobacillus plantarum and Propionibacterium freudenreichii under the control of native promoters[J]. Journal of Bioscience and Bioengineering, 2001, 92(5): 459-465. DOI:10.1016/S1389-1723(01)80296-6
|
| [96] |
KIATPAPAN P, HASHIMOTO Y, NAKAMURA H, PIAO YZ, ONO H, YAMASHITA M, MUROOKA Y. Characterization of pRGO1, a plasmid from Propionibacterium acidipropionici, and its use for development of a host-vector system in propionibacteria[J]. Applied and Environmental Microbiology, 2000, 66(11): 4688-4695. DOI:10.1128/AEM.66.11.4688-4695.2000
|
| [97] |
PIAO YZ, YAMASHITA M, KAWARAICHI N, ASEGAWA R, ONO H, MUROOKA Y. Production of vitamin B12 in genetically engineered Propionibacterium freudenreichii[J]. Journal of Bioscience and Bioengineering, 2004, 98(3): 167-173. DOI:10.1016/S1389-1723(04)00261-0
|
| [98] |
CAI YY, XIA MM, DONG HN, QIAN Y, ZHANG TC, ZHU BW, WU JC, ZHANG DW. Engineering a vitamin B12 high-throughput screening system by riboswitch sensor in Sinorhizobium meliloti[J]. BMC Biotechnology, 2018, 18(1): 27. DOI:10.1186/s12896-018-0441-2
|
| [99] |
MOORE SJ, MAYER MJ, BIEDENDIECK R, DEERY E, WARREN MJ. Towards a cell factory for vitamin B12 production in Bacillus megaterium: bypassing of the cobalamin riboswitch control elements[J]. New Biotechnology, 2014, 31(6): 553-561. DOI:10.1016/j.nbt.2014.03.003
|
| [100] |
FANG H, LI D, KANG J, JIANG PT, SUN JB, ZHANG DW. Metabolic engineering of Escherichia coli for de novo biosynthesis of vitamin B12[J]. Nature Communications, 2018, 9: 4917. DOI:10.1038/s41467-018-07412-6
|
| [101] |
2022年中国维生素C发展现状、市场竞争格局及发展趋势[EB/OL]. [2024-02-28]. https://www.163.com/dy/article/HR45JK710552SV13.html.
|
| [102] |
Reichstein T, Grussner A. Productive synthesis of L-ascorbic acid, vitamin C[J]. Helvetica Chimica Acta, 1934.
|
| [103] |
尹光琳, 陶增鑫, 于龙华, 王大耜, 谈家林, 严自正, 宁文珠, 王长会, 王书鼎, 姜慧凤, 张秀明, 冯晓云, 赵强, 魏文巧. L-山梨糖发酵产生维生素C前体: 2-酮基-L-古龙酸的研究Ⅰ. 菌种的分离筛选和鉴定[J]. 微生物学报, 1980, 20(3): 246-251. YIN GL, TAO ZX, YU LH, WANG DS, TAN JL, YAN ZZ, NING WZ, WANG CH, WANG SD, JIANG HF, ZHANG XM, FENG XY, ZHAO Q, WEI WQ. Studies on the production of vitamin C precursor 2-ketoyl-L-Gulonic acid from L-sorbate fermentation Ⅰ. Isolation, screening and identification of strains[J]. Acta Microbiologica Sinica, 1980, 20(3): 246-251 (in Chinese). |
| [104] |
满都拉, 杨伟超, 徐慧, 张忠泽. 维生素C二步发酵中伴生菌促进产酸菌产酸机制的研究[C]. 中国微生物学会学术年会, 2013. MAN DL, YANG WC, XU H, ZHANG ZZ, Study on the mechanism of promoting acid-producing bacteria by associated bacteria in the two-step fermentation of vitamin C[C]. Annual Conference of Chinese Society of Microbiology, 2013 (in Chinese). |
| [105] |
WANG CY, LI Y, GAO ZW, LIU LC, WU YC, ZHANG MY, ZHANG TY, ZHANG YX. Reconstruction and analysis of carbon metabolic pathway of Ketogulonicigenium vulgare SPU B805 by genome and transcriptome[J]. Scientific Reports, 2018, 8: 17838. DOI:10.1038/s41598-018-36038-3
|
| [106] |
WANG CY, LI Y, GAO ZW, LIU LC, ZHANG MY, ZHANG TY, WU CF, ZHANG YX. Establishing an innovative carbohydrate metabolic pathway for efficient production of 2-keto-L-gulonic acid in Ketogulonicigenium robustum initiated by intronic promoters[J]. Microbial Cell Factories, 2018, 17(1): 81. DOI:10.1186/s12934-018-0932-9
|
| [107] |
SUGISAWA T, MIYAZAKI T, HOSHINO T. Microbial production of L-ascorbic acid from D-sorbitol, L-sorbose, L-gulose, and L-sorbosone by Ketogulonicigenium vulgare DSM 4025[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(3): 659-662. DOI:10.1271/bbb.69.659
|
| [108] |
SAUER M, BRANDUARDI P, VALLI M, PORRO D. Production of L-ascorbic acid by metabolically engineered Saccharomyces cerevisiae and Zygosaccharomyces bailii[J]. Applied and Environmental Microbiology, 2004, 70(10): 6086-6091. DOI:10.1128/AEM.70.10.6086-6091.2004
|
| [109] |
ZENG WZ, WANG PP, LI N, LI JH, CHEN J, ZHOU JW. Production of 2-keto-L-gulonic acid by metabolically engineered Escherichia coli[J]. Bioresource Technology, 2020, 318: 124069. DOI:10.1016/j.biortech.2020.124069
|
| [110] |
LI D, DENG ZW, HOU XD, QIN ZJ, WANG XL, YIN DJ, CHEN Y, RAO YJ, CHEN J, ZHOU JW. Structural insight into the catalytic mechanisms of an L-sorbosone dehydrogenase[J]. Advanced Science, 2023, 10(30): e2301955. DOI:10.1002/advs.202301955
|
| [111] |
LI G, LI D, ZENG WZ, QIN ZJ, CHEN J, ZHOU JW. Efficient production of 2-keto-L-gulonic acid from D-glucose in Gluconobacter oxydans ATCC9937 by mining key enzyme and transporter[J]. Bioresource Technology, 2023, 384: 129316. DOI:10.1016/j.biortech.2023.129316
|
| [112] |
EL-SAMAD H. The next emergence of synthetic biology[J]. GEN Biotechnology, 2024, 3(1): 1-2. DOI:10.1089/genbio.2024.29134.editorial
|