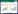中国科学院微生物研究所、中国微生物学会主办
文章信息
- 张博, 余浩楠, 朱丽丹, 朱溢, 柳志强, 郑裕国
- ZHANG Bo, YU Haonan, ZHU Lidan, ZHU Yi, LIU Zhiqiang, ZHENG Yuguo
- 脂溶性维生素的生物合成
- Biosynthesis of fat-soluble vitamins
- 生物工程学报, 2024, 40(8): 2552-2569
- Chinese Journal of Biotechnology, 2024, 40(8): 2552-2569
- 10.13345/j.cjb.240155
-
文章历史
- Received: February 28, 2024
- Accepted: May 9, 2024
- Published: May 11, 2024
2. 浙江工业大学 生物工程学院 浙江省生物有机合成技术研究重点实验室, 浙江 杭州 310014
2. Key Laboratory of Bioorganic Synthesis of Zhejiang Province, College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, Zhejiang, China
维生素(vitamin)是维持人和动物正常生理功能所必需的一种微量的有机化合物[1]。根据其溶解性,维生素分为水溶性维生素和脂溶性维生素两大类。脂溶性维生素有维生素A、维生素D、维生素E和维生素K,脂溶性维生素大都稳定性较高,易溶于有机溶剂而不溶于水,能被脂肪吸收并储存在体内(主要在肝脏)[2]。脂溶性维生素具有非常广阔的市场前景,目前维生素A以及维生素E在脂溶性维生素中占有约45%的市场。随着人们生活方式的改变,人们的健康意识逐步增强,维生素等营养品的补充也逐步渗透到了日常的生活中,全球市场对维生素的需求进一步扩大。工业上脂溶性维生素主要由化学法合成,当前新一轮科技革命正在进行,生物合成已成为科技革命中的热点赛道。随着合成生物技术的发展和生物技术手段的应用,微生物作为底盘细胞得以进行改造,从而开发出可定制的生物应用系统(图 1)。目前,多种工业产品已实现由化学合成向生物合成的产业升级,减轻了资源压力和环境压力,实现了真正的环境友好型发展,为我国绿色低碳发展、实现“碳达峰”和“碳中和”目标作出了贡献[3]。今年“新质生产力”首次被写入政府的工作报告,新质生产力是高质量发展的关键着力点,是高质量、高效能、环境友好的创新型科技,合成生物学作为新一轮科技革命的主力军,具有非常广阔的发展前景,其发展使得脂溶性维生素的生产不再局限于化学方法的生产。近年来利用微生物发酵生产维生素正在成为行业主流,这一技术有望开启维生素工业的新时代[4]。本文综述了近年来使用生物合成进行脂溶性维生素生产的实例,为实现维生素产业的绿色生产发展、进一步推进新一轮科技革命提供了参考。
|
| 图 1 脂溶性维生素与经典合成生物技术 Fig. 1 Fat-soluble vitamins and classical synthetic biotechnology. EMP: Embden-Meyerhof pathway; Glc: Glucose; G6P: Glucose-6-phosphate; F6P: Fructose-6-phosphate; GAP: 3-phosphate-glyceraldehyde; 3-PG: 3-phosphate-glycerate; PEP: Phosphate-enolpyruvate; PYR: Pyruvate; TCA: Tricarboxylic acid cycle; AcCoA: Acetyl-CoA; CIT: Citrate; ICTC: Isocitrate; α-KG: α-Ketoglutarate; SUC: Succinate; FUM: Fumarate; MAL: Malate; OAA: Oxaloacetate. |
| |
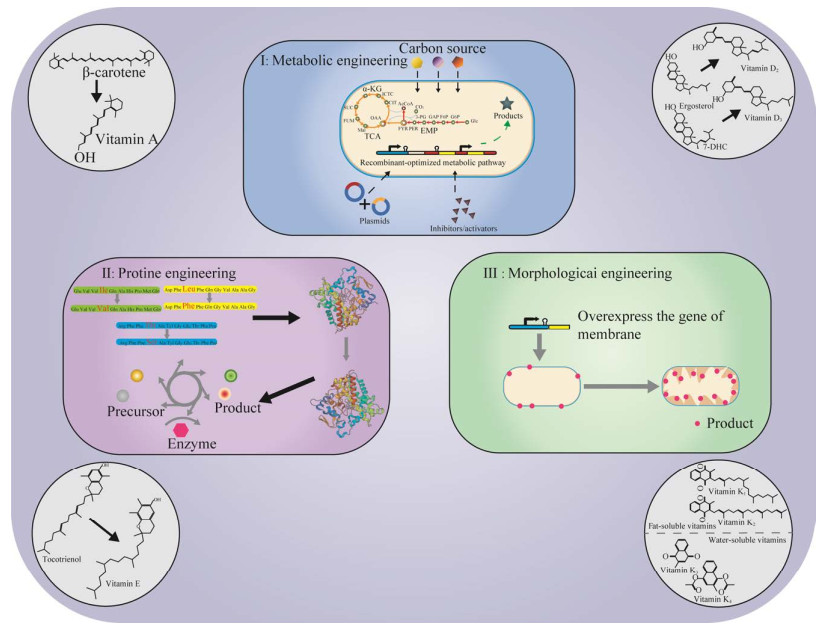
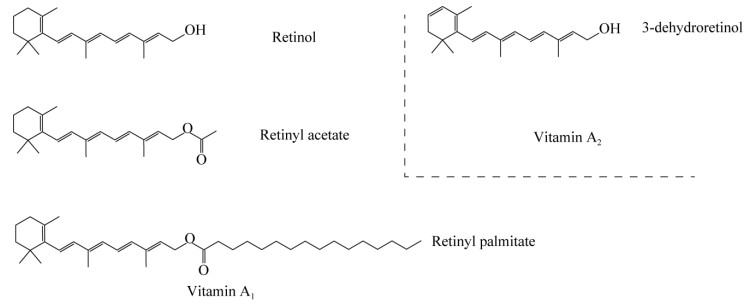
维生素A是一类具有视黄醇生物活性的化合物,主要应用于食品、饲料医药及美妆领域,包括VA1 (视黄醇、视黄醇醋酸乙酯、视黄醇棕榈酸酯)和VA2 (3-脱氢视黄醇)[5] (图 2)。其中VA2的生理活性是VA1的40%[6]。目前,维生素A的工业合成主要有罗氏公司(Roche)的(C14+C6)和巴斯夫股份公司(BASF)的(C15+C5)两条化学合成工艺路线[7]。Roche和BASF两条工艺路线均以β-紫罗兰酮为起始原料[8],Roche工艺经达参(Darzens)反应、格氏反应、选择加氢、羟基溴化和脱溴化氢,完成维生素A醋酸酯的合成[9];BASF工艺的典型特征则是维蒂希(Wittng)反应,以β-紫罗兰酮为起始原料和乙炔进行格氏反应生成乙炔-β-紫罗兰醇,选择加氢得到乙烯-β-紫罗兰醇,再经Wittng反应之后,以醇钠为催化剂,与C5醛缩合生成维生素A醋酸酯,相比较而言,Roche工艺技术成熟、收率稳定[10]。2022年,全球维生素A市场规模约83亿元,主要生产厂商有皇家帝斯曼公司DSM、BASF、浙江新和成股份有限公司(中国)、安迪苏集团Adisseo、浙江医药股份有限公司(中国)、金达威集团有限公司(中国)等[11]。其中排名前3的厂商约占市场份额的60%。亚洲是第一大市场,约占整个市场份额的45%,其次是欧洲,约占30%的市场份额。中国作为世界上最大的维生素A生产国之一,维生素A的产量占全球总产量的1/3以上,预计到2027年,维生素A的市场规模将达到50亿元人民币[12]。大肠杆菌和酵母菌凭借其遗传信息清晰、编辑操作简单、易培养等优势常优先用作合成生物的底盘。完整的维生素A合成途径存在于海洋透光层中的一组变形视紫红质细菌和古菌中[13],β-胡萝卜素15,15′-单加氧酶(β-carotene 15,15’-mono-ordioxygenase, BCMO)是β-胡萝卜素合成维生素A的关键酶。Jang等[14]通过筛选得到了来自海洋细菌的具有最高β-胡萝卜素裂解效率的BCMO,同时引入了异源的甲羟戊酸途径(mevalonate pathway, MVA) (图 3),使大肠杆菌可直接产生8.7 mg/L的维生素A;为了防止维生素A在细胞内被降解,该团队使用了十二烷两相培养系统,在5 mL培养物上,覆盖了5 mL的十二烷,经过72 h发酵后最终得到136 mg/L的维生素A。
|
| 图 2 维生素A分类 Fig. 2 Categories of vitamin A. |
| |
|
| 图 3 维生素A代谢路径图 Fig. 3 Metabolic pathways of vitamin A. MEP pathway: Methylerythritol-4-phosphate pathway; MVA pathway: Mevalonate pathway; mvaS: HMG-CoA synthase; mvaA: HMG-CoA reductase; crtE: GGPP synthase; crtB: Phytoene synthase; crtY: Lycopene cyclase; crtI: Phytoene desaturase; BCMO: β-carotene 15,15ʹ-mono-ordioxygenase; GAP: GTPase-activating protein; PEP: Phosphoenolpyruvate; DXP: 1-deoxy-D-xyluose-5-phosphate; MEP: 2-C-methyl-D-erythritol-4-phosphate; CDP-ME: 4-diphosphocytidyl-2-methyl-D-erythritol synthase; ME-cPP: 2-C-methyl-D-erythritol 2,4-cyclodiphosphate; HMBPP: 4-hydroxy-3-methyl-but-2-enyl diphosphate; DMAPP: Dimethylallyl diphosphate; IPP: Isopentenyl diphosphate; FPP: Farnesyl diphosphate; GGPP: Geranylgeranyl diphosphate. |
| |
Sun等[15]也通过引入的维生素A合成途径中的β-胡萝卜素15,15′-单加氧酶(BCMO),实现了在酿酒酵母中直接生产维生素A,通过补料分批发酵得到了3 350 mg/L的维生素A。
维生素A的直接前体是天然的类胡萝卜素[16],也被称为“维生素A原”[17],β-胡萝卜素作为最主要的“维生素A原”,其产量直接影响维生素A的产量[18]。很多植物和藻类可以天然合成β-胡萝卜素[19]。除了植物和藻类,一些微生物也可以合成β-胡萝卜素,包括真菌和细菌[20]。在真菌中,丝状真菌(如三孢布拉霉)以及酵母(如法夫酵母和球拟酵母)常用于发酵生产β-胡萝卜素[21-22]。在细菌中,噬夏欧文氏菌和成团泛菌是β-胡萝卜素的主要生产者。这些野生菌株具有生长周期短、代谢快、合成效率高等优点,但由于发酵不稳定、产量低,目前并未实现工业化生产。随着代谢工程、合成生物学以及相关学科的发展和应用,类胡萝卜素也可以在非类胡萝卜素生产菌株(大肠杆菌和酵母菌等)中进行异源合成[23]。Li等[24]通过优化大肠杆菌磷酸甲基赤藓糖醇途径和中心代谢途径,使β-胡萝卜素的产量浓度在补料分批发酵器中达到2.0 g/L;后续Wu等[25]又改善了代谢途径中NADPH的供应,使得β-胡萝卜素的产量浓度在摇瓶培养中达到266.4 mg/L,在5 L生物反应器中达到2 579.1 mg/L。除了常规的代谢改造策略,Wu等[26]在膜形态和膜合成途径方面对大肠杆菌进行了工程改造,通过过表达膜弯曲蛋白来工程化膜的形态,同时设计膜合成途径,使得细胞膜向内形成膜堆,在这两种策略的协同作用下,β-胡萝卜素的产量浓度可以达到268.1 mg/L;Lee等[27]通过构建一种视紫红质融合蛋白使大肠杆菌成为一种光动力菌株并提高了β-胡萝卜素的产量。另外,在真菌中也可以进行β-胡萝卜素的生产,在解脂耶氏酵母中,Ma等[28]消除了番茄红素底物的抑制作用,通过发酵可以获得39.5 g/L的β-胡萝卜素。Nanou等[29]通过提高超氧化物歧化酶和过氧化氢酶的比活提高了胡萝卜素的产量,同时,他们还使用餐厨废油作为发酵碳源使胡萝卜素的产量达到(2 021±75) mg/L。
2 维生素D维生素D是环戊烷多氢菲类化合物的总称,属于固醇类衍生物[30],具有治疗佝偻病、调节细胞的生长分化以及增强免疫力的功能[31],主要包括VD2 (麦角钙化醇)和VD3 (胆钙化醇)[32]。VD2由植物体内的麦角固醇经紫外线照射后生成,VD3则是存在于动物体组织及鱼肝油中[33],人类及大多数高等动物在皮肤组织中都含有7-脱氢胆固醇(7-dehydrocholesterol, 7-DHC),在阳光或紫外光照射下经光化学反应可转化成VD3[34-35]。现阶段工业生产VD3的工艺方法主要为使用天然的7-DHC为原料的半合成法:以7-DHC为原料,通过溴化法制备中间体——VD3原,最后通过光化开环反应构建VD3[36]。全球和中国维生素D市场规模在2022年分别达到166.54亿元和54.71亿元,生产出的维生素D主要应用于保健品、医药和饲料等领域,其中保健品市场占据较大份额。维生素D行业内主要厂商包括浙江新和成股份有限公司、LycoRed、Fermenta BiotechLimited、辉瑞公司Pfizer、BASF、Roche。随着国民健康意识的逐渐加强,维生素D的市场规模也在逐渐扩大,据维生素D行业市场规模分析预测,2022−2028年维生素D市场规模将从184.66亿元增长至334.66亿元,复合年均增长率(compound annual growth rate, CAGR)约为10.58%[37]。
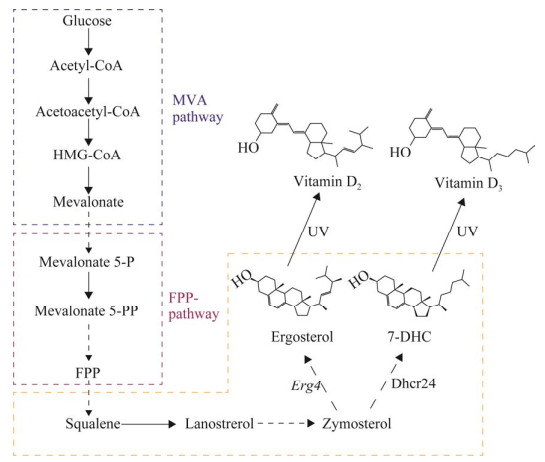
目前,维生素D生物合成的主要方法就是生物发酵法合成其前体物质7-DHC,发酵所用菌种主要为酵母,7-DHC是其细胞膜的主要组成成分[38]。
在酿酒酵母细胞中,7-DHC的合成主要发生在3个区域:(1)在线粒体中生成甲羟戊酸;(2)在液泡中生成关键中间体法尼基焦磷酸(farnesyl diphosphate, FPP);(3)在内质网中生成7-DHC (图 4)。Guo等[39]调整后角鲨烯酶的亚细胞定位,消除代谢瓶颈以促进7-DHC的产生,同时在内质网上重新定位了DHCR24 (7-DHC生物合成的唯一异源蛋白),并定位靶向脂质体上的ERG蛋白,以提高中间体的转化效率,最后使得7-DHC在摇瓶里的产量达到360.6 mg/L。Tan等[40]发现溶氧指标可作为酵母补料分批发酵麦角固醇的有效控制参数,并对其进行了优化;当溶解氧控制在12%左右,并同时采用脉冲补料法时,麦角固醇总产量可达到1 160 mg/L。Xiu等[41]通过激活和抑制酿酒酵母中CRISPER介导的转录调控系统,同时将ERG7、ERG20、IDI1、MVD1、ERG8、ERG12这6个基因与内质网靶向信号肽(CEN1)进行融合,并过表达INO2基因以扩大内质网内腔,最终在摇瓶中7-DHC的产量达到了455.6 mg/L,在5 L反应容器中达到了2 870 mg/L,这也是迄今为止报道的最高的7-DHC产量。
|
| 图 4 维生素D代谢路径图 Fig. 4 Metabolic pathways of vitamin D. Erg4: C-24(28) sterol reductase; Dhcr24: C-24 reductase, the only heterologous protein for 7-DHC biosynthesis; MVA pathway: Mevalonate pathway; FPP: Farnesyl diphosphate; 7-DHC: 7-dehydrocholesterol; UV: Ultraviolet. |
| |
VD3需要在体内(主要是肝脏以及肾脏)经P450羟化酶的羟化反应才能生成具有活性的VD3并发挥生理作用(图 5)[42],因此,挖掘并改造P450羟化酶实现VD3高效羟基化反应是实现活性VD3大规模产业化的关键。Fujii等[43]从自养假诺卡氏菌(Pseudonocardia autotrophica NBRC 12743)中分离出P450单加氧酶CYP107 (Vdh),该酶能够对VD3进行1位与25位羟化,其团队对该酶进行了异源表达与定向进化,得到了比野生酶活性高约20倍的突变体酶Vdh-K1,具有一定的工业化潜力。随着计算机在生物工程方面的应用,酶可以通过软件进行设计,并进行人工诱变来进一步提高酶的催化活性。Abdulmughni等[44]对底物VD3和蛋白酶之间进行了对接分析,确定了底物的特点及酶的相对应重要活性位点的氨基酸残基,并采用定点诱变技术获得突变体185 A,最终实现了对VD3的25位羟基化的高选择性,与野生型相比,突变体的产量提高了2倍。

|
| 图 5 P450催化维生素D3羟基化的路径 Fig. 5 Catalytic pathways for vitamin D3 hydroxylation by P450. |
| |
维生素E是生育酚类物质的总称,天然存在的维生素E有α、β、γ和δ这4种类型的生育酚或生育三烯酚,一共8种类似物(图 6),其中α-生育酚含量最高,生理活性也最高[45-46]。天然的维生素E广泛存在于植物的绿色部分以及禾本科种子的胚芽里[47],尤其在植物油中含量丰富,其中植物油脂精炼的副产品油脂脱臭馏出物中维生素E的含量最多[48],是目前提取天然维生素E的主要来源。国外天然维生素E提取工艺较为成熟,主要包括:皂化-萃取法、酯化-超临界萃取法、水解-蒸馏法、酯化(酯交换)-蒸馏法等。国内天然维生素E的提取方法主要是将脱臭馏出物中的脂肪酸用低级醇进行酯化,然后进行中和、冷却结晶来获得较高含量的天然维生素E浓缩物[49]。化学合成维生素E通常采用2,3,5-三甲基氢醌(2,3,5-trimethylhydroquinone, TMHQ)与异植物醇(isophytol, IP)为原料,再通过烷基化-缩合反应得到。全球维生素E的年产量约为8万t,其中四大厂商控制着全球维生素E供给的80%以上,分别是国外的荷兰皇家帝斯曼公司、德国巴斯夫公司、国内的浙江新和成股份有限公司、浙江医药股份有限公司,目前维生素E全球需求量约为6−8万t,主要应用于饲料、医药美妆及食品饮料等行业,其中饲料行业用量最大,占比达到67%,后两者的占比分别为28%和5%[50]。

|
| 图 6 维生素E分类 Fig. 6 Categories of vitamin E. |
| |
微生物是天然生育酚的最佳来源。Albermann等[51]通过在大肠杆菌中过表达羟基苯丙酮酸双加氧(4-hydroxyphenylpyruvate dioxygenase, Hpd)、香叶酰焦磷酸合酶(geranylgeranyl pyrophosphate synthase, CrtE)、香叶酰焦磷酸还原酶(geranylgeranyl pyrophosphate reductase, Ggh)、生育酚环化酶(tocopherol-cyclase, Cyc)等,使生育三烯醇的产量达到15 μg/g。
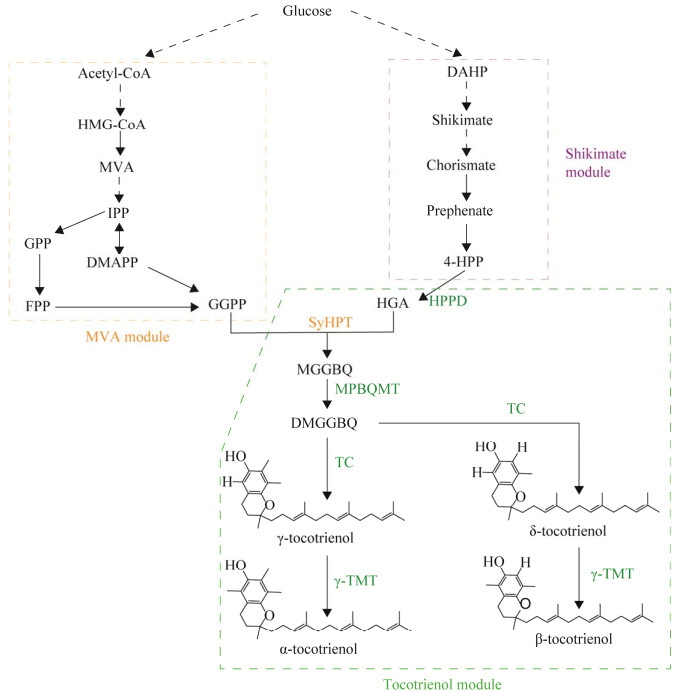
Shen等[52]将来自拟南芥的4-羟基苯丙酮酸双加氧酶(4-hydroxyphenylpyruvate dioxygenase, HPPD)、尿黑酸香叶基香叶基转移酶(homogentisate geranylgeranyl transferase, HGGT)、2-甲基-6-叶绿基-1,4-苯醌甲基转移酶(2-methyl-6-phytyl-1,4-benzo-quinol methyltransferase, MPBQMT)、生育酚环化酶(tocopherol cyclase, TC)、生育酚甲基转移酶(γ-tocopherol methyltransferase, γ-TMT)和来自蓝细菌集胞藻PCC 6803的尿黑酸叶基转移酶(homogentisate phytyltransferase, HPT)与内源莽草酸途径和甲羟戊酸途径相结合(图 7),通过构建温敏型菌株,进行两阶段变温发酵,在葡萄糖耗尽后温度从30 ℃降至24 ℃进入冷休克阶段,从而启动由温敏PACT1启动子驱动的目标合成路径,经过24 ℃、5 h的冷休克发酵,减轻了代谢负担,成功实现生育三烯酚在工程菌株细胞中生物量积累和目标产物积累的分阶段控制,最终在5 L发酵罐中使总生育三烯酚产量达到320 mg/L,为实现天然维生素E的全发酵法生产奠定了基础。目前研究较多的底盘细胞来自酿酒酵母和解耶氏酵母[53]。Jiao等[54]通过提高MVA途径通量,加强双香叶基焦磷酸(geranyl geranyl pyrophosphate, GGPP)和NADPH的供应,同时筛选负责解毒的多效应药物抗性(pandrug-resistant bacteria, PDR)内源性转运蛋白,使生育三烯酚在酿酒酵母中能够分泌生产,并在摇瓶培养中使生育三烯酚产量达到82.68 mg/L。近期,其团队还通过途径模块化和优化生育三烯酚的转运工程显著提高摇瓶中δ-生育三烯酚的产量至241.7 mg/L[55]。同时,Han等[56]通过优化高龙胆酸(homogentisic acid, HGA)合成生育三烯酚的限速步骤,采用添加50% (体积比)十二烷的两相萃取发酵法使生育三烯酚的产量达到3 262.2 μg/L。
|
| 图 7 维生素E代谢路径图 Fig. 7 Metabolic pathways of vitamin E. HMG-CoA: 3-hydroxy-3-methylglutaryl-CoA; MVA: Mevalonic acid; IPP: Isopentenyl diphosphate; DMAPP: Dimethylallyl diphosphate; GPP: Geranyl diphosphate; FPP: Farnesyl diphosphate; DAHP: 3-deoxy-arabino-heptulonate 7-phosphate; 4-HPP: 4-hydroxyphenylpyruvate; HGA: Homogentisic acid; GGPP: Geranyl geranyl pyrophosphate; MGGBQ: 2-methyl-6-geranylgeranyl benzoquinol; DMGGBQ: 2,3-dimethyl-5-geranylgeranyl-benzoquinone; HPPD: 4-hydroxyphenylpyruvate dioxygenase; SyHPT: Homogentisate phytyltransferase; MPBQMT: 2-methyl-6-phytylbenzoquinol-methyltransferase; TC: Tocopherol cyclase; γ-TMT: γ-tocopherol methyltransferase. |
| |
维生素K,又名凝血维生素,是一类具有叶绿醌生物活性物质的总称[57],包括VK1、VK2、VK3、VK4这4种形式(图 8)。VK1在植物中广泛存在,VK2则主要由微生物等合成,它们是天然存在的脂溶性维生素;而VK3、VK4是通过人工合成的水溶性的维生素[58]。VK2具有保护心血管健康和促进骨骼恢复的作用,同时还可以预防骨质疏松和动脉粥样硬化[59-60],根据其异戊二烯侧链的长度可以分为不同类型的甲萘醌(menaquinone-n, MK-n)[61],其中MK-4可通过人工合成获得,主要方法是通过逆狄尔斯-阿尔德(DielsAlder)反应将甲萘醌-环戊二烯加合生成MK-4[62]。当前,全球VK2的需求量每年增长幅度都在10%左右,预计到2026年,VK2在全球的市场规模将达到400.8万美元[63]。全球的制造商主要有皇家帝斯曼DSM (荷兰)、丹尼克斯集团(丹麦)、花臣集团Frutarom (以色列)、协和麒麟株式会社Kyowa Kirin (日本)、Natto Pharma (挪威)、Viridis BioPharma (挪威)、西宝生物科技股份有限公司(中国)、双骏生物科技有限公司(中国)、Gnosis S.P.A (意大利)、Kappa Bioscience AS (挪威)等[64]。

|
| 图 8 维生素K分类 Fig. 8 Categories of vitamin K. |
| |
VK1通常由可进行光合作用的植物及藻类产生[65],VK2则是由细菌合成,是呼吸链必需电子的传递载体,各种微生物细胞都能产生VK2[66]。不同的菌株可以产生不同类型的VK2。因此,甲萘醌的类型也被用作细菌分类的基础。枯草芽孢杆菌能够产生从MK-4到MK-8的MK同系物,而黄杆菌主要产生MK-4和MK-6。一些肠道微生物,特别是乳酸菌,如乳球菌、乳酸杆菌、肠球菌、明串珠菌和链球菌,也被发现能够产生更广泛的MK-n,包括MK-7、MK-8、MK-9和MK-10[67]。其中MK-7被认为是维生素K2中活性最强的类型[68]。芽孢杆菌是VK2的主要生产菌株和最有改造前景的潜在菌株,因为它们具有高安全性和高含量的MK-7[69]。枯草芽孢杆菌作为一种通常被认为是安全(generally recognized as safe, GRAS)的菌种常被用于微生物的发酵生产,芽孢杆菌中甲萘醌的生物合成途径分为3种途径:甲基赤藓糖醇磷酸(methylerythritol-4-phosphate pathway, MEP)途径、莽草酸(shikimate pathway, SA)途径和甲萘醌途径[70]。Berenjian等[71]通过对野生型枯草芽孢杆菌纳豆菌株培养基组成和发酵条件进行优化,将VK2在3 L发酵罐中的产量提高至226 mg/L。Cui等[72-73]开发了一个基于Phr60-Rap60-Spo0A的双功能群体感应(quorum sensing, QS)系统,动态平衡目标产物的合成与细胞生长之间的关系,动态控制枯草芽孢杆菌中VK2的合成,使VK2的产量提高了40倍,在摇瓶中的产量从9 mg/L提升至360 mg/L,在15 L生物反应器中可达到200 mg/L;之后他们通过比较转录组学,发现生物膜的形成和电子传递是促进VK2合成的重要因素;通过过表达信号转导蛋白TatAD-CD和甲基酚细胞色素折叠酶QcrA-C,经过发酵后在15 L生物反应容器中VK2的产量提高到了310 mg/L。
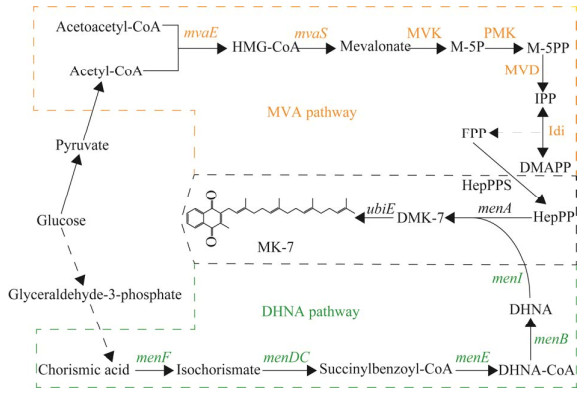
Gao等[74]在大肠杆菌中把VK2生物合成途径分为3个模块,即MVA途径、1,4-二羟基-2-萘甲酸甲酯(1,4-dihydroxy-2-naphthoate pathway, DHNA)途径和MK-7途径(图 9),并对其进行了系统优化,通过组合代谢工程和膜工程,在摇瓶实验中获得了129 mg/L的VK2,与起始菌株相比增加了306倍;在放大发酵中,发酵52 h后获得1 350 mg/L的VK2,产率为26 mg/(L·h),这是截至目前报道的最高产量。
|
| 图 9 维生素K2代谢路径图 Fig. 9 Metabolic pathways of vitamin K2. The whole MK-7 biosynthetic pathway was divided into three modules (MVA pathway, DHNA pathway and MK-7 pathway). mvaE: HMG-CoA synthase; mvaS: HMG-CoA reductase; MVK: Mevalonate kinase; PMK: Phosphomevalonate kinase; MVD: Mevalonate pyrophosphate decarboxylase; Idi: IPP isomerase; HepPPS: Heptaprenyl pyrophosphate synthetase; menA: 1,4-dihydroxy-2-naphthoate prenyltransferase; menB: 1,4-dihydroxy-2-naphthoyl-CoA synthase; menC: o-succinylbenzoate synthase; menD: 2-succinyl-5-enolpyruvyl-6-hydroxy-3-cyclohexene-1-carboxylate synthase; menE: o-succinylbenzoate-CoA ligase; menF: Isochorismate synthase; menI: 1,4-dihydroxy-2-naphthoyl-CoA thioesterase; ubiE: Ubiq-uinone/menaquinone biosynthesis methyltransferase; HMG-CoA: 3-hydroxy-3-methyl-glutaryl-coenzyme A; M-5P: Phosphomevalonate; M-5PP: Diphosphomevalonate; IPP: Isopentenyl pyrophosphate; DMAPP: Dimethylallyl pyrophosphate; HepPP: Heptaprenyl diphosphate; FPP: Farnesyl pyrophosphate; DHNA: 1,4-dihydroxy-2-naphthoate; DHNA-CoA: 1,4-dihydroxy-2-naphthoyl-coenzyme A. |
| |
脂溶性维生素已成为当下人们生活必不可少的产品,在食品、医疗、美妆以及畜牧等行业中广泛应用。科学家们通过合成生物学技术进行微生物发酵法生产脂溶性维生素(表 1),是实现低碳、节能、减排以及我国“碳达峰”和“碳中和”的重要技术手段。但是,脂溶性维生素的生物合成技术在实际生产过程中依然存在着许多共性问题:首先,对多种底盘生物的认知还有局限,经过长期自然选择的进化,微生物已经生成了一套平衡协调的调控系统,对其自身系统的编辑犹如“黑客入侵”[75],虽然已经部分实现了“成功入侵”,但是大部分的基因编辑依然受制于自然选择后菌种对自身的保护。其次,一个基因在不同的生物体内或在不同的环境下的功能是不同的,将已有的各种基因以及基因元件组合,很多时候并不会按目的设计进行表达或发挥功能。对于合成线路的理性设计也是研究过程中的一大挑战,新的代谢路径的引入以及边路代谢途径的敲除都会一定程度影响细胞自身的生长发育,如何解决目的代谢路径与自身代谢路径的资源平衡,仍需更深入地研究。
| Vitamin | Species | Method | Main culture substances | Yield | References |
| VA | Saccharomyces cerevisiae | Introducing a β-carotene biosynthetic pathway, and a gene coding for β-carotene 15,15′-dioxygenase (BCMO) into a xylose-fermenting S. cerevisiae | The modified Verduyn medium (xylose replaces glucose as a carbon source) | 3 350 mg/L | [15] |
| Escherichia coli | Strain ZF43ΔgdhA knocking out zwf gene, ptsHIcrr operon, yjgB gene and overexpressing nadK gene BL21(DE3): pET32a-gr-gfr |
LB | 2 579.1 mg/L | [25] | |
| E. coli Yarrowia lipolytica |
Using structure-oriented protein design, combined with phylogenetic information, the generation of reduced inhibition of protein variants; reducing the carbon flow through the carotenoid pathway and thus preventing inhibitory metabolite accumulation to inhibitory levels | LB YPD media |
Abs458/OD600=0.29 39.5 g/L |
[27] [28] |
|
| VD | S. cerevisiae | Rearranging the subcellular location of post-squalene enzymes; all the ER-located enzymes are grouping into four modules: ERG1/11/24, ERG25/26/27, ERG2/3 and DHCR24 and are individually overexpressing on ER or in LDs | YPD media | 360.6 mg/L | [39] |
| S. cerevisiae | Overexpressing tHMG1, IDI1, ERG1, ERG11, ADH2, ERG7 genes and a transcription factor mutant UPC2G888A, and overexpressing INO2 | Solid synthetic dropout(SSD) medium | 2 870 mg/L | [41] | |
| VE | Y. lipolytica | Optimizing the promoter of OptFSLERG20, Sc-tHMG1 and IDI; overexpressing Yl-HMGR and ERG19 genes | YPD medium | 34 mg/g DCW | [53] |
| S. cerevisiae | Enhancing the MVA pathway flux, strengthening supply of GGPP and NADPH and overexpressing the endogenous transporters | Synthetic dropout(SD), and YPD media | 82.68 mg/L | [54] | |
| S. cerevisiae | Modular engineering strategies to reconstruct and optimize a de novo δ-tocotrienol biosynthesis pathway | SD and YPD media | 3 262.2 μg/L | [56] | |
| VK | Bacillus subtilis | Optimizing the medium, fermentation condition, stirrer speed and aeration rate | Consisting of 5% (W/V) yeast extract, 18.9% (W/V) soy peptone, 5% (W/V) glycerol, and 0.06% K2HPO4 | 226 mg/L | [70] |
| B. subtilis | (1) Developing a bifunctional and modular Phr60-Rap60-Spo0A QS system and constructing a library of promoters with different capacities to implement down-regulation and upregulation by changing the location, number, and sequences of the binding sites for Spo0A-P | LB | 200 mg/L | [71] | |
| (2) Knocking out the biofilm-forming genes epsA-C, tasA, sinI, yuaB and ftsH and overexpressing the cell membrane protein tatAD-CD and menaquinol-cytochrome C reductase qcrA-C | LB | 310 mg/L | [72] | ||
| E. coli | Screening and enhancing Idi, overexpressing the endogenous MenA and exogenous UbiE, and fine-tuning the expression of HepPPS, MenA, and UbiE expression and enhancing DNA synthesis pathway | LB | 1 350 mg/L, 26 mg/(L·h) | [73] |
目前已经成功建立了维生素A细胞工厂并实现了规模化的生产工艺,但是由于自身细胞生长对维生素的需求,还不能实现高产。大部分研究是关于其主要前体β-胡萝卜素合成的,但是β-胡萝卜素作为合成维生素A的中间体,后期的合成工艺复杂,若想实现生物合成法向化学合成法的产业升级,还需要解决目前细胞产量低、无法实现工业化等问题。维生素D的工业生产在我国相对来说更加稳定,主要是化学合成有活性的25-羟基VD3和1α,25-二羟基VD3,但目前最大的工艺瓶颈就是对原料纯度的需求,其要求必须是纯度大于95% (NF级别)的胆固醇[76]。因此,对其原料生产菌进行改良和发酵模式进行优化,使其进一步高产是解决原料问题的一大关键,若想实现VD3在微生物细胞内的从头合成途径,其关键在于能否准确地人工合成或者鉴定出特定的酶来实现光化学合成[77]。维生素E的化学法提取以及合成工艺技术的优化,不仅降低了技术成本,还提高了产率。虽然目前在细胞内已经构建了完整的维生素E从头合成路径,但是生物法仍存在产量低、无法实现产业化等问题,可能的原因包括以下几点:(1) HPT和TC这两个限速酶的催化活性低;(2) 目前已有的异源途径与天然途径的兼容性差;(3) 难以实现高效率的外排。植物是目前生物合成维生素E的主要来源,但有研究表明光合微生物有相当大潜力生产生育酚[78],所以利用光合微生物合成维生素E是未来可行的研究方向。纳豆菌是生产维生素K最有前景的微生物之一。许多研究者通过改良代谢通路、优化发酵条件、调整发酵模式等方式来增加维生素K的产量[79],但最后还是难以达到工业化且高利产出的水平,需要进一步研究以攻克难题。
合成生物技术发展至今,已经有诸多适配的先进技术,例如:CRISPR/Cas9基因组编辑技术、单碱基编辑技术、生物法与化学法耦合等,可以去设计效率更高的代谢通路;通过高通量筛选育种、蛋白工程改造、生物反应器、自动化基因组装、人工细胞工厂等技术构建新的高产菌株。同时,为进一步实现我国的“双碳”目标,低碳生物合成也将成为研究重点。在研究过程中以合成生物学、代谢工程等学科为理性指导,通过生物元件的挖掘与设计、基因元件和代谢模块的组装与集成、合成和发酵系统的优化与适配实现了目标产物的高产,真正实现了环境友好型的产业发展。科学理性地预测设计和编程生物合成的软件开发,实现高效率的生物合成,是合成生物学发展中的难题,也是新兴的机遇与挑战[80]。如今世界正处于第四次工业革命的窗口期,生物技术作为“新质生产力”的主力军之一,在未来的发展中必将实现产业的成功转型,在国际竞争中作产业革命的先锋者,实现真正的科技强国。未来研究人员需要进行多学科、多领域结合,取其精华、去其糟粕,开发新的技术策略,优化传统技术模式,新旧结合,从而推动科学技术的进步,让科技创新为产业赋能。
| [1] |
路则宝. 脂溶性维生素研究进展[J]. 特别健康, 2017(19): 295. |
| [2] |
韩超. 运动与维生素[J]. 福建质量管理, 2018(13): 208. HAN C. Exercise and vitamins[J]. Fujian Quality Management, 2018(13): 208 (in Chinese). DOI:10.3969/j.issn.1673-9604.2018.13.169 |
| [3] |
王钦宏, 张以恒, 田朝光, 孙周通, 马延和. 低碳生物合成: 机遇与挑战[J]. 科学通报, 2023, 68(19): 2427-2434. WANG QH, ZHANG YH, TIAN CG, SUN ZT, MA YH. Low-carbon biosynthesis: opportunities and challenges[J]. Chinese Science Bulletin, 2023, 68(19): 2427-2434 (in Chinese). |
| [4] |
曾艳, 赵心刚, 周桔. 合成生物学工业应用的现状和展望[J]. 中国科学院院刊, 2018, 33(11): 1211-1217. ZENG Y, ZHAO XG, ZHOU J. Current situations and perspectives of industrial applications of synthetic biology[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(11): 1211-1217 (in Chinese). |
| [5] |
BORGAN SM, KHAN LZ, MAKIN V. Hypercalcemia and vitamin A: a vitamin to keep in mind[J]. Cleveland Clinic Journal of Medicine, 2022, 89(2): 99-105. DOI:10.3949/ccjm.89a.21056
|
| [6] |
汪之顼, 荫士安. β-胡萝卜素转化为维生素A的机制、调节和生物学意义[J]. 国外医学(卫生学分册), 2003(5): 283-287. WANG ZX, YIN SA. Mechanism, regulation and biological significance of β-carotene transforming into vitamin A[J]. Journal of Environmental Hygiene, 2003(5): 283-287 (in Chinese). |
| [7] |
PARKER GL, SMITH LK, BAXENDALE IR. Development of the industrial synthesis of vitamin A[J]. Tetrahedron, 2016, 72(13): 1645-1652. DOI:10.1016/j.tet.2016.02.029
|
| [8] |
肖繁花, 程婷婷, 陈超, 吴范宏. 乙烯基-β-紫罗兰醇的合成[J]. 上海应用技术学院学报(自然科学版), 2013, 13(3): 186-188, 200. XIAO FH, CHENG TT, CHEN C, WU FH. Synthesis of vinyl-β-ionol[J]. Journal of Shanghai Institute of Technology (Natural Science), 2013, 13(3): 186-188, 200 (in Chinese). DOI:10.3969/j.issn.1671-7333.2013.03.004 |
| [9] |
吕国锋, 高建荣, 黄国东, 李小军, 刘井平, 贾建洪. 合成维生素A醋酸酯新工艺的研究[J]. 浙江工业大学学报, 2006, 34(6): 614-616. LV GF, GAO JR, HUANG GD, LI XJ, LIU JP, JIA JH. Study on a new process for preparation of vitamine A acetate[J]. Journal of Zhejiang University of Technology, 2006, 34(6): 614-616 (in Chinese). DOI:10.3969/j.issn.1006-4303.2006.06.007 |
| [10] |
彭玉琳, 唐波. 合成维生素A醋酸酯新工艺的研究[J]. 建筑工程技术与设计, 2018(23): 5619. |
| [11] |
杨晓晶. 我国成为世界维生素生产中心[N]. 中国食品报, 2022-10-31.
|
| [12] |
2023年维生素A行业现状分析: 全球维生素A市场规模约83亿元[EB/OL]. [2024-02-28]https://www.chinabgao.com/info/1247487.html.
|
| [13] |
SABEHI G, LOY A, JUNG KH, PARTHA R, SPUDICH JL, ISAACSON T, HIRSCHBERG J, WAGNER M, BÉJÀ O. New insights into metabolic properties of marine bacteria encoding proteorhodopsins[J]. PLoS Biology, 2005, 3(8): e273. DOI:10.1371/journal.pbio.0030273
|
| [14] |
JANG HJ, YOON SH, RYU HK, KIM JH, WANG CL, KIM JY, OH DK, KIM SW. Retinoid production using metabolically engineered Escherichia coli with a two-phase culture system[J]. Microbial Cell Factories, 2011, 10(1): 59. DOI:10.1186/1475-2859-10-59
|
| [15] |
SUN L, KWAK S, JIN YS. Vitamin A production by engineered Saccharomyces cerevisiae from xylose via two-phase in situ extraction[J]. ACS Synthetic Biology, 2019, 8(9): 2131-2140. DOI:10.1021/acssynbio.9b00217
|
| [16] |
CHAPMAN MS. Vitamin a: history, current uses, and controversies[J]. Seminars in Cutaneous Medicine and Surgery, 2012, 31(1): 11-16. DOI:10.1016/j.sder.2011.11.009
|
| [17] |
KIM YS, OH DK. Biotransformation of carotenoids to retinal by carotenoid 15,15′-oxygenase[J]. Applied Microbiology and Biotechnology, 2010, 88(4): 807-816. DOI:10.1007/s00253-010-2823-9
|
| [18] |
王欣慧, 王颖, 姚明东, 肖文海. 维生素A生物合成的研究进展[J]. 化工学报, 2022, 73(10): 4311-4323. WANG XH, WANG Y, YAO MD, XIAO WH. Research progress of vitamin A biosynthesis[J]. CIESC Journal, 2022, 73(10): 4311-4323 (in Chinese). |
| [19] |
王兰明, 赵俊杰. 维生素A的化学合成[J]. 国外医药合成药生化药制剂分册, 1991, 12(3): 156-161. WANG LM, ZHAO JJ. Chemical synthesis of vitamin A[J]. World Clinical Drug, 1991, 12(3): 156-161 (in Chinese). |
| [20] |
SINGH RV, SAMBYAL K. An overview of β-carotene production: current status and future prospects[J]. Food Bioscience, 2022, 47: 101717. DOI:10.1016/j.fbio.2022.101717
|
| [21] |
LUTHRA U, BABU P, REMYA RR, JULIUS A, PATEL Y, JAJULA VEERA R, MAJEED I. Medium optimization and downstream process design for the augmented yield of β-carotene using fungi Blakeslea trispora[J]. Pigment & Resin Technology, 2022, 51(6): 574-580.
|
| [22] |
MUSSAGY CU, FARIAS FO, SANTOS-EBINUMA VC, PEREIRA JFB, PESSOA A Jr. Sustainable one-pot platform for the green recovery of carotenoids from Phaffia rhodozyma yeast and their use as natural additives in soap formulation[J]. Environmental Technology & Innovation, 2023, 29: 103029.
|
| [23] |
WANG L, LIU Z, JIANG H, MAO XZ. Biotechnology advances in β-carotene production by microorganisms[J]. Trends in Food Science & Technology, 2021, 111: 322-332.
|
| [24] |
LI YF, LIN ZQ, HUANG C, ZHANG Y, WANG ZW, TANG YJ, CHEN T, ZHAO XM. Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J]. Metabolic Engineering, 2015, 31: 13-21. DOI:10.1016/j.ymben.2015.06.006
|
| [25] |
WU YQ, YAN PP, LI Y, LIU XW, WANG ZW, CHEN T, ZHAO XM. Enhancing β-carotene production in Escherichia coli by perturbing central carbon metabolism and improving the NADPH supply[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8: 585. DOI:10.3389/fbioe.2020.00585
|
| [26] |
WU T, YE LJ, ZHAO DD, LI SW, LI QY, ZHANG BL, BI CH, ZHANG XL. Membrane engineering-a novel strategy to enhance the production and accumulation of β-carotene in Escherichia coli[J]. Metabolic Engineering, 2017, 43: 85-91. DOI:10.1016/j.ymben.2017.07.001
|
| [27] |
LEE CY, CHEN KW, CHIANG CL, KAO HY, YU HC, LEE HC, CHEN WL. Improved production of β-carotene in light-powered Escherichia coli by co-expression of Gloeobacter rhodopsin expression[J]. Microbial Cell Factories, 2023, 22(1): 207. DOI:10.1186/s12934-023-02212-0
|
| [28] |
MA YS, LIU N, GREISEN P, LI JB, QIAO KJ, HUANG SW, STEPHANOPOULOS G. Removal of lycopene substrate inhibition enables high carotenoid productivity in Yarrowia lipolytica[J]. Nature Communications, 2022, 13: 572. DOI:10.1038/s41467-022-28277-w
|
| [29] |
NANOU K, ROUKAS T, PAPADAKIS E, KOTZEKIDOU P. Carotene production from waste cooking oil by Blakeslea trispora in a bubble column reactor: the role of oxidative stress[J]. Engineering in Life Sciences, 2017, 17(7): 775-780. DOI:10.1002/elsc.201600228
|
| [30] |
ZAHEDIRAD M, ASADZADEH S, NIKOOYEH B, NEYESTANI TR, KHORSHIDIAN N, YOUSEFI M, MORTAZAVIAN AM. Fortification aspects of vitamin D in dairy products: a review study[J]. International Dairy Journal, 2019, 94: 53-64. DOI:10.1016/j.idairyj.2019.01.013
|
| [31] |
MAESTRO MA, MOLNÁR F, CARLBERG C. Vitamin D and its synthetic analogs[J]. Journal of Medicinal Chemistry, 2019, 62(15): 6854-6875. DOI:10.1021/acs.jmedchem.9b00208
|
| [32] |
CARLBERG C. Vitamin D in the context of evolution[J]. Nutrients, 2022, 14(15): 3018. DOI:10.3390/nu14153018
|
| [33] |
BALACHANDAR R, PULLAKHANDAM R, KULKARNI B, SACHDEV HS. Relative efficacy of vitamin D2 and vitamin D3 in improving vitamin D status: systematic review and meta-analysis[J]. Nutrients, 2021, 13(10): 3328. DOI:10.3390/nu13103328
|
| [34] |
DUCHOW EG, COOKE NE, SEEMAN J, PLUM LA, DeLUCA HF. Vitamin D binding protein is required to utilize skin-generated vitamin D[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(49): 24527-24532.
|
| [35] |
LJUBIC A, THULESEN ET, JACOBSEN C, JAKOBSEN J. UVB exposure stimulates production of vitamin D3 in selected microalgae[J]. Algal Research, 2021, 59: 102472. DOI:10.1016/j.algal.2021.102472
|
| [36] |
刘绍鹏, 姜艳, 宋凯, 耿君霞, 王伟, 康尚渝, 康惠鹏, 张成明. 维生素D3及其羟基衍生物合成研究进展[J]. 山东化工, 2023, 52(7): 73-82. LIU SP, JIANG Y, SONG K, GENG JX, WANG W, KANG SY, KANG HP, ZHANG CM. Progress in synthesis of vitamin D3 and its hydroxyl derivatives[J]. Shandong Chemical Industry, 2023, 52(7): 73-82 (in Chinese). DOI:10.3969/j.issn.1008-021X.2023.07.022 |
| [37] |
维生素D行业研究报告: 2023−2029年国内维生素D市场规模趋势与发展机遇分析[EB/OL]. [2024-02-28]. https://www.globalmarketmonitor.com.cn/reports/2102854-vitamin-d-market-report.html.
|
| [38] |
JORDÁ T, PUIG S. Regulation of ergosterol biosynthesis in Saccharomyces cerevisiae[J]. Genes, 2020, 11(7): 795. DOI:10.3390/genes11070795
|
| [39] |
GUO XJ, YAO MD, XIAO WH, WANG Y, ZHAO GR, YUAN YJ. Compartmentalized reconstitution of post-squalene pathway for 7-dehydrocholesterol overproduction in Saccharomyces cerevisiae[J]. Frontiers in Microbiology, 2021, 12: 663973. DOI:10.3389/fmicb.2021.663973
|
| [40] |
TAN TW, ZHANG M, GAO H. Ergosterol production by fed-batch fermentation of Saccharomyces cerevisiae[J]. Enzyme and Microbial Technology, 2003, 33(4): 366-370. DOI:10.1016/S0141-0229(03)00132-7
|
| [41] |
XIU X, SUN Y, WU YK, JIN K, QU LS, LIU YF, LI JH, DU GC, LV XQ, LIU L. Modular remodeling of sterol metabolism for overproduction of 7-dehydrocholesterol in engineered yeast[J]. Bioresource Technology, 2022, 360: 127572. DOI:10.1016/j.biortech.2022.127572
|
| [42] |
Di ROSA M, MALAGUARNERA L, NICOLOSI A, SANFILIPPO C, MAZZARINO C, PAVONE P, BERRETTA M, COSENTINO S, CACOPARDO B, PINZONE MR, NUNNARI G. Vitamin D3: an ever green molecule[J]. Frontiers in Bioscience (Scholar Edition), 2013, 5(1): 247-260.
|
| [43] |
FUJII Y, KABUMOTO H, NISHIMURA K, FUJII T, YANAI S, TAKEDA K, TAMURA N, ARISAWA A, TAMURA T. Purification, characterization, and directed evolution study of a vitamin D3 hydroxylase from Pseudonocardia autotrophica[J]. Biochemical and Biophysical Research Communications, 2009, 385(2): 170-175. DOI:10.1016/j.bbrc.2009.05.033
|
| [44] |
ABDULMUGHNI A, JÓŹWIK IK, PUTKARADZE N, BRILL E, ZAPP J, THUNNISSEN AM WH, HANNEMANN F, BERNHARDT R. Characterization of cytochrome P450 CYP109E1 from Bacillus megaterium as a novel vitamin D3 hydroxylase[J]. Journal of Biotechnology, 2017, 243: 38-47. DOI:10.1016/j.jbiotec.2016.12.023
|
| [45] |
DUNCAN KR, SUZUKI YJ. Vitamin E nicotinate[J]. Antioxidants, 2017, 6(1): 20. DOI:10.3390/antiox6010020
|
| [46] |
ZHU BQ, ZHANG Q, LU LY, BAO JJ, RONG XY, WANG JR, MEI XF. Cocrystals to tune oily vitamin E into crystal vitamin E[J]. International Journal of Pharmaceutics, 2021, 592: 120057. DOI:10.1016/j.ijpharm.2020.120057
|
| [47] |
MUÑOZ P, MUNNÉ-BOSCH S. Vitamin E in plants: biosynthesis, transport, and function[J]. Trends in Plant Science, 2019, 24(11): 1040-1051. DOI:10.1016/j.tplants.2019.08.006
|
| [48] |
MÈNE-SAFFRANÉ L. Vitamin E biosynthesis and its regulation in plants[J]. Antioxidants, 2017, 7(1): 2. DOI:10.3390/antiox7010002
|
| [49] |
NIU Y, ZHANG Q, WANG JJ, LI YJ, WANG XH, BAO Y. Vitamin E synthesis and response in plants[J]. Frontiers in Plant Science, 2022, 13: 994058. DOI:10.3389/fpls.2022.994058
|
| [50] |
2021年中国维生素E行业分析报告-行业规模与发展趋势预测[EB/OL]. [2024-02-28]. https://zhuanlan.zhihu.com/p/415427291.
|
| [51] |
ALBERMANN C, GHANEGAONKAR S, LEMUTH K, VALLON T, REUSS M, ARMBRUSTER W, SPRENGER GA. Biosynthesis of the vitamin E compound delta-tocotrienol in recombinant Escherichia coli cells[J]. Chembiochem: a European Journal of Chemical Biology, 2008, 9(15): 2524-2533. DOI:10.1002/cbic.200800242
|
| [52] |
SHEN B, ZHOU PP, JIAO X, YAO Z, YE LD, YU HW. Fermentative production of vitamin E tocotrienols in Saccharomyces cerevisiae under cold-shock-triggered temperature control[J]. Nature Communications, 2020, 11: 5155. DOI:10.1038/s41467-020-18958-9
|
| [53] |
LIU SC, LIU ZJ, WEI LJ, HUA Q. Pathway engineering and medium optimization for α-farnesene biosynthesis in oleaginous yeast Yarrowia lipolytica[J]. Journal of Biotechnology, 2020, 319: 74-81. DOI:10.1016/j.jbiotec.2020.06.005
|
| [54] |
JIAO X, SHEN B, LI M, YE LD, YU HW. Secretory production of tocotrienols in Saccharomyces cerevisiae[J]. ACS Synthetic Biology, 2022, 11(2): 788-799. DOI:10.1021/acssynbio.1c00484
|
| [55] |
JIAO X, BIAN Q, FENG TT, LYU XM, YU HW, YE LD. Efficient secretory production of δ-tocotrienol by combining pathway modularization and transportation engineering[J]. Journal of Agricultural and Food Chemistry, 2023, 71(23): 9020-9030. DOI:10.1021/acs.jafc.3c01743
|
| [56] |
HAN LY, WU YK, XU YM, ZHANG CY, LIU YF, LI JH, DU GC, LV XQ, LIU L. Engineered Saccharomyces cerevisiae for de novo δ-tocotrienol biosynthesis[J]. Systems Microbiology and Biomanufacturing, 2024, 4(1): 150-164. DOI:10.1007/s43393-023-00167-2
|
| [57] |
KANG MJ, BAEK KR, LEE YR, KIM GH, SEO SO. Production of vitamin K by wild-type and engineered microorganisms[J]. Microorganisms, 2022, 10(3): 554. DOI:10.3390/microorganisms10030554
|
| [58] |
CHATRON N, HAMMED A, BENOÎT E, LATTARD V. Structural insights into phylloquinone (vitamin K1), menaquinone (MK4, MK7), and menadione (vitamin K3) binding to VKORC1[J]. Nutrients, 2019, 11(1): 67. DOI:10.3390/nu11010067
|
| [59] |
AKBULUT AC, PAVLIC A, PETSOPHONSAKUL P, HALDER M, MARESZ K, KRAMANN R, SCHURGERS L. Vitamin K2 needs an RDI separate from vitamin K1[J]. Nutrients, 2020, 12(6): 1852. DOI:10.3390/nu12061852
|
| [60] |
KHALIL Z, ALAM B, AKBARI AR, SHARMA H. The medical benefits of vitamin K2 on calcium-related disorders[J]. Nutrients, 2021, 13(2): 691. DOI:10.3390/nu13020691
|
| [61] |
YAN QX, ZHANG T, O'CONNOR C, BARLOW JW, WALSH J, SCALABRINO G, XU F, SHERIDAN H. The biological responses of vitamin K2: a comprehensive review[J]. Food Science & Nutrition, 2023, 11(4): 1634-1656.
|
| [62] |
朱进伟, 桂王艳, 张安源, 彭湘屏. 维生素K2的相关合成研究及前景展望[J]. 中国抗生素杂志, 2020, 45(7): 646-654. ZHU JW, GUI WY, ZHANG AY, PENG XP. Synthetic research and prospects of vitamin K2[J]. Chinese Journal of Antibiotics, 2020, 45(7): 646-654 (in Chinese). DOI:10.3969/j.issn.1001-8689.2020.07.003 |
| [63] |
2020−2026全球及中国维生素K2市场现状及未来发展趋势[EB/OL]. [2024-02-28]. https://zhuanlan.zhihu.com/p/163678340.
|
| [64] |
维生素K2市场规模较大行业发展前景较好[EB/OL]. [2024-02-28]. https://baijiahao.baidu.com/s?id=1716122768003308509.
|
| [65] |
BASSET GJ, LATIMER S, FATIHI A, SOUBEYRAND E, BLOCK A. Phylloquinone (vitamin K1): occurrence, biosynthesis and functions[J]. Mini Reviews in Medicinal Chemistry, 2017, 17(12): 1028-1038.
|
| [66] |
WILKENS D, MEUSINGER R, HEIN S, SIMON J. Sequence analysis and specificity of distinct types of menaquinone methyltransferases indicate the widespread potential of methylmenaquinone production in bacteria and archaea[J]. Environmental Microbiology, 2021, 23(3): 1407-1421. DOI:10.1111/1462-2920.15344
|
| [67] |
REN LJ, PENG C, HU XC, HAN YW, HUANG H. Microbial production of vitamin K2: current status and future prospects[J]. Biotechnology Advances, 2020, 39: 107453. DOI:10.1016/j.biotechadv.2019.107453
|
| [68] |
CIRILLI I, ORLANDO P, SILVESTRI S, MARCHEGGIANI F, DLUDLA PV, KAESLER N, TIANO L. Carboxylative efficacy of trans and cis MK7 and comparison with other vitamin K isomers[J]. BioFactors, 2022, 48(5): 1129-1136. DOI:10.1002/biof.1844
|
| [69] |
MAHANAMA R, BERENJIAN A, VALTCHEV P, TALBOT A, BIFFIN R, REGTOP H, DEHGHANI F, KAVANAGH JM. Enhanced production of menaquinone 7 via solid substrate fermentation from Bacillus subtilis[J]. International Journal of Food Engineering, 2011, 7(5).
|
| [70] |
YANG SM, WANG YP, CAI ZG, ZHANG GY, SONG H. Metabolic engineering of Bacillus subtilis for high-titer production of menaquinone-7[J]. AIChE Journal, 2020, 66(1): e16754. DOI:10.1002/aic.16754
|
| [71] |
BERENJIAN A, MAHANAMA R, TALBOT A, REGTOP H, KAVANAGH J, DEHGHANI F. Designing of an intensification process for biosynthesis and recovery of menaquinone-7[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1347-1357. DOI:10.1007/s12010-013-0602-7
|
| [72] |
CUI SX, LV XQ, WU YK, LI JH, DU GC, LEDESMA-AMARO R, LIU L. Engineering a bifunctional Phr60-Rap60-Spo0A quorum-sensing molecular switch for dynamic fine-tuning of menaquinone-7 synthesis in Bacillus subtilis[J]. ACS Synthetic Biology, 2019, 8(8): 1826-1837. DOI:10.1021/acssynbio.9b00140
|
| [73] |
CUI SX, XIA HZ, CHEN TC, GU Y, LV XQ, LIU YF, LI JH, DU GC, LIU L. Cell membrane and electron transfer engineering for improved synthesis of menaquinone-7 in Bacillus subtilis[J]. iScience, 2020, 23(3): 100918. DOI:10.1016/j.isci.2020.100918
|
| [74] |
GAO QX, CHEN H, WANG GY, YANG W, ZHONG XT, LIU JZ, HUO XJ, LIU WF, HUANG JZ, TAO Y, LIN BX. Highly efficient production of menaquinone-7 from glucose by metabolically engineered Escherichia coli[J]. ACS Synthetic Biology, 2021, 10(4): 756-765. DOI:10.1021/acssynbio.0c00568
|
| [75] |
EL-SAMAD H. The next emergence of synthetic biology[J]. GEN Biotechnology, 2024, 3(1): 1-2. DOI:10.1089/genbio.2024.29134.editorial
|
| [76] |
维生素行业深度报告: 13个主要维生素品种生产工艺与市场格局解析[EB/OL]. [2024-02-28]. http://stock.finance.sina.com.cn/stock/go.php/vReport_Show/kind/lastest/rptid/641126651806/index.phtml.
|
| [77] |
GALANIE S, THODEY K, TRENCHARD IJ, FILSINGER INTERRANTE M, SMOLKE CD. Complete biosynthesis of opioids in yeast[J]. Science, 2015, 349(6252): 1095-1100. DOI:10.1126/science.aac9373
|
| [78] |
ALMAGRO L, SABATER-JARA AB, BELCHÍ-NAVARRO S, PEDREÑO MÁ. Recent trends in the biotechnological production of tocopherols using in vitro cultures[J]. Phytochemistry Reviews, 2021, 20(6): 1193-1207. DOI:10.1007/s11101-021-09742-8
|
| [79] |
SZTERK A, ZMYSŁOWSKI A, BUS K. Identification of cis/trans isomers of menaquinone-7 in food as exemplified by dietary supplements[J]. Food Chemistry, 2018, 243: 403-409. DOI:10.1016/j.foodchem.2017.10.001
|
| [80] |
王查娜. 合成生物学有望重塑工业生态[N]. 中国高新技术产业导报, 2023-12-04.
|
 2024, Vol. 40
2024, Vol. 40