
中国科学院微生物研究所、中国微生物学会主办
文章信息
- 易崇华, 钱思雨, 钮成拓, 郑飞云, 刘春凤, 李崎, 王金晶
- YI Chonghua, QIAN Siyu, NIU Chengtuo, ZHENG Feiyun, LIU Chunfeng, LI Qi, WANG Jinjing
- 天然紫外吸收剂gadusol在毕赤酵母中的生物合成及其性能分析
- Synthesis and properties of the natural ultraviolet absorber gadusol in Komagataella phaffii
- 生物工程学报, 2024, 40(9): 3039-3056
- Chinese Journal of Biotechnology, 2024, 40(9): 3039-3056
- 10.13345/j.cjb.230894
-
文章历史
- Received: December 26, 2023
- Accepted: April 12, 2024
2. 江南大学 酿酒科学与工程研究室, 江苏 无锡 214122
2. Laboratory of Brewing Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
Gadusol [3, 5, 6-三羟基-5-羟甲基-2-甲氧基环己-2-烯-1-酮(3, 5, 6-trihydroxy-5-hydroxymethyl-2-methoxycyclohex-2-en-1-one)]在一系列天然紫外吸收化合物中具有较为简单的化学结构[1],其在多种鱼卵如斑马鱼、鲑鱼、鲟鱼,以及珊瑚礁生态体系中天然存在,保护海洋生物免受紫外线伤害[2-3]。Gadusol的基础骨架是环己烯酮,其水溶液吸收光谱随pH而变化,酸性条件下(pH 2.5)最大吸收光谱为268 nm,中性条件下(pH 7.0)最大吸收光谱为296 nm[4]。Gadusol的存在能有效减少UVB (280−320 nm)诱导的DNA损伤特征物质环丁烷嘧啶二聚体(cyclobutane pyrimidine dimer, CPD)的形成[5]。其能够与多种氨基酸进行缩合反应生成一大类紫外防护物质类菌胞素氨基酸(mycosporine-like amino acids, MAAs)[6-7],以提供更全面的UV保护。
除此之外,gadusol在生物中的其他潜在作用也受到了广泛关注,尤其是其显著的抗氧化活性。研究表明鱼卵中提取的gadusol在生理pH下具有与抗坏血酸相当的自由基还原能力,并且拥有更强的过氧自由基链式反应破坏能力[8],且海鱼卵中的gadusol浓度是抗坏血酸浓度的数倍,高浓度的gadusol在海洋鱼类胚胎发育中具有重要的保护功能[9-10]。另外,gadusol在抗炎、抗衰老、细胞内氮储库等方面的功能也有相关的研究报道[11]。
Gadusol的合成依赖于糖磷酸环化酶(2-epi-5-epi-valiolone synthase, EEVS)和甲基转移-氧化还原酶(methyltransferase-oxidoreductase, MT-Ox)的催化,该合成途径已在酿酒酵母(Saccharomyces cerevisiae)中被成功构建,获得了能生产gadusol的酿酒酵母菌株(图 1)[12]。毕赤酵母(Komagataella phaffii)是美国食品药品监督管理局(Food and Drug Administration, FDA)认定为公认安全(generally regarded as safe, GRAS)的益生菌级别的微生物,已有5 000种蛋白在毕赤酵母中被成功表达,70余种蛋白产品进入市场[13]。与传统模式生物酿酒酵母相比,新兴模式生物毕赤酵母具有高水平重组蛋白表达与分泌能力[14],目标基因的蛋白表达水平能达到总蛋白的30%以上,远高于酿酒酵母[15]。此外,酿酒酵母表达系统存在蛋白高糖基化的问题,过度糖基化会导致合成蛋白相对分子质量不一致,对蛋白的折叠、稳定以及功能等造成影响,并且毕赤酵母较酿酒酵母具有更合适的糖基化修饰[16]。最后,毕赤酵母是Crabtree阴性酵母,能有效提高底物利用率,实现高密度发酵[17]。因此,毕赤酵母有望成为大规模生产天然产物的理想宿主,在工业生产中拥有巨大的应用潜力。
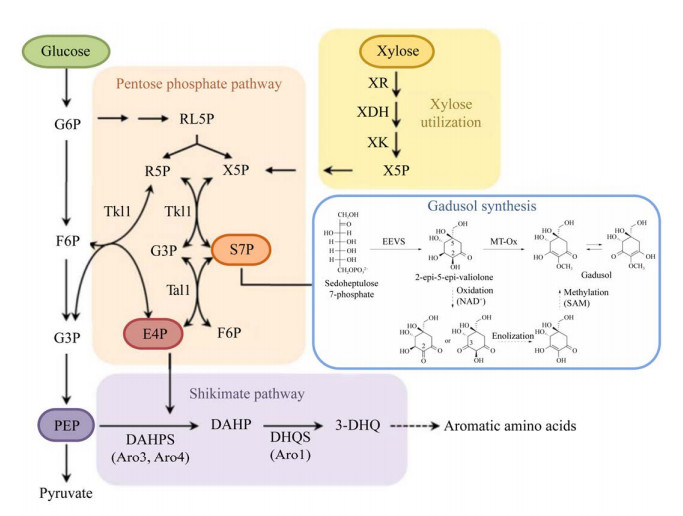
|
| 图 1 酵母利用木糖合成gadusol代谢示意图[2] Fig. 1 Metabolic diagram of yeast using xylose to synthesize gadusol[2]. The three-step catalytic reactions that MT-Ox may involve are represented by dotted arrows. G6P: Glucose 6-phosphate; RL5P: Ribulose 5-phosphate; X5P: Xylulose 5-phosphate; R5P: Ribose-5-phosphate; G3P: Glyceraldehyde 3-phosphate; S7P: Sedoheptulose 7-phosphate; E4P: Erythrose 4-phosphate; F6P: Fructose 6-phosphate; PEP: Phosphoenolpyruvate; DAHP: 3-deoxy-D-arabino-heptulosonic acid 7-phosphate; 3-DHQ: 3-dehydroquinic acid; XR: Xylose reductase; XDH: Xylitol dehydrogenase; XK: Xylulokinase; Tkl1: Transketolase; Tal1: Transaldolase. |
| |
本研究以毕赤酵母GS115为底盘生物,异源表达斑马鱼来源的gadusol生物合成基因,针对前体物质景天庚酮糖-7-磷酸(sedoheptulose 7-phosphate, S7P)积累量低的问题,强化木糖利用途径改变碳代谢流,提高目标物质的产量,并对合成物质的紫外防护性能和抗氧化能力进行评价,为gadusol的工业化生产与应用提供理论基础与技术支持。
1 材料与方法 1.1 菌株、培养基和试剂本研究中使用的质粒和菌株见表 1。
| Name | Description | Resource |
| Plasmids | ||
| pYEP352‑EEVS‑MT-Ox[12] | Carrying gadusol synthetic genes EEVS and MT-Ox | Lab store |
| pPIC9K | A high-copy constitutive plasmid | Lab store |
| pPIC9-Zeocin | pPIC9K variant, zeocin replaces kanamycin | Lab store |
| pY15TEF1‑XR‑XDH[12] | Carrying xylose metabolism XR-XDH pathway genes | Lab store |
| pUG6-XK | Carrying xylose metabolism gene XK | Lab store |
| pPIC9-Zeocin-EM | Carrying gadusol synthetic genes EEVS and MT-Ox | This study |
| pPIC9K-X2 | Carrying xylose metabolism genes XR and XDH | This study |
| pPIC9K-X3 | Carrying xylose metabolism genes XR, XDH and XK | This study |
| Strains | ||
| Escherichia coli JM109 | Lab store | |
| Komagataella phaffii GS115 | Mut+, his4− | Lab store |
| BY4743-rad1Δ | rad1 gene deletion, sensitive to UV | Lab store |
| GS-EM | GS115 transformed with pPIC9-Zeocin-EM | This study |
| GS-C | GS115 transformed with pPIC9-Zeocin | This study |
| GS-EM-X2 | GS-EM transformed with pPIC9K-X2 | This study |
| GS-EM-X3 | GS-EM transformed with pPIC9K-X3 | This study |
| GS-C-X2 | GS-C transformed with pPIC9K-X2 | This study |
| GS-C-X3 | GS-C transformed with pPIC9K-X3 | This study |
LB培养基:1%胰蛋白胨,0.5%酵母提取物,1%氯化钠,调节pH为7.4;添加2%琼脂粉配制固体培养基;利用氨苄青霉素(终浓度100 mg/L)或卡那霉素(终浓度50 mg/L)筛选转化子。
YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖;添加2%琼脂粉配制固体培养基;利用博来霉素(终浓度100 mg/L)或/和G418 (终浓度200 mg/L)筛选转化子。
YPX培养基:1%酵母提取物,2%蛋白胨,2%木糖;添加2%琼脂粉配制固体培养基;利用博来霉素(终浓度100 mg/L)或/和G418 (终浓度200 mg/L)筛选转化子。
葡萄糖、木糖、甲醇等试剂均购自国药集团化学试剂(上海)有限公司;蛋白胨、胰蛋白胨、酵母提取物等试剂及酵母基因组DNA快速抽提试剂盒均购自生工生物工程(上海)股份有限公司;还原糖含量检测试剂盒购自北京盒子生工科技有限公司;2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐购自阿拉丁试剂(上海)有限公司;1, 1-二苯基-2-苦基肼自由基购自梯希爱(上海)化成工业发展有限公司;2, 4, 6-三吡啶基三嗪[2, 4, 6-tris(2-pyridyl)-1, 3, 5-triazine, TPTZ]、L-抗坏血酸购自上海麦克林生化科技股份有限公司;PrimeSTAR® Max DNA Polymerase、T4 DNA Ligase、限制性内切酶等均购自宝日医生物技术(北京)有限公司;2×Hieff Clone® MultiS Enzyme Premix购自翌圣生物科技(上海)股份有限公司;质粒提取试剂盒等购自Omega Bio-Tek公司;引物由苏州金唯智生物科技有限公司合成。
1.2 仪器和设备T100 Thermal Cycler PCR仪、PowerPac™ 基础电泳仪、Gene Pulser Xcell电穿孔仪,伯乐生命医学产品(上海)有限公司;超声破碎仪,Sonics公司;Bio-Tek多功能酶标仪,北京伯腾仪器有限公司;NanoDrop分光光度计,赛默飞世尔科技有限公司;紫外可见分光光度计TU-1950,北京普析通用仪器有限责任公司;Labconco FreeZone 4.5 L台式冻干机,Labconco公司;安捷伦液相色谱仪1260 Infinity Ⅱ,安捷伦科技有限公司;超高效液相色谱串联四极杆飞行时间质谱联用仪,沃特世科技(上海)有限公司。
1.3 重组菌株的构建 1.3.1 Gadusol合成菌株的构建对NCBI数据库中斑马鱼(Danio rerio)的gadusol合成基因EEVS (GenBank登录号为LOC100003999)和MT-Ox (GenBank登录号为zgc: 113054)基于酵母进行密码子优化,优化后的基因通过基因合成获得。本研究所用引物见表 2。以pYEP352‑EEVS‑MT-Ox为模板,使用引物对EM-F/EM-R扩增gadusol合成基因表达盒EEVS-MT-Ox (图 2)。以pPIC9-Zeocin为模板,使用引物对pPIC9-Zeocin-F/pPIC9-Zeocin-R扩增克隆载体片段。随后通过Gibson Assembly将基因表达盒与克隆载体片段连接,连接产物转化入大肠杆菌JM109感受态,在含100 mg/L氨苄青霉素的LB平板上过夜培养,筛选转化子。提取转化子质粒,使用限制性内切酶Xho Ⅰ和Sal Ⅰ进行双酶切验证。采用BstB Ⅰ酶对上述构建质粒及pPIC9-Zeocin质粒进行线性化,采用电击转化法将线性化质粒分别导入毕赤酵母GS115感受态,涂布于含有100 mg/L博莱霉素(zeocin)的YPD平板培养3−4 d,挑选转化子进行菌落PCR,验证合成基因的存在。
| Primer name | Sequences (5′→3′) | Size (bp) |
| EM-F | CCAAGTAGCGAAGCCTATTTTAGATTCCTGACTTCAACTCAAGACGCAC | 49 |
| EM-R | CCGACATCCACAGGTCCATTCCAGTATAGCGACCAGCATTCACATACG | 48 |
| pPIC9-Zeocin-F | GTGAATGCTGGTCGCTATACTGGAATGGACCTGTGGATGTCGGATG | 46 |
| pPIC9-Zeocin-R | GAGTTGAAGTCAGGAATCTAAAATAGGCTTCGCTACTTGGAGCCAC | 46 |
| EEVS-F | GGTACTTGGAAGAGGAAAGCTGGTC | 25 |
| EEVS-R | CCAAACCAGTTGGCAATGGCATTC | 24 |
| MT-Ox-F | GTCTATGGCTGAAGCTTTGCCTG | 23 |
| MT-Ox-R | CATAACTCTACCAGCAGCTTGACAACAC | 28 |
| XR-XDH-F | CGAGCTCGCAGTATAGCGACCAGCATTCACATACG | 35 |
| XR-XDH-R | CTGCCGCGGCAAGTATTTTAGATTCCTGACTTCAACTCAAGACGCAC | 47 |
| pPIC9K-F | CTTGCCGCGGCAGCTAAATAATTAAATAAGTCCCAGTTTCTCCATACGAACCTTAAC | 57 |
| pPIC9K-R | CTGCGAGCTCGACTTACATTTAGAAGCATTGGGGCCCCGCGCGGAACCCCTATTTGTTTATTTTTC | 66 |
| XR-F | GAATTGACATCCTTGTTTTCCAACAATCTTGG | 32 |
| XR-R | CTGGTTATGATATGCCTGCTGTTGG | 25 |
| XDH-F | CAGCACCTTTACCAGCTCTAACCAAATC | 28 |
| XDH-R | GGGTCATGAATCTGCTGGTACTGTTG | 26 |
| pXK-F | CGGGGCCCCGAAGGGAAAGATATGAGCTATACAGCGG | 37 |
| pXK-R | CGAGCTCGGGGCGCCATAACCAAGGTATCTATAG | 34 |
| XK-F | CTTTTTAGCCTCGCACTCATAAGACCAAG | 29 |
| XK-R | GTTATTGGTGCTGATGCTTTGGCTG | 25 |
| Zeocin-F | GATCCCCCACACACCATAGCTTC | 23 |
| Zeocin-R | GGACGCTCGAAGGCTTTAATTTGC | 24 |
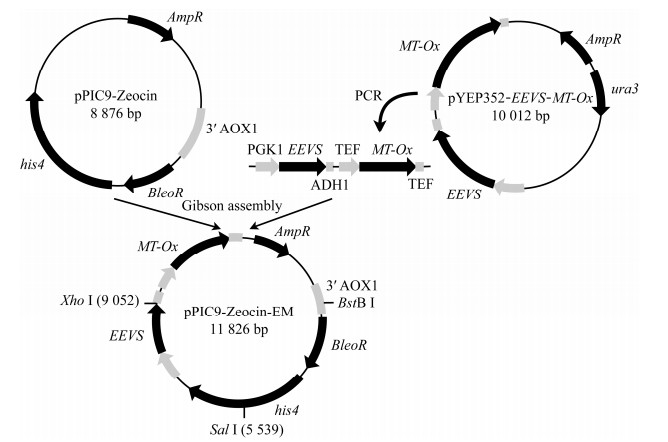
|
| 图 2 Gadusol合成基因表达载体构建流程图 Fig. 2 Construction of expression vector containing gadusol synthetic genes. |
| |
编码木糖还原酶(xylose reductase, XR)、木糖醇脱氢酶(xylitol dehydrogenase, XDH)和木酮糖激酶(xylulokinase, XK)的木糖同化基因XR (GenBank登录号为4839234)、XDH (GenBank登录号为4852013)和XK (GenBank登录号为4850923)来自树干毕赤酵母(Scheffersomyces stipites),由基因合成获得。以pY15TEF1‑XR‑XDH为模板,通过引物对XR-XDH-F/XR-XDH-R扩增XR-XDH表达盒,并使其两端带有Sac Ⅰ和Sac Ⅱ酶切位点。以pPIC9K为模板,使用引物对pPIC9K-F/pPIC9K-R扩增,获得携带相同酶切末端的载体片段。分别对插入基因片段与载体片段双酶切,纯化酶切产物,使用T4 DNA Ligase连接两个片段,连接产物转化入大肠杆菌JM109感受态,在含100 mg/L氨苄青霉素的LB平板上过夜培养,筛选转化子,通过限制性内切酶BamH Ⅰ和Sal Ⅰ酶切验证质粒正确性。随后,以pUG6-XK为模板,通过引物对pXK-F/pXK-R扩增XK基因,使其产生Apa Ⅰ与Sac Ⅰ末端酶切位点。对XK片段和携带XR‑XDH基因的pPIC9K质粒进行酶切连接操作,产物转化入大肠杆菌JM109感受态,以氨苄青霉素作为筛选标记,使用Apa Ⅰ和Sac Ⅰ进行双酶切验证(图 3)。采用Sal Ⅰ酶对上述质粒进行线性化,采用电击转化法分别将两个线性化质粒导入毕赤酵母感受态,涂布于含有200 mg/L G418的YPD平板培养2−3 d,挑选转化子进行菌落PCR,验证木糖同化基因的存在。
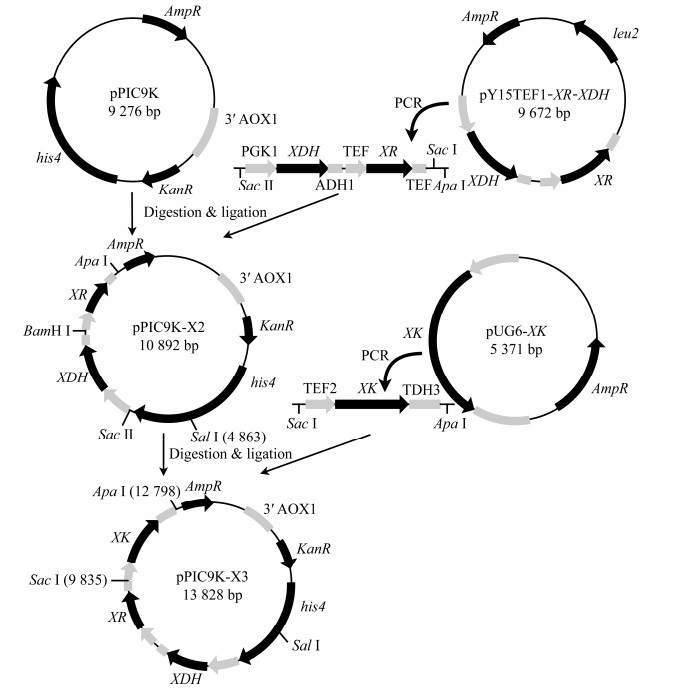
|
| 图 3 木糖同化途径表达载体构建流程图 Fig. 3 Construction of expression vectors containing xylose assimilation pathway. |
| |
以起始OD600为0.01接种菌株,在30 ℃、200 r/min条件下培养,使用酶标仪在600 nm处测定菌株生长情况。根据还原糖含量检测试剂盒的操作说明,使用酶标仪在540 nm处测定培养基中的残糖含量。
1.5 Gadusol标准品的制备及检测按照参考文献[2]的方法,利用gadusol极易溶于极性溶剂的性质,对其进行萃取。将受精72 h后的斑马鱼卵冷冻干燥,得到冻干胚胎,使用液氮研磨成细粉,胚胎粉末溶于80%甲醇(MeOH: H2O=80:20),并用80%甲醇提取2次,去除沉淀,取上清真空干燥。将提取物重悬于1 mL 80%甲醇,正己烷萃取2次,回收水层,干燥并称重。通过Agilent 1260 Infinity Ⅱ HPLC系统,使用Agilent ZORBAX Eclipse XDB-C18 (4.6 mm×250 mm, 5 µm)色谱柱,对提取物进行分析,绘制标准曲线。提取物溶于5 mmol/L PBS (pH 7.0),以甲醇和5 mmol/L PBS为流动相,进行梯度洗脱(0−20 min,1%甲醇;20−40 min,甲醇由1%变为95%;40−45 min,甲醇由95%变为1%;45−60 min,1%甲醇),流速0.3 mL/min,波长290 nm,柱内温度35 ℃[2]。物质溶于甲醇进行液相色谱-质谱联用(liquid chromatography- mass spectrometry, LC-MS)分析。
1.6 重组菌株gadusol的提取及检测将重组菌株在30 ℃、200 r/min发酵5 d后收集两组50 mL发酵液。一组发酵液6 000 r/min离心5 min,用水洗涤2次后烘干测定酵母细胞干重(cell dry weight, DCW)。另一组相同条件下离心分离上清与酵母细胞,上清经真空旋转蒸发浓缩后加入20 mL甲醇,−20 ℃过夜萃取,萃取液浓缩后用2 mL甲醇复溶,20 mL正己烷过夜萃取,回收甲醇层,真空旋转蒸发,浓缩液溶于10 mL的5 mmol/L磷酸盐缓冲液(PBS, pH 7.0),收集在预先称重的离心管中,冷冻干燥,获得发酵上清液提取样品。菌体用PBS溶液洗涤2次后重悬于20 mL甲醇中,超声破碎细胞(破碎功率350 W,破碎10 s,间隔20 s,全程工作时间60 min),回收破碎上清液,置于−20 ℃过夜,浓缩后溶于2 mL甲醇溶液,使用正己烷萃取,后续工作与上清液处理过程相同,获得酵母细胞提取样品。按照1.5中的分析条件进行检测。
1.7 合成产物紫外防护性能测定 1.7.1 全波长扫描使用5 mmol/L PBS (pH 7.0)对提取样品进行适当倍数稀释,以导入空质粒pPIC9-Zeocin的菌株发酵提取样品为空白,通过紫外可见分光光度计在波长190−400 nm范围内进行扫描,确定合成物质的紫外吸收范围以及最大吸收波长。
1.7.2 紫外辐照实验在含有200 mg/L G418的YPD培养基中培养紫外敏感酿酒酵母BY4743-rad1Δ,24 h后离心收集两份酵母沉淀。将含有gadusol的发酵提取物和空白组的发酵提取物分别溶于5 mmol/L PBS,配制成50 mg/mL的浓缩液,分别使用其洗涤BY4743-rad1Δ酵母沉淀2次。BY4743-rad1Δ最终以107个细胞/mL的浓度重悬于两种浓缩液中。各取1 mL BY4743-rad1Δ酵母重悬液均匀平铺在平板中,将平板置于UVB (带宽280−320 nm,主峰308 nm)或UVC (254 nm)灯下辐照,在照射15、30、60、90 min后,随机选取3个点,吸取3 µL细胞液点于YPD平板,30 ℃避光培养24 h,观察菌落生长情况。
1.8 合成产物抗氧化性测定 1.8.1 铁离子还原能力FRAP测定按照参考文献[18-19]的方法,配制铁离子还原抗氧化能力(ferric ion reducing antioxidant power, FRAP)工作溶液,绘制FeSO4标准曲线。配制浓度为1 mg/mL的待测样品及L-抗坏血酸(阳性对照)溶液,向180 μL FRAP工作液加入5 μL待测样品溶液,空白对照中加入5 μL蒸馏水,37 ℃暗反应30 min,测定在593 nm处的吸光值。根据标准曲线得到在与标准品拥有相同吸光值时样品的总抗氧化能力(使用FeSO4标准溶液浓度表示),实验重复3次[18-19]。
1.8.2 ABTS自由基清除能力测定按照参考文献[20]的方法,配制2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS]工作液。精确吸取10 μL不同浓度的样品和200 μL ABTS工作液混合作为实验组,使用200 μL PBS溶液替代ABTS工作液为对照组,用10 μL PBS溶液代替样品溶液为空白组,每个测试组设置3个平行,每个浓度重复3次。室温避光反应30 min后,测定在734 nm处的吸光值,以公式(1)计算ABTS自由基清除率。L-抗坏血酸为参照标准,对比两者的IC50值[20]。

|
(1) |
按照参考文献[21]的方法,配制1, 1-二苯基-2-苦基肼自由基(1, 1-diphenyl-2-picrylhydrazyl, DPPH)工作液。精确吸取10 μL不同浓度样品与190 μL DPPH工作液混合作为实验组,使用190 μL无水乙醇替代DPPH工作液为对照组,10 μL PBS溶液代替样品为空白组,每个测试组设置3个平行,每个浓度重复3次。室温避光反应20 min后,测定在517 nm处的吸光值,DPPH自由基清除率计算公式同公式(1)。L-抗坏血酸为参照标准,对比两者的IC50值[21]。
2 结果与分析 2.1 毕赤酵母中gadusol生物合成途径的构建从pYEP352‑EEVS‑MT-Ox上扩增gadusol合成基因表达盒,与毕赤酵母表达载体pPIC9-Zeocin连接得到质粒pPIC9-Zeocin-EM,质粒经双酶切验证正确后电转入毕赤酵母GS115感受态,对转化子进行菌落PCR验证。如图 4B所示,基因EEVS和MT-Ox成功导入GS115,该菌株被命名为GS-EM,导入pPIC9-Zeocin质粒的菌株命名为GS-C。如图 5所示,gadusol合成基因的表达并没有对毕赤酵母细胞生长造成影响。使用HPLC对发酵产物进行分析,通过标准曲线定量(检出限为0.037 mg/mL),发现菌株GS-EM的gadusol产量非常低(5.9 mg/L,0.69 mg/g DCW,胞内产物约70%)。使用串联质谱对发酵产物进行分析,结果如图 6C所示,与GS-C发酵提取物相比,GS-EM发酵提取物出现目标分子量(gadusol, Mw: 204.18),表明有新物质生成。
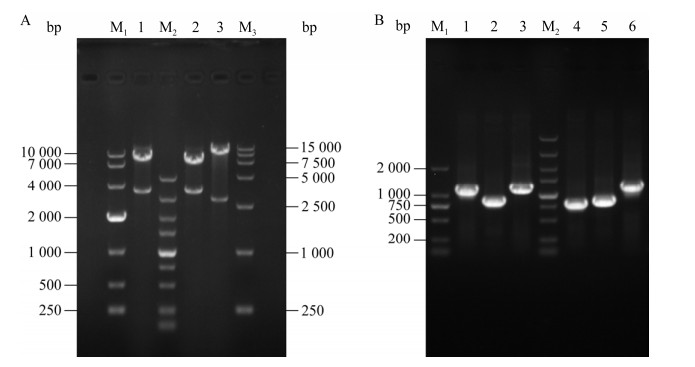
|
| 图 4 质粒pPIC9-Zeocin-EM、pPIC9K-X2和pPIC9K-X3双酶切验证(A)及菌株GS-EM、GS-C、GS-EM-X2、GS-EM-X3、GS-C-X2、GS-C-X3菌落PCR验证(B) Fig. 4 Plasmids pPIC9-Zeocin-EM, pPIC9K-X2 and pPIC9K-X3 double enzyme digestion verification (A), strains GS-EM, GS-C, GS-EM-X2, GS-EM-X3, GS-C-X2, GS-C-X3 colony PCR verification (B). A: Lane M1: DNA marker DL10000; Lane M2: DNA marker DL5000; Lane M3: DNA marker DL15000; Lane 1: pPIC9-Zeocin-EM, 3 513 bp and 8 313 bp; Lane 2: pPIC9K-X2, 3 447 bp and 7 445 bp; Lane 3: pPIC9K-X3, 2 963 bp and 10 865 bp. B: Lane M1: DNA marker DL2000; Lane M2: DNA marker DL5000; Lane 1: Primer pair EEVS-F/EEVS-R, 1 186 bp (GS-EM); Lane 2: Primer pair MT-Ox-F/MT-Ox-R, 907 bp (GS-EM); Lane 3: Primer pair Zeocin-F/Zeocin-R, 1 230 bp (GS-C); Lane 4: Primer pair XR-F/XR-R, 832 bp (GS-EM-X2/GS-C-X2); Lane 5: Primer pair XDH-F/XDH-R, 872 bp (GS-EM-X2/GS-C-X2); Lane 6: Primer pair XK-F/XK-R, 1 263 bp (GS-EM-X3/GS-C-X3). |
| |
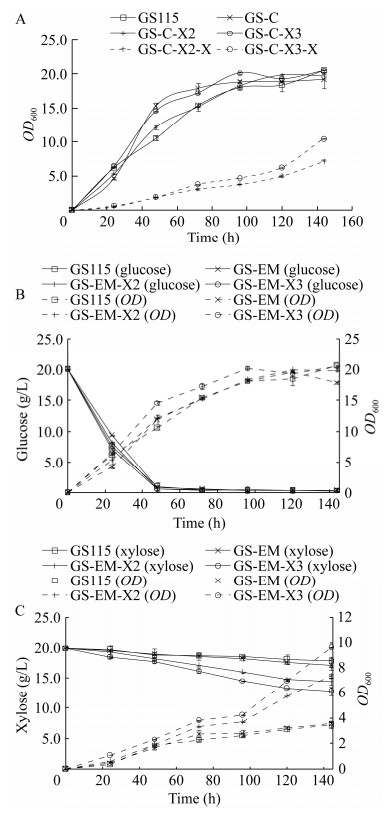
|
| 图 5 亲本菌株与工程菌株的生长(A)及葡萄糖(B)、木糖(C)利用情况 Fig. 5 The growth (A) and utilization of glucose (B) and xylose (C) of the original strain and the engineered strains. |
| |
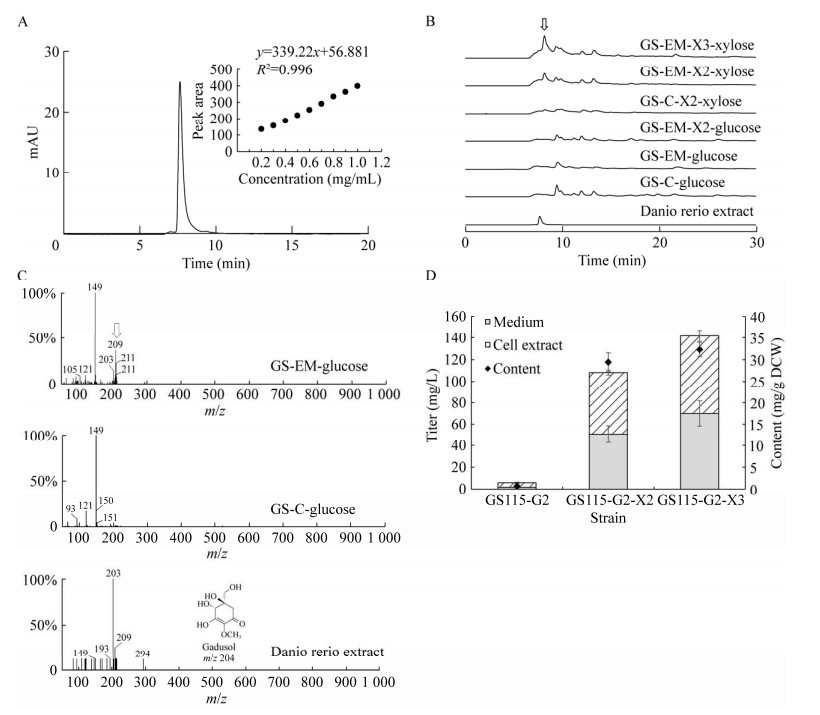
|
| 图 6 工程菌合成gadusol的鉴定分析 Fig. 6 Identification and analysis of gadusol synthesis by engineering strains. A: Chromatogram of zebrafish extract. B: Chromatogram of yeast extract. C: Mass spectra of zebrafish extract and yeast extract. D: Intracellular and extracellular gadusol content. A:斑马鱼提取物色谱图. B:酵母提取物色谱图. C:斑马鱼提取物及酵母提取物质谱图. D:胞内、外gadusol含量. |
| |
为进一步提高工程菌gadusol产量,将S. stipites的XR-XDH木糖同化途径引入毕赤酵母以提高前体物质S7P的积累量。在XR-XDH途径中,木糖还原酶(XR)将木糖转化为木糖醇,木糖醇脱氢酶(XDH)进一步将木糖醇转化为木酮糖,木酮糖被木酮糖激酶(XK)转化为X5P,进入磷酸戊糖途径(pentose phosphate pathway, PPP)。从pY15TEF1‑XR‑XDH上扩增XR‑XDH基因表达盒,与毕赤酵母表达载体pPIC9K连接得到质粒pPIC9K-X2,质粒经双酶切验证后电转入毕赤酵母GS-EM感受态,获得转化子并将其命名为GS-EM-X2 (图 4B)。该菌株在YPD培养基中显示出与亲本菌株相似的生长速率(图 5B)。培养120 h后,菌株GS-EM-X2在YPX培养基中的OD600约为GS115的2倍(图 5C),表明XR-XDH途径的引入在一定程度上提高了菌株的木糖利用效率。GS-EM-X2发酵产物的HPLC结果如图 6B所示,当使用葡萄糖作为唯一碳源时,GS-EM-X2提取物在液相图谱上较对照组无明显差异。而使用木糖作为唯一碳源时,GS-EM-X2提取物在目标物质出峰时间段出现了一个明显的吸收峰,此时gadusol产量达到108.2 mg/L (29.4 mg/g DCW,胞内产物占比53.2%),比仅含有gadusol合成途径的菌株中gadusol产量提高约42倍,并且随着产物的积累,gadusol会被细胞分泌至胞外。结果表明,引入XR-XDH途径是改善PPP代谢通量、提高S7P积累和gadusol合成的有效策略。
木酮糖激酶(XK)是木糖代谢限速步骤之一,在酿酒酵母中过表达自身木酮糖激酶基因可提高木糖的利用率[22]。推测在毕赤酵母中过表达木酮糖激酶基因同样也可以促使木糖代谢流向PPP。将pUG6-XK中的XK基因插入质粒pPIC9K-X2,构建质粒pPIC9K-X3,转化毕赤酵母GS-EM感受态,获得菌株GS-EM-X3 (图 4B)。使用YPX培养基发酵发现GS-EM-X3中的gadusol产量进一步提高到141.8 mg/L (32.3 mg/g DCW,胞内产物占比50.6%),较GS-EM菌株gadusol产量提高约46倍。此时,GS-EM-X3菌株在YPX培养基中发酵120 h的木糖消耗量约为7 g/L,是GS115的3.5倍。然而,由于酵母对木糖的有效利用率不及葡萄糖,菌株在以木糖作为唯一碳源的培养基中表现出明显的生长缓慢以及糖消耗速率缓慢的情况,因此向培养基中添加一定量的葡萄糖可能有助于促进细胞生长和gadusol的产生。
2.2 合成产物紫外防护性能分析为探究合成物质的紫外防护性能,对GS-EM发酵产物在紫外光谱范围进行全波长扫描。结果发现GS-EM发酵产物在275−305 nm范围内存在明显吸收,最大吸收波长为290 nm,结果与天然gadusol扫描结果一致(图 7A、7B)。为进一步探究该物质的紫外保护能力,将紫外敏感菌株BY4743-rad1Δ以107个细胞/mL的浓度分别悬浮于GS-C和GS-EM的发酵提取物浓缩液中。如图 7C所示,在使用UVB/UVC辐照60 min后,悬浮于对照溶液中的细胞完全死亡,而悬浮于含有gadusol的溶液中的细胞在辐射90 min后仍表现出较高的活性。表明GS-EM发酵浓缩液降低了菌株BY4743-rad1Δ对紫外的敏感性,GS-EM合成的物质即gadusol具有UVB/UVC保护能力。
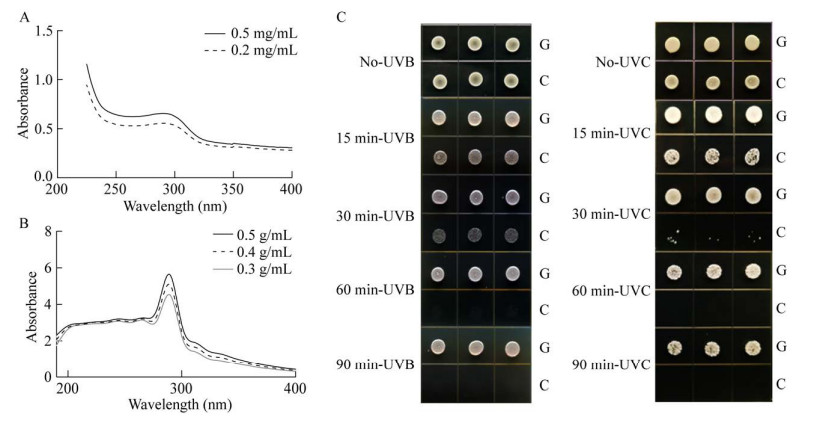
|
| 图 7 天然gadusol (A)与GS-EM发酵提取物(B)紫外吸收情况及合成物质紫外保护情况(C) Fig. 7 UV absorption of natural gadusol and GS-EM fermentation extract and UV protection of synthetic substances. A: Gadusol standard full-wavelength scanning. B: GS-EM fermentation extract full wavelength scanning. C: UVB or UVC radiation UV sensitive yeast strain growth (G: GS-EM concentrate; C: GS-C concentrate). |
| |
L-抗坏血酸、GS-EM-X3发酵液提取物和GS-C-X3发酵液提取物的抗氧化能力测定结果如表 3所示。从FRAP、ABTS和DPPH这3个指标反映的情况看,L-抗坏血酸的抗氧化能力均显著高于GS-EM-X3发酵液提取物(P < 0.01)。液相结果显示,经过萃取浓缩处理得到的斑马鱼提取物纯度达到98%以上,而酵母提取物纯度较低,仅为15%−20%,这可能是由于该提取方法是基于斑马鱼卵建立的,在酵母细胞产物提取过程中无法去除某些小分子物质,导致提取物浓度较低。但是,GS-EM-X3与GS-C-X3发酵提取物的抗氧化能力显示出明显差异。菌株GS-EM-X3和GS-C-X3仅存在是否存在gadusol合成途径的差异,因此两者之间抗氧化能力差异可作为初步评估gadusol抗氧化性能的指标。从FRAP值与ABTS的IC50值上看,GS-EM-X3的抗氧化能力高于GS-C-X3,但并没有表现出显著差异(P > 0.05),而两者对DPPH自由基的清除能力存在显著性差异(P < 0.01)。结果表明gadusol能够还原金属离子并直接清除自由基,在DPPH自由基清除上具有明显优势。
| Sample | FRAP (mmol/L) | ABTS scavenging efficiency | DPPH scavenging efficiency | |||||
| Regression equation | R2 | IC50 (g/L) | Regression equation | R2 | IC50 (g/L) | |||
| L-ascorbic acid | 12.700±0.300 | y=570.170x+3.515 | 0.997 | 0.082±0.005 | y=509.820x+4.020 | 0.992 | 0.090±0.010 | |
| GS-EM-X3 | 0.090±0.020 | y=60.907x+4.818 | 0.998 | 0.742±0.060 | y=5.361x+4.480 | 0.993 | 8.493±0.070 | |
| GS-C-X3 | 0.020±0.005 | y=47.293x+7.645 | 0.992 | 0.896±0.060 | y=2.284x+4.355 | 0.992 | 20.020±0.190 | |
由于每种抗氧化剂存在结构、组成、性质等方面的差异,导致其与金属离子及自由基的反应速率均不相同,到达反应平衡的时间也不相同,使用固定的反应时间评价不同抗氧化剂的抗氧化能力可能会造成错误判断[23]。因此对gadusol在FRAP法、DPPH法和ABTS法中的反应时间进行了探究。结果如图 8所示,在常用的抗氧化反应时间(20−30 min)内,L-抗坏血酸的3种抗氧化能力评价实验均达到平衡,且ABTS法、DPPH法测定结果分别在反应1 h和3 h后出现下降,而gadusol在反应5 h后仍保持较高的变化率。从固定反应时间到反应5 h,L-抗坏血酸使用FRAP法、ABTS法和DPPH法测定的抗氧化能力变化率分别为18.16%、0.70%和−3.35%,而GS-EM-X3发酵提取物对应的抗氧化能力变化率为90.83%、25.50%和131.80%。相比于L-抗坏血酸,GS-EM-X3发酵提取物达到反应平衡需要更长的时间,常用的固定反应时间不太适用于该物质抗氧化能力评价。为进一步探究gadusol的抗氧化能力的持续性,测定了发酵提取物ABTS法与DPPH法反应24 h后的自由基清除率。结果如图 8D所示,GS-EM-X3发酵提取物ABTS自由基清除率与DPPH自由基清除率分别在反应10 h和15 h后达到平衡,且在反应24 h后未出现降低趋势。与L-抗坏血酸相比,发酵提取物在进入反应平衡期后具有更长的抗氧化效果持续时间,显示出更强的稳定性,有作为长效抗氧化剂的潜在应用价值。
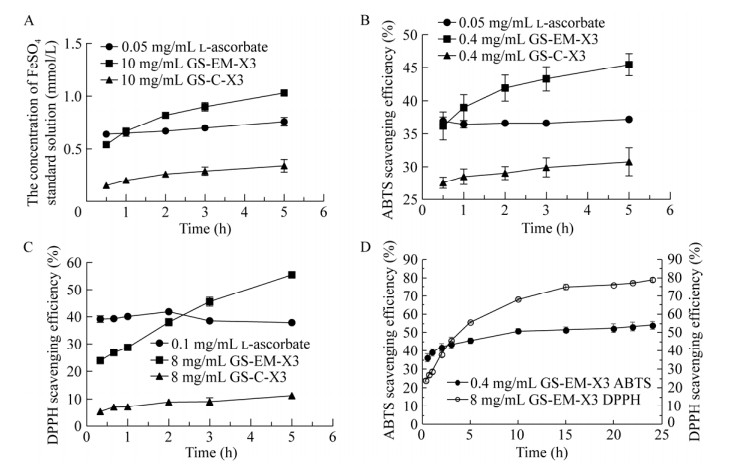
|
| 图 8 反应时间对FRAP法(A)、ABTS法(B)和DPPH法(C)测定L-抗血酸与gadusol抗氧化性结果的影响及gadusol自由基清除能力持续时间探究(D) Fig. 8 Effect of reaction time on the results of FRAP (A), ABTS (B) and DPPH (C) radical scavenging rate of L-ascorbate and gadusol, and the duration of gadusol's free radical scavenging ability (D). |
| |
紫外辐射按照波长被分为UVC (100−280 nm),UVB (280−320 nm)和UVA (320−400 nm),所有的UVC和超过90%的UVB会被大气层和水蒸气等吸收掉,少部分的UVB和大部分的UVA到达地面。其中,UVB被认为是引起皮肤癌的最主要因素[24]。UVB能辐射到清澈、少植被覆盖的水下10 m,生活在约占地球表面积75%的水生环境中的生物为抵御潜在的致命紫外辐射,进化出了一系列针对紫外诱导损伤的保护机制。藻类、微生物、珊瑚及众多无脊椎动物中广泛存在的防晒物质gadusol和其衍生物类菌胞素氨基酸[25]是有效的UV保护紫外吸收剂,具有强光稳定性,能够快速地将光能转化为热能[4, 26]。
天然gadusol主要从鱼卵中提取,其提取受动物生长速度限制且环境不友好。为解决天然提取面临的提取量少、提取效率低、提取工艺复杂以及对生物造成伤害等问题,利用微生物工厂实现天然产物的合成是目前最有效、最普遍的方法之一。酿酒酵母是真核生物的模式生物,常用于异源表达真核生物来源基因。Osborn等首次实现斑马鱼来源gadusol合成基因在酿酒酵母中的表达,gadusol积累量约20 mg/L[2]。伍小艺等通过引入木糖代谢途径进一步提升了gadusol的产量(40.5 mg/L)[12],是目前在酿酒酵母中报道的合成gadusol的最高产量。然而目前gadusol的生物合成产量较低,未能满足其工业化生产需求。本研究尝试将毕赤酵母作为异源宿主,重组菌株GS-EM-X3产量可达141.8 mg/L,并首次在酵母胞外检测到gadusol,有效提升了目的产物的合成与分泌。产物的外泌为后续的分离、纯化提供便利。同时,毕赤酵母的高密度培养有利于推进该物质工业化生产进程。
在gadusol的合成途径中,PPP的中间代谢产物S7P是gadusol合成中所必需的底物,而在以葡萄糖为碳源的发酵过程中,大部分碳源流向糖酵解途径,只有少部分的碳流进入PPP[27]参与gadusol的合成。有研究报道将木糖途径引入酵母细胞,能够显著提升S7P的积累[28-29]。Park等将木糖代谢途径引入酿酒酵母用于shinorine (一种MAAs)的生产,重组菌株在木糖培养基中的产量是葡萄糖培养基中的24.9倍[30]。Kim等的研究发现酿酒酵母在葡萄糖: 木糖为1:1的培养基中,shinorine产量比在纯葡萄糖培养基中高出34倍[31]。Jin等构建了能够合成MAAs的解脂耶氏酵母(Yarrowia lipolytica)重组菌株,其在甘油: 木糖为1:1的SC培养基中MAAs产量约是甘油: 葡萄糖为1:1培养基中的1.17倍,是纯甘油培养基中的1.25倍[32]。木糖代谢途径在gadusol的合成中同样显示出积极影响,前期研究中发现产gadusol的酿酒酵母在木糖培养基中的产量约为葡萄糖培养基中的10倍[12]。使用木糖作为合成这类天然紫外防晒物质的新碳源被认为是一种有效提高产量的策略[12]。同时,木糖的利用也是实现地球最丰富且廉价的可再生资源木质纤维素发酵的基础[31]。酵母主要通过XI途径或XR-XDH途径代谢木糖[27],由于木糖异构酶(xylose isomerase, XI)大多存在于亲缘关系较远的细菌中,目前能够在酵母中活性表达的木糖异构酶仅有两种来源[33],在酵母的木糖发酵中,多使用来源于亲缘较近的树干毕赤酵母XR-XDH途径相关基因。本研究在毕赤酵母中引入XR-XDH-XK木糖途径,重组菌株的gadusol产量约是YPD培养基中的46倍,但由于菌株对木糖的同化较低效,出现明显的生长缓慢,在shinorine的相关研究中也存在类似的现象[30]。因此经常将木糖与葡萄糖、甘油等碳源结合使用,向培养基中添加一定比例的葡萄糖有助于菌株的生长,而木糖则主要用于S7P的积累[31]。在使用混合碳源进行发酵过程中,优化的碳源比例是产物高效合成的重要基础[30],因此,葡萄糖与木糖的比例优化将能进一步提升gadusol的产量。
自由基是紫外辐射的一大产物。原子氧在紫外光子的作用下,会形成羟基自由基、氮氧自由基和超氧化物等自由基衍生物[34]。核苷酸对自由基极其敏感,核苷酸碱基的氧化使碱基错配率上升,间接造成DNA突变,这种氧化损伤可能存在致癌性[35]。蛋白质、脂质等大分子也极易受到自由基的攻击,导致其结构和功能发生改变[35]。研究表明,gadusol的紫外辐射防护机制除了紫外吸收外,还包含清除自由基能力[8]。在生理pH下鱼卵提取的gadusol具有与L-抗坏血酸相似的ABTS自由基清除率,氧化自由基的吸收能力是L-抗坏血酸的6倍,是优秀的超氧自由基链式反应的破坏者[8, 36]。
FRAP法是在酸性条件下,抗氧化物质将Fe3+-三吡啶三嗪(Fe3+-tripyridine triazine, Fe3+-TPTZ)还原成蓝紫色Fe2+-TPTZ络合物,属于典型的电子转移(electron transfer, ET)反应,是一种用氧化还原来评价抗氧化活性的化学方法。样品的总抗氧化能力(FRAP值)常以FeSO4标准溶液的浓度来表示,FRAP值越大,样品抗氧化能力越强[37]。ABTS在氧化剂的作用下被氧化为蓝绿色的ABTS+阳离子自由基,抗氧化物的存在会抑制ABTS+的产生,反应主要涉及ET,吸光度的变化取决于抗氧化物的抗氧化能力[38-40]。DPPH是一种稳定的呈深紫色的氮中心自由基,当抗氧化物质存在时,主要通过氢原子转移(hydrogen atom transfer, HAT)将DPPH自由基转化为无色的还原态形式,在一定范围内吸光度的降低与自由基清除率成正比[38-41]。三种评价方法是常用的抗氧化能力评价方法,可用于评价供试物质的抗氧化机制。Gadusol的抗氧化机制包括ET和HAT两种类型,其中可能以HAT为主要清除机制,推测这可能与gadusol多羟基结构有关。有研究表明,gadusol对于ABTS自由基的清除可分为两个部分:1 min内的快速清除和较长时间的慢速清除[8]。这可能与其复杂的反应机理有关,推测gadusol第一个氧化步骤的产物在以较低的速率与自由基进一步作用[8]。从而导致其在抗氧化实验中出现长时间的结果变化。Gadusol具有巨大的光稳定性,其在受到能量(光能)激发后会返回基态,且未出现明显的光降解,能经历多次激发循环[25],推测该性质可能有利于其长时间的抗氧化保护。另外,由于在空气中gadusol较L-抗坏血酸表现出更强的稳定性[42],因此这可能导致其能够在进入抗氧化反应平衡后具有更长时间的稳定清除效率。对于gadusol具体的抗氧化机制还需进一步研究。
4 结论本研究成功构建利用木糖高产gadusol的毕赤酵母重组菌株,木糖途径的强化提高了前体物质S7P的积累,实现了gadusol产量的显著增加。合成gadusol在UVB、UVC波长范围内具有良好紫外吸收及细胞保护能力。FRAP、ABTS和DPPH法检测的结果表明,合成产物具有铁离子及自由基的还原及清除能力。由于其具有多羟基结构,因此对DPPH自由基的清除效果尤为显著。研究发现,随反应时间的延长,gadusol发酵提取物3种抗氧化评价结果均出现明显改变,需较长时间才能达到反应平衡。且该物质具有长时间、稳定的自由基清除能力,其可能作为一种长效的抗氧化剂。Gadusol的紫外吸收及抗氧化性能,能够直接或间接地保护皮肤免受UV的伤害,因此其在紫外防护领域中具有巨大应用潜力。
| [1] |
LOSANTOS R, CHURIO MS, SAMPEDRO D. Computational exploration of the photoprotective potential of gadusol[J]. ChemistryOpen, 2015, 4(2): 155-160. DOI:10.1002/open.201402125
|
| [2] |
OSBORN AR, ALMABRUK KH, HOLZWARTH G, ASAMIZU S, LADU J, KEAN KM, KARPLUS PA, TANGUAY RL, BAKALINSKY AT, MAHMUD T. De novo synthesis of a sunscreen compound in vertebrates[J]. eLife, 2015, 4: e05919. DOI:10.7554/eLife.05919
|
| [3] |
PLACK PA, FRASER NW, GRANT PT, MIDDLETON C, MITCHELL AI, THOMSON RH. Gadusol, an enolic derivative of cyclohexane-1, 3-dione present in the roes of cod and other marine fish. isolation, properties and occurrence compared with ascorbic acid[J]. The Biochemical Journal, 1981, 199(3): 741-747. DOI:10.1042/bj1990741
|
| [4] |
ORALLO DE, LORES NJ, ARBELOA EM, BERTOLOTTI SG, CHURIO MS. Sensitized photo-oxidation of gadusol species mediated by singlet oxygen[J]. Journal of Photochemistry and Photobiology B: Biology, 2020, 213: 112078. DOI:10.1016/j.jphotobiol.2020.112078
|
| [5] |
RICE MC, LITTLE JH, FORRISTER DL, MACHADO J, CLARK NL, GAGNON JA. Gadusol is a maternally provided sunscreen that protects fish embryos from DNA damage[J]. bioRxiv: the Preprint Server for Biology, 2023, 33(15): 3229-3237.
|
| [6] |
顾智强, 张振华, 徐琰雯, 顾梦娇, 徐强, 朱自强, 钟伯坚. 南极绿藻中类菌胞素氨基酸对UV-B胁迫的响应[J]. 海洋科学, 2018, 42(12): 37-46. GU ZQ, ZHANG ZH, XU YW, GU MJ, XU Q, ZHU ZQ, ZHONG BJ. Study of response of mycosporine-like amino acids in Antarctic green algae to UV-B radiation[J]. Marine Sciences, 2018, 42(12): 37-46 (in Chinese). |
| [7] |
陈小兰, 邓国宾, 刘开庆, 陈善娜. 水生生物的紫外光防护剂: 类菌胞素氨基酸[J]. 植物学通报, 2006, 23(1): 78-86. CHEN XL, DENG GB, LIU KQ, CHEN SN. UV-protective metabolites in aquatic organisms: mycosporine-like amino acids[J]. Chinese Bulletin of Botany, 2006, 23(1): 78-86 (in Chinese). DOI:10.3969/j.issn.1674-3466.2006.01.011 |
| [8] |
ARBELOA EM, UEZ MJ, BERTOLOTTI SG, CHURIO MS. Antioxidant activity of gadusol and occurrence in fish roes from Argentine Sea[J]. Food Chemistry, 2010, 119(2): 586-591. DOI:10.1016/j.foodchem.2009.06.061
|
| [9] |
DUNLAP WC, YAMAMOTO Y. Small-molecule antioxidants in marine organisms: antioxidant activity of mycosporine-glycine[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1995, 112(1): 105-114. DOI:10.1016/0305-0491(95)00086-N
|
| [10] |
DAHMS HU, LEE JS. UV radiation in marine ectotherms: molecular effects and responses[J]. Aquatic Toxicology, 2010, 97(1): 3-14. DOI:10.1016/j.aquatox.2009.12.002
|
| [11] |
GUEDES M, GONÇALVES VMF, TIRITAN ME, REIS RL, FERREIRA H, NEVES NM. Aqueous extracts of fish roe as a source of several bioactive compounds[J]. Separations, 2022, 9(8): 210. DOI:10.3390/separations9080210
|
| [12] |
伍小艺, 王金晶, 余施雨, 易崇华, 周庭安, 李崎, 钮成拓, 郑飞云, 刘春凤, 许鑫. 一种具有强化防晒效果的酿酒酵母及其应用: CN114621883B[P]. 2023-08-25. WU XY, WANG JJ, YU SY, YI CH, ZHOU TA, LI Q, NIU CT, ZHENG FY, LIU CF, XU X. Saccharomyces cerevisiae with enhanced sunscreen effect and application of Saccharomyces cerevisiae: CN114621883B[P]. 2023-08-25 (in Chinese). |
| [13] |
钱芷兰, 宋丽丽, 刘启, 龚秀龙, 康艺嘉, 何子雨, 龙浩雨, 蔡孟浩. 非常规酵母天然产物合成[J]. 生物工程学报, 2023, 39(6): 2284-2312. QIAN ZL, SONG LL, LIU Q, GONG XL, KANG YJ, HE ZY, LONG HY, CAI MH. Biosynthesis of natural products by non-conventional yeasts[J]. Chinese Journal of Biotechnology, 2023, 39(6): 2284-2312 (in Chinese). DOI:10.13345/j.cjb.220914 |
| [14] |
艾聪聪, 龚国利, 焦小雨, 田露, 盖中朝, 缑敬轩, 李慧. 毕赤酵母作为基础研究的新兴模式生物的研究进展[J]. 广西师范大学学报(自然科学版), 2023, 1-13. AI CC, GONG GL, JIAO XY, TIAN L, GAI ZC, GOU JX, LI H. Komagataella phaffii serves as a model organism for emerging basic research[J]. Journal of Guangxi Normal University (Natural Science Edition), 2023, 1-13 (in Chinese). |
| [15] |
GAO JC, JIANG LH, LIAN JZ. Development of synthetic biology tools to engineer Pichia pastoris as a chassis for the production of natural products[J]. Synthetic and Systems Biotechnology, 2021, 6(2): 110-119. DOI:10.1016/j.synbio.2021.04.005
|
| [16] |
刘冰, 黄志强, 郑潇, 张建国. 毕赤酵母外源蛋白分泌途径的研究进展[J]. 微生物学杂志, 2019, 39(4): 83-90. LIU B, HUANG ZQ, ZHENG X, ZHANG JG. Advances in heterologous protein secretory pathway from Komagataella phaffii[J]. Journal of Microbiology, 2019, 39(4): 83-90 (in Chinese). |
| [17] |
JIAO X, GU YH, ZHOU PP, YU HW, YE LD. Recent advances in construction and regulation of yeast cell factories[J]. World Journal of Microbiology and Biotechnology, 2022, 38(4): 57. DOI:10.1007/s11274-022-03241-4
|
| [18] |
高月红, 郑建普, 朱春赟, 李亚娟, 可燕, 卞卡. 抗氧化能力检测方法评估及微型化[J]. 中国药学杂志, 2008, 43(24): 1863-1867. GAO YH, ZHENG JP, ZHU CY, LI YJ, KE Y, BIAN K. Evaluation and miniaturization for antioxidant capacity measurement[J]. Chinese Pharmaceutical Journal, 2008, 43(24): 1863-1867 (in Chinese). DOI:10.3321/j.issn:1001-2494.2008.24.007 |
| [19] |
BUENO-PEREIRA TO, BERTOZZI-MATHEUS M, ZAMPIERI GM, ABBADE JF, CAVALLI RC, NUNES PR, SANDRIM VC. Markers of endothelial dysfunction are attenuated by resveratrol in preeclampsia[J]. Antioxidants, 2022, 11(11): 2111. DOI:10.3390/antiox11112111
|
| [20] |
王荣, 罗倩, 冯怡. DPPH、ABTS和FRAP微量法测定山奈酚的抗氧化能力[J]. 广州化工, 2021, 49(3): 58-59, 63. WANG R, LUO Q, FENG Y. Determination of antioxidant effects of kaempferol by micro-model of DPPH, ABTS and FRAP assay[J]. Guangzhou Chemical Industry, 2021, 49(3): 58-59, 63 (in Chinese). |
| [21] |
ZENG WC, SHI B. Common methods of antioxidant activity evaluation for natural products: a review[J]. Chemical Industry and Engineering Progress, 2013, 32(6): 1205-1213, 1247. |
| [22] |
曹喜生. 木酮糖激酶基因表达载体构建及在酿酒酵母中的超表达[D]. 哈尔滨: 黑龙江大学硕士学位论文, 2009. CAO XS. Construction of xylulose kinase gene expression vector and its overexpression in Saccharomyces cerevisiae[D]. Harbin: Master's Thesis of Helongjiang University, 2009 (in Chinese). |
| [23] |
林恋竹, 赵谋明. 反应时间对DPPH·法、ABTS+·法评价抗氧化性结果的影响[J]. 食品科学, 2010, 31(5): 63-67. LIN LZ, ZHAO MM. Effect of reaction time on DPPH and ABTS+ radical scavenging assays for antioxidant capacity evaluation[J]. Food Science, 2010, 31(5): 63-67 (in Chinese). |
| [24] |
王平, 毕志刚. UVB诱发皮肤癌的分子机制研究进展[J]. 国外医学皮肤性病学分册, 2005, 31(1): 44-46. WANG P, BI ZG. Research progress on molecular mechanism of UVB-induced skin cancer[J]. International Journal of Dermatology and Venereology, 2005, 31(1): 44-46 (in Chinese). |
| [25] |
HILLE-REHFELD A. Gadusol, ein hochwirksamer biogener UV-schutz[J]. Chemie in Unserer Zeit, 2015, 49(5): 290.
|
| [26] |
LOSANTOS R, SAMPEDRO D, CHURIO MS. Photochemistry and photophysics of mycosporine-like amino acids and gadusols, nature's ultraviolet screens[J]. Pure and Applied Chemistry, 2015, 87(9/10): 979-996.
|
| [27] |
王明, 栾韬, 赵建志, 李洪兴, 鲍晓明. 酿酒酵母转化木糖生产化学品的研究进展[J]. 生物工程学报, 2021, 37(3): 1042-1057. WANG M, LUAN T, ZHAO JZ, LI HX, BAO XM. Progress in studies on production of chemicals from xylose by Saccharomyces cerevisiae[J]. Chinese Journal of Biotechnology, 2021, 37(3): 1042-1057 (in Chinese). DOI:10.13345/j.cjb.200708 |
| [28] |
KWAK S, JO JH, YUN EJ, JIN YS, SEO JH. Production of biofuels and chemicals from xylose using native and engineered yeast strains[J]. Biotechnology Advances, 2019, 37(2): 271-283.
|
| [29] |
FIAUX J, ÇAKAR ZP, SONDEREGGER M, WÜTHRICH K, SZYPERSKI T, SAUER U. Metabolic-flux profiling of the yeasts Saccharomyces cerevisiae and Pichia stipitis[J]. Eukaryotic Cell, 2003, 2(1): 170-180.
|
| [30] |
PARK SH, LEE K, JANG JW, HAHN JS. Metabolic engineering of Saccharomyces cerevisiae for production of shinorine, a sunscreen material, from xylose[J]. ACS Synthetic Biology, 2019, 8(2): 346-357.
|
| [31] |
KIM SR, CHA M, KIM T, SONG S, KANG HJ, JUNG Y, CHO JY, MOH SH, KIM SJ. Sustainable production of shinorine from lignocellulosic biomass by metabolically engineered Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2022, 70(50): 15848-15858.
|
| [32] |
JIN H, KIM S, LEE D, LEDESMA-AMARO R, HAHN JS. Efficient production of mycosporine-like amino acids, natural sunscreens, in Yarrowia lipolytica[J]. Biotechnology for Biofuels and Bioproducts, 2023, 16(1): 162.
|
| [33] |
沈煜. 木酮糖激酶对酿酒酵母代谢工程菌木糖利用的影响及木糖异构酶基因的胞外表达[D]. 济南: 山东大学博士学位论文, 2005. SHEN Y. Effect of xylulokinase in Sacchaomyces cerevisiae xylose catabolism and expression of xylose isomeras gene outside the cells[D]. Jinan: Doctoral Dissertation of Shandong University, 2005 (in Chinese). |
| [34] |
MISHRA AK, MISHRA A, CHATTOPADHYAY P. Herbal cosmeceuticals for photoprotection from ultraviolet B radiation: a review[J]. Tropical Journal of Pharmaceutical Research, 2011, 10(3): 351-360.
|
| [35] |
D'ORAZIO J, JARRETT S, AMARO-ORTIZ A, SCOTT T. UV radiation and the skin[J]. International Journal of Molecular Sciences, 2013, 14(6): 12222-12248.
|
| [36] |
SHICK JM, DUNLAP WC. Mycosporine-like amino acids and related gadusols: biosynthesis, acumulation, and UV-protective functions in aquatic organisms[J]. Annual Review of Physiology, 2002, 64: 223-262.
|
| [37] |
闫峻, 顾娟, 冯硕, 姬瑞芳, 全庆华, 刘永刚. 大青叶化学成分及抗氧化活性研究[J]. 质谱学报, 2019, 40(4): 381-390. YAN J, GU J, FENG S, JI RF, QUAN QH, LIU YG. Study of chemical constituents and antioxidant activity of isatidis folium[J]. Journal of Chinese Mass Spectrometry Society, 2019, 40(4): 381-390 (in Chinese). |
| [38] |
GULCIN İ. Antioxidants and antioxidant methods: an updated overview[J]. Archives of Toxicology, 2020, 94(3): 651-715.
|
| [39] |
KAVIARASAN S, NAIK GH, GANGABHAGIRATHI R, ANURADHA CV, PRIYADARSINI KI. In vitro studies on antiradical and antioxidant activities of fenugreek (Trigonella foenum graecum) seeds[J]. Food Chemistry, 2007, 103(1): 31-37.
|
| [40] |
KÖKSAL E, GÜLÇIN I, BEYZA S, SARIKAYA Ö, BURSAL E. In vitro antioxidant activity of silymarin[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2009, 24(2): 395-405.
|
| [41] |
PRIOR RL, WU XL, SCHAICH K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4290-4302.
|
| [42] |
ARBELOA EM, LUJÁN RAMÍREZ C, ARIEL PROCACCINI R, CHURIO MS. Electrochemical characterization of the marine antioxidant gadusol[J]. Natural Product Communications, 2012, 7(9): 1211-1214.
|
 2024, Vol. 40
2024, Vol. 40




