扩展功能
文章信息
- 张军, 王祺, 汤伟, 刘国瑞, 许向阳, 何增国
- ZHANG Jun, WANG Qi, TANG Wei, LIU Guo-Rui, XU Xiang-Yang, HE Zeng-Guo
- 细菌素对产生菌获得生存优势及其诱导合成条件的研究进展
- Bacteriocinogeny, the way to acquire survival advantages through biosynthetic regulation: a review
- 微生物学通报, 2020, 47(3): 923-932
- Microbiology China, 2020, 47(3): 923-932
- DOI: 10.13344/j.microbiol.china.190617
-
文章历史
- 收稿日期: 2019-07-27
- 接受日期: 2019-09-12
- 网络首发日期: 2019-10-17
2. 青岛海洋生物医药研究院 山东 青岛 266061;
3. 枣庄市杰诺生物酶有限公司 山东 枣庄 277100;
4. 青岛百奥安泰生物科技有限公司 山东 青岛 266100
2. Marine Biomedical Research Institute of Qingdao, Qingdao, Shandong 266061, China;
3. Zaozhuang Jienuo Enzyme Co. Ltd., Zaozhuang, Shandong 277100, China;
4. Qingdao Bioantai Biotechnology Co. Ltd., Qingdao, Shandong 266100, China
细菌素是一类通过细菌核糖体合成的具有抑制其他微生物生长的小肽类抗菌物质。细菌素来源和种类多样,传统的分类方法根据结构将细菌素分为四类:Ⅰ型(Ⅰa型、Ⅰb型)、Ⅱ型(Ⅱa型、Ⅱb型、Ⅱc型、Ⅱd型)、Ⅲ型和Ⅳ型。不同类型的细菌素从一级结构的氨基酸组成到二级结构的空间排列再到三级结构的空间构象存在较大差异[1]。根据细菌素数据库BACTIBASE对来源于31个属的177条细菌素的统计,它们的甘氨酸、半胱氨酸、带电荷氨基酸数量及净电荷、疏水性、极性差异较大,而序列长度更是从7-688个氨基酸残基不等(http://bactibase.hammamilab.org/statistics.php)。通过对PDB数据库中22个已公布三维结构的细菌素比较发现,其三维结构虽然存在一些共同特点,如带电荷氨基酸和疏水性氨基酸聚集等特点,但同样存在较大差异(https://www.rcsb.org/)。这些特点为细菌素在抗菌领域的应用提供了丰富的选择材料。近年来,随着抗生素耐药菌在卫生、食品、养殖等领域的不断出现,新型抗菌类物质的研究备受关注[2]。细菌素以有别于抗生素的抑菌机制、不易产生耐药性和无毒副作用的特点,成为最有可能替代抗生素的物质之一[3]。
对微生物而言,动物肠道“拥挤不堪”。有研究预测,肠道内的微生物总数量达到1014个,且70%位于结肠[4]。在如此有限的空间和营养条件下,不同种类微生物间面临激烈的生存竞争,细菌素成为许多微生物维持生存优势的重要手段[5]。然而,细菌素并非细菌生长所必需,其分子量虽小,但其合成往往需要一簇基因共同表达,一般包括:结构基因(structural gene)、免疫基因(immunity gene)、转运基因(transporter gene)和调节基因(regulatory gene),这种非生长相关的物质和能量消耗对细菌而言构成了一定的负担[6-8]。因此,细菌素的合成需要受到产生菌内外诸多因素的调控,以此来寻求获得竞争优势与物质能量消耗之间的平衡。之前关于细菌素的研究多集中于发现新细菌素资源及其作用机制的研究,鲜有从细菌素产生菌的角度论述产生菌合成细菌素所获得的生存优势及其诱导合成细菌素的调控机制。本文以细菌素产生菌为出发点,在总结前人研究的基础上,希望通过梳理产生菌通过合成细菌素获得的生存优势和产生菌合成细菌素的调控机制,为新细菌素的发掘、过量表达和应用提供一定的参考和理论依据。
1 定殖优势细菌在肠道内定殖是获得生存优势的必要条件,细菌素的合成可能对产生菌在肠道上皮细胞的粘附定殖产生积极效果。Kommineni等[9]研究发现,相对于不产细菌素的粪肠球菌(Enterococcus faecalis),产生细菌素的E. faecalis在小鼠肠道中定殖的效率更高。目前,关于细菌素使产生菌获得定殖优势的作用机理还没有明确结论。然而一些研究结果显示:(1)细菌素合成后通常吸附于产生菌的细胞壁上,这一特性常常用于细菌素的纯化[7, 10-11]。(2)细菌素的高级结构常形成疏水性氨基酸聚集的疏水区[12-14]。这些研究结果显然有助于形成以下假设:当细菌素大量吸附于产生菌表面时,可能使细胞表面整体疏水性增加。研究表明,细菌表面的疏水性与其在肠道上皮细胞的粘附性呈正相关[15]。因此,细菌素对增强产生菌定殖优势的机制,可能来源于其附着于细胞壁而导致整个细胞表面疏水性的提高。
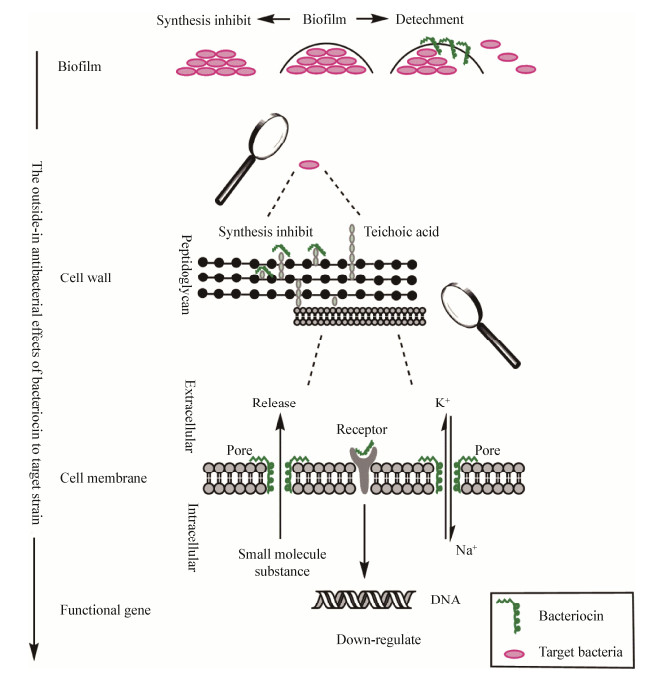
2 竞争优势产生菌合成细菌素的最主要目的是同目标微生物展开竞争,从而获得生存优势,而获得该优势的主要手段是抑制目标菌株生长。之前关于细菌素对目标菌株抑制作用的研究多集中于细菌的某一位置(如细胞壁或细胞膜)。然而近年来的研究逐渐揭示:细菌素的作用位点可能不单局限于特定位置,其作用的靶点可能是目标菌株的生物被膜、细胞壁、细胞膜,还可能同时影响目标菌株功能基因表达,因此细菌素抑菌作用的实现可能需要上述情况的综合影响[16-17]。本文根据细菌素对目标菌株不同位点的作用机制,使用ChemBioDraw Ultra 14.0软件,绘制了细菌素作用位点示意图(图 1)。
|
| 图 1 细菌素作用位点示意图(ChemBioDraw Ultra 14.0软件绘制) Figure 1 Schematic diagram of bacteriocin targeting loci (drawed by ChemBioDraw Ultra 14.0) |
|
|
细菌在物体表面或生物体内特定位置聚集成群,并向胞外分泌多聚物(extracellular polymeric substance,EPS),如蛋白质、多糖和eDNA,形成致密的膜状结构,被称为生物被膜(biofilm),生物被膜使细菌能较稳定地附着于固形物表面而不流散,产生长期定殖效果,并有效阻碍抑菌药物向胞内渗入[18-20]。细菌素作为产生菌获得生存优势的手段,首先是对目标菌株的生物被膜表现出了抑制作用,主要体现在两个方面:(1)非特异性抑制生物被膜合成。细菌素具有明确抑制生物被膜合成的作用。Yi等[21]使用细菌素BM 1157和Nisin处理单核增生李斯特氏菌(Listeria monocytogenes),其生物被膜的形成率分别降低67.33%和79.25%。Chopra等[22]研究发现,随着细菌素Sonorensin A浓度增加(20-200 μg),金黄色葡萄球菌(Staphylococcus aureus)生物被膜的形成被逐渐抑制(30%-90%)。Camargo等[20]共总结了24种细菌产生的细菌素均可抑制L. monocytogenes生物被膜的形成。(2)特异性剥离生物被膜中的目标菌。细菌素可在不影响细菌活力的情况下,将目标菌从生物被膜中分离出来,脱离了生物被膜保护的细菌更容易被杀灭。Ceotto-Vigoder等[18]研究发现,使用0.4 μg/mL细菌素Lysostaphin (最小抑菌浓度为7.8 μg/mL)处理S. aureus,结果显示98.2%的S. aureus从生物被膜释放到基质中,而使用250倍的Nisin未发现类似的解离效果,表明这种解离作用具有特异性。因此,可以推测当细菌素产生菌与目标菌株共存于肠道环境时,上述细菌素对生物被膜的影响不仅削弱竞争菌对肠道组织细胞的粘附,还能增加其对包括细菌素在内的药物敏感性,这些作用促使细菌素产生菌形成对目标菌的竞争优势。
2.2 细胞壁细胞壁是目标菌株保持菌株形态、防御外界侵染、识别和传递信号的重要结构。产生菌合成细菌素对细胞壁装配的抑制作用,可以使产生菌在与目标菌的竞争中获得更好的生存优势。细菌素对目标菌细胞壁合成的抑制多见于Ⅰ型羊毛硫细菌素(Lantibiotic),其中以Nisin的应用最为广泛。在这一过程中,细胞壁的类脂Ⅱ (Lipid Ⅱ)作为Lantibiotic的靶分子已被多项研究证实,且在胞外加入Lipid Ⅱ可以降低细菌素的抑菌效果[17, 23]。该类细菌素抑制细胞壁合成具体的机理为:Nisin末端两个羊毛硫氨基酸与目标菌株的Lipid Ⅱ结合,形成类似“笼状”结构,将Lipid Ⅱ的焦磷酸基团关闭在“笼状”结构中,使Lipid Ⅱ无法进一步形成磷壁酸,从而抑制了细胞壁的合成[24]。磷壁酸是革兰氏阳性细菌的特有组分,因此该类细菌素的靶菌株多为革兰氏阳性细菌,而对革兰氏阴性细菌的抑菌效果并不显著[25]。另有研究显示,羊毛硫细菌素Lacticin 3147具有两条肽链,可依次与Lipid Ⅱ结合形成复合体,阻止细胞壁合成[17]。这一抑菌机制类似于一些大环内酯类抗生素,抑菌浓度可达媲美抗生素的纳摩尔级(表 1),但其抗菌谱较窄,常只表现为对革兰氏阳性细菌有效[17, 26-32]。
| 细菌素 Bacteriocin |
类型 Type |
竞争菌 Competitive bacteria |
指示菌类型 Indicator |
靶点 Target |
最小抑菌浓度 MIC |
参考文献 References |
| Lacticin 3147 | Ⅰ | Micrococcus flavus | G+ | 细胞壁和细胞膜 Wall & Membrane |
380.0 nmol/L | [17] |
| Lactococcus lactis | 6.0 nmol/L | |||||
| Nisin | Micrococcus flavus | 6.0 nmol/L | ||||
| Lactococcus lactis | 48.0 nmol/L | |||||
| Enterocin AS-48 | Ⅱ | Listeria monocytogenes | G+ | 细胞壁和细胞膜 Wall & Membrane |
13.9 nmol/L | [16] |
| Lacticin 3147 | Ⅰ | Listeria monocytogenes | G+ | 细胞壁 Wall |
301.0 nmol/L | [26] |
| Bacillus cereus | 156.0 nmol/L | |||||
| Enterococcus faecalis | 312.0 nmol/L | |||||
| Enterococcus casseliflavus | 312.5 nmol/L | |||||
| Lactolisterin BU | Ⅱ | Listeria monocytogenes | G+ | 细胞膜 Membrane |
1.34 μmol/L | [3] |
| Lactococcus lactis | 1.34 μmol/L | |||||
| Bacillus subtilis | 5.38 μmol/L | |||||
| Warnericin RK | - | Bacillus megaterium | G+ | 细胞膜 Membrane |
1.2 μmol/L | [27] |
| Legionella longbeachae | G- | 1.2 μmol/L | ||||
| Legionella pneumophila | 1.2 μmol/L | |||||
| Safencin AS-48(96) | Ⅱ | Escherichia coli | G- | 细胞膜 Membrane |
2.0 μmol/L | [13] |
| Pseudomonas aeruginosa | 8.0 μmol/L | |||||
| Streptococcus pyogenes | G+ | 8.0 μmol/L | ||||
| Bactofencin A | Ⅱ | Staphylococcus aureus | G+ | 细胞膜 Membrane |
4.0 μmol/L | [28] |
| Listeria monocytogenes | 8.0 μmol/L | |||||
| Laterosporulin 10 | Ⅱ | Staphylococcus aureus | G+ | 细胞膜 Membrane |
4.0 μmol/L | [29] |
| Bacillus subtilis | 6.0 μmol/L | |||||
| Enterocine 50-52 | Ⅱ | Micrococcus luteus | G+ | 细胞膜 Membrane |
12.5 μmol/L | [30] |
| Pediocin PA-1 | 100.0 μmol/L | |||||
| Plantaricin GZ1-27 | Ⅱ | Bacillus cereus | G+ | 细胞膜 Membrane |
16.4 μmol/L | [31] |
| Nove: -: No obvious classification. | ||||||
细菌素使产生菌获得竞争优势的机理与抗生素不同,其差异性主要体现在对目标菌株细胞膜结构的破坏上,这一过程主要通过在目标菌株细胞膜上的穿孔来实现,包含3个步骤:(1)形成孔洞。细菌素结构与细胞膜类似,具有两亲性,即疏水性和亲水性氨基酸残基,往往聚集于肽链的不同区域,且相同类型的氨基酸残基会因为肽链的折叠进一步拉近距离,形成相应的疏水区核心和亲水区核心,其中亲水性氨基酸残基多是带有正电荷氨基酸残基,因此亲水核心常带正电荷。研究发现,细菌素Enterocin AS-48三维结构中,5个α-螺旋相互靠近形成一个核心疏水区,另外10个带正电荷的氨基酸残基集中在一个肽段中形成一个正电荷集中的亲水区[33]。孔洞形成时,带正电荷的亲水区首先与细胞膜磷脂双分子层带负电荷的磷酸基团相互结合,使细菌素锚定在细胞膜上,之后疏水区域自然向磷脂双分子层中疏水性脂肪酸进行插入,细菌素不断在膜上聚集最终形成孔洞;研究发现,细菌素Lacticin和Nisin可在厚度约6 nm的细胞膜上形成直径约0.6-2.0 nm的孔洞[17, 34]。(2)膜的去极化。孔洞形成后,K+和Na+借助膜两侧的浓度差,快速地外泄和回流导致细胞膜去极化,破坏用以跨膜运输质子泵的驱动力。研发发现,用16 μg/mL细菌素Plantaricin GZ1-27处理蜡样芽孢杆菌(Bacillus cereus) 5 min后,胞外K+浓度增加到0.70 mg/mL[32]。Wiedemann等[17]用0.5 μmol/L的细菌素Lacticin 3147处理乳酸乳球菌(Lactococcus lactis)约2 min后,胞内K+的释放率可达100%;(3)前体物质转运失灵,大分子合成受阻。孔洞形成后,一些胞内的小分子物质同样可以借助孔洞外流,小分子物质含量的降低必然会对大分子物质的代谢产生影响。研究发现,用2.3 μg/mL细菌素Enterocin AS-48处理E. faecalis 1 min后,胞内合成蛋白质、DNA和RNA的小分子物质(如亮氨酸、胸腺嘧啶、尿嘧啶等)的浓度下降了90%,进而导致了相应大分子物质合成受阻[35]。
细菌素与细胞膜的结合不具特异性,因此通过该机制实现抑菌作用的细菌素常具广谱性,即对革兰氏阳性和阴性细菌均表现出杀菌作用,但其发挥功能需要足够浓度的细菌素与细胞膜结合,因此其最小抑菌浓度(minimal inhibit concentration,MIC)一般在微摩尔级(表 1)。即使目前在细胞膜上形成孔洞直径最大(4.6 nm)的细菌素Lacticin Q,其抑菌活性也只能达到750 nmol/L[36]。虽然近来有研究发现,细菌素和一些膜受体通过特异性结合的方式发挥抑菌作用,其抑菌浓度也可以达到纳摩尔级[37],但是产生菌要通过这种方式获得竞争优势,需要合成大量的细菌素,当然也意味着更高的物质和能量消耗代价。
2.4 功能基因表达细菌素不仅可以影响目标菌株的膜结构,还可以下调目标菌株胞内功能性基因的表达,从而抑制目标菌株生长,这些功能基因主要包括参与能量代谢、细胞壁合成、毒素表达、细胞分裂的相关基因。对这些生长相关基因表达的抑制,可对目标菌株的生存产生不利影响,进而使细菌素产生菌获得相对的竞争优势。Miao等[38]用细菌素Peptide F1处理大肠杆菌(Escherichia coil)后发现了10个被下调的功能基因,其中延胡索酸水合酶(FumB)、ATP合酶α亚基(F0F1)均参与E. coil的能量代谢。Du等[32]研究发现用0.8×MIC的植物乳杆菌素Plantaricin处理B. cereus 5 h,其参与细胞壁肽聚糖合成的关键酶基因glmS表达水平降低了87.9%,介导细胞分裂的基因ftsZ表达量下调76.1%,导致动物腹泻性痢疾的基因hblDCA和nheABC也分别下调了31.5%和68.0%。Abriouel等[39]将2.5 μg/mL的细菌素Enterocin AS-48加入到B. cereus中,在不影响目标菌株数量的前提下,其肠毒素(Enterotoxin)的合成降低了10倍之多。受细菌素的影响,这些参与目标菌株能量和物质代谢相关基因表达的下调,会降低目标菌株活性,增加膜表面渗透性,加速自溶解,从而使产生菌实现了抑制目标菌株生长获得生存优势的目的。近年来,关于细菌素对目标菌株基因表达影响的研究较少,其中未发现细菌素与目标菌基因组直接互作影响基因表达的报道,因此推测细菌素对目标菌功能基因表达的影响,可能是通过其与膜受体的结合进而激活相关基因表达的调控因子来实现的[40]。
3 细菌素的诱导合成条件产生菌基因组中细菌素基因簇表达伴随着能量和营养物质消耗,对细菌而言同样不容忽视。研究发现,当环境条件不适于生长时,细菌会通过下调细菌素等非生长相关基因的表达以维持生长[41]。因此,虽然作为初生代谢产物,但细菌素的大量表达合成仍然需要一定的诱导机制和环境条件,以平衡获得的生存优势和物质能量消耗,使细菌素的作用效果达到最佳。
3.1 基于群体效应的自诱导与生物被膜的形成类似,产生菌合成细菌素同样受到群体感应(quorum sensing,QS)的影响,即只有当产生菌的数量达到一定的阈值之后(通常是对数生长的中后期),才会开启细菌素的表达[6, 11]。QS影响产生菌合成细菌素的特点在于细菌素本身作为一种诱导物,通过自诱导开启细菌素的合成。Wayah等[11]研究发现,在未达到细菌素合成阈值的戊糖乳杆菌(Lactobacillus pentosus)中加入0.21 μmol/L细菌素Pentocin MQ1,可以诱导Pentocin MQ1的大量合成。细菌素基于群体效应自诱导典型的循环机制包括3个部分,即跨膜的组氨酸激酶、胞内的应答调节因子和细菌素自身;具体作用方式是:当细菌素在胞外不断聚集达到一定阈值时,激活了跨膜的组氨酸激酶,激活的组氨酸激酶诱导胞质内的应答调节蛋白磷酸化,磷酸化的应答调节蛋白与细菌素合成相关基因的启动子结合,开启了细菌素的转录[42]。之后,更多的细菌素将这个循环不断放大,从而使细菌素达到抑制其他微生物的浓度。然而该机制似乎无法解释自诱导循环发生的初始阶段,即起始诱导的细菌素如何产生。最新的研究表明,产细菌素的A群链球菌粘附于宿主细胞后,可诱导宿主细胞产生天冬酰胺(Asn),天冬酰胺激活了起始诱导细菌素的表达[6]。这一发现表明,细菌素基于群体效应的自诱导合成机制可能受到“宿主/环境效应”的调节。
3.2 基于微生物种间的共培养诱导产生菌合成细菌素的目的是获得生存优势,若产生菌长期处于非竞争性环境时,细菌素的合成因物质和能量的消耗,反而成为产生菌的负担,这时产生菌常通过对细菌素合成的调控来避免多余的物质和能量消耗。有研究发现,对产细菌素Colicins的E. coli进行连续传代实验,在含有Colicins合成基因质粒完整的情况下,传至38代时其杀菌能力逐渐丧失,表明Colicins合成受到抑制[43]。相反,同产生菌在物质利用方面有竞争或共生关系的细菌与产生菌共培养时,则可以诱导细菌素的合成。Maldonado-Barragán等[44]研究发现,将未达到细菌素Gassericin E产生阈值的加氏乳杆菌(Lactobacillus gasseri EV1461),分别与植物乳杆菌(Lactobacillus plantarum)、L. pentosus、L. gasseri Lc9 (不产生Gassericin E)共培养时,可诱导Gassericin E的大量合成。Chanos等[42]总结了12种通过共培养方式诱导细菌素产生的研究发现,这种诱导作用与诱导菌株和产生菌株之间的遗传距离相关,即亲缘关系越近诱导能力越强。更近的亲缘关系往往意味着相似的营养物质需求,对这类竞争性菌株的抑制,可以使产生菌在营养物质的利用方面获得更大的优势。同时,一些和产生菌在代谢方面具有共生关系的微生物也可以诱导细菌素的合成。Ariana等[45]在Nisin高效表达的研究中发现,将产生菌L. lactis与耶氏解脂酵母(Yarrowia lipolytica)共培养时,后者可高效利用抑制Nisin合成的乳糖,使Nisin的产量提高4倍。在生产实践中,共培养的方式可以作为提高细菌素产量有效手段。虽然关于细菌素共培养诱导的机制尚不清楚,但是这种具有强特异性的诱导方式必须要基于产生菌和目标菌之间的相互接触[41]。因此,推测该诱导方式可能与两者间细胞表面物质的信号传递有关。
3.3 基于所处环境因素的外源诱导除自诱导和共培养诱导外,一些细菌所处环境中的物质也表现出对细菌素合成的诱导作用。Hatziioanou等[46]研究发现,在固体培养基中加入5 μg/mL胰蛋白酶,可以诱导粪罗斯氏菌(Roseburia faecis)细菌素的产生。另有研究发现,一株分离自干酪的牛链球菌(Streptococcus macedonicus)只在含有牛奶蛋白的培养基中培养时才能合成细菌素Macedocin,而在MSR和MH17培养基中并不产生,进一步的研究发现这种诱导作用来源于牛奶蛋白降解之后的α-酪蛋白、β-酪蛋白和β-乳球蛋白[47]。胰蛋白酶、α-酪蛋白、β-酪蛋白和β-乳球蛋白等都是产生菌所处环境中的常见物质,这可能意味着产生菌合成细菌素具有稳定的诱导源。同时,这也可以解释一些含有细菌素合成基因的细菌,在体外纯培养时因缺乏合适的诱导物而无法合成细菌素[42, 48]。
4 展望细菌素作为微生物获得生存优势的常用手段,可作用于目标菌株的生物被膜、细胞壁、细胞膜和功能基因等多处靶点,从而更难于产生耐药性。然而从进化的角度来看,细菌素长期使用后,其抗性菌也必然会伴随产生。根据细菌素上述作用机理,其抗性菌的产生可能来源于3个方面:(1)更强流动性的细胞膜。流动镶嵌模型是细胞膜的经典模型,而细胞膜中脂肪酸的种类和组成会直接影响细胞膜的流动性。研究发现,不饱和脂肪酸、短链脂肪酸和支链脂肪酸的含量与细胞膜的流动性呈正相关[49]。细胞膜更强的流动性可能意味着细菌素在细胞膜特定位置上“制造”的孔洞存在时间缩短,从而减少自孔洞中外泄的内容物,进而对目标菌株形成了一定的保护。研究发现,对细菌素Durancin GL具有抗性的耐久肠球菌(Enterococcus durans),细胞膜中不饱和脂肪酸的含量显著高于敏感型E. durans[50]。类似的研究发现,相对于生长稳定期,嗜肺军团菌(Legionella pneumophila)在对数期表现出对细菌素Warnericin RK更强的抗性,进一步研究发现对数期L. pneumophila细胞膜中支链脂肪酸和短链脂肪酸明显高于稳定期[28]。未来具有流动性更强的细胞膜突变株,即细胞膜中不饱和脂肪酸、短链脂肪酸和支链脂肪酸含量更高的突变株,可能是细菌素抗性菌株的重要来源。(2)更高效的小分子物质补偿能力。细菌素在细胞膜上穿孔后导致小分子物质外流,进而使胞内诸多依赖外流小分子物质的代谢途径受阻。目标菌为维持相关的代谢途径,需要激活外流小分子物质的基因表达,进而补偿因外流小分子物质而受阻的代谢途径。Grande Burgos等[40]用亚致死剂量的细菌素Enterocin AS-48处理B. cereus 30 min,其编码膜蛋白和转录调控因子的基因表达显著上调,上调后的B. cereus对Enterocin AS-48的MIC从2.5 μg/mL上升到4.5 μg/mL。未来,具有更高效的小分子合成途径突变株能够对外流的小分子物质形成快速、有效的补偿,也可能成为细菌素抗性菌株的来源。(3)细菌素受体缺失的突变株。抑菌活性达到抗生素级别的细菌素(纳摩尔级)具有的应用价值更大。这些细菌素主要包括Ⅰ类细菌素和部分Ⅱ类细菌素,该类细菌素在目标菌株细胞表面具有特定受体,细菌素通过与受体的特异性结合实现抑菌作用。因此,当这些受体发生缺失突变时,目标菌株即表现出对该细菌素的抗性。研究发现,甘露糖磷酸转移酶作为L. monocytogenes细胞膜上细菌素Leucocin A的受体缺失后,L. monocytogenes表现出了对细菌素Leucocin A的抗性,而对同类的细菌素Nisaplin和ESF1-7GR并未表现出相应的抗性,表明Leucocin A与L. monocytogenes细胞膜上甘露糖磷酸转移酶的结合具有特异性[51]。
由于作用靶点及抑菌机制与抗生素不同,细菌素具有替代抗生素的潜力。就细菌素在食品、卫生、养殖等领域的应用而言,通过非特异性方式发挥抑菌作用的细菌素其MIC多在毫摩尔级(表 1),约为抗生素的1 000倍,难以满足抗生素替代的需求。然而,以特异性方式发挥抑菌作用的细菌素,如Lantibiotics,其MIC可以达到与抗生素近似的纳摩尔级(表 1)。因此,该类细菌素在替代抗生素方面可能更具潜力。本课题组之前在多粘类芽孢杆菌(Paenibacillus polymyxa)发现了一个唯一N端乙酰化的羊毛硫细菌素Paenibacillin,其抑菌能力可与抗生素媲美[25]。
总之,有抗生素的前车之鉴,科学规范地使用细菌素是其应用的关键。一方面,应加强对细菌素作用机理和成药性的研究,制定科学的配套应用方案,降低细菌素耐受性菌株的产生几率;另一方面,应尽可能多地发掘新细菌素资源。随着人类探索地球脚步的不断延伸,在海洋和陆地极端环境中发现的功能特异性微生物菌株必然孕育着更新奇的细菌素资源,对这些潜在资源的发掘可以为细菌素的利用提供更丰富的选择。
| [1] |
Towle KM, Vederas JC. Structural features of many circular and leaderless bacteriocins are similar to those in saposins and saposin-like peptides[J]. MedChemComm, 2017, 8(2): 276-285. DOI:10.1039/C6MD00607H |
| [2] |
de Mol ML, Snoeck N, de Maeseneire SL, et al. Hidden antibiotics: where to uncover?[J]. Biotechnology Advances, 2018, 36(8): 2201-2218. DOI:10.1016/j.biotechadv.2018.10.008 |
| [3] |
Lozo J, Mirkovic N, O'Connor PM, et al. Lactolisterin BU, a novel class Ⅱ broad-spectrum bacteriocin from Lactococcus lactis subsp. lactis bv. diacetylactis BGBU1-4[J]. Applied and Environmental Microbiology, 201783, 21: e01519-17. |
| [4] |
Sekirov I, Russell SL, Antunes LCM, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3): 859-904. |
| [5] |
Garcia-Gutierrez E, Mayer MJ, Cotter PD, et al. Gut microbiota as a source of novel antimicrobials[J]. Gut Microbes, 2019, 10(1): 1-21. DOI:10.1080/19490976.2018.1455790 |
| [6] |
Hertzog BB, Kaufman Y, Biswas D, et al. A sub-population of group A Streptococcus elicits a population-wide production of bacteriocins to establish dominance in the host[J]. Cell Host & Microbe, 2018, 23(3): 312-323. |
| [7] |
Wang Y, Shang N, Qin YX, et al. The complete genome sequence of Lactobacillus plantarum LPL-1, a novel antibacterial probiotic producing class Ⅱa bacteriocin[J]. Journal of Biotechnology, 2018, 266: 84-88. DOI:10.1016/j.jbiotec.2017.12.006 |
| [8] |
Noda M, Miyauchi R, Danshiitsoodol N, et al. Expression of genes involved in bacteriocin production and self-resistance in Lactobacillus brevis 174A is mediated by two regulatory proteins[J]. Applied and Environmental Microbiology, 2018, 84(7): e02707-17. |
| [9] |
Kommineni S, Bretl DJ, Lam V, et al. Bacteriocin production augments niche competition by enterococci in the mammalian gastrointestinal tract[J]. Nature, 2015, 526(7575): 719-722. DOI:10.1038/nature15524 |
| [10] |
Wayah SB, Philip K. Characterization, yield optimization, scale up and biopreservative potential of fermencin SA715, a novel bacteriocin from Lactobacillus fermentum GA715 of goat milk origin[J]. Microbial Cell Factories, 2018, 17: 125. DOI:10.1186/s12934-018-0972-1 |
| [11] |
Wayah SB, Philip K. Pentocin MQ1: a novel, broad-spectrum, pore-forming bacteriocin from Lactobacillus pentosus CS2 with quorum sensing regulatory mechanism and biopreservative potential[J]. Frontiers in Microbiology, 2018, 9: 564. DOI:10.3389/fmicb.2018.00564 |
| [12] |
Acedo JZ, Towle KM, Lohans CT, et al. Identification and three-dimensional structure of carnobacteriocin XY, a class Ⅱb bacteriocin produced by Carnobacteria[J]. FEBS Letters, 2017, 591(10): 1349-1359. DOI:10.1002/1873-3468.12648 |
| [13] |
Fields FR, Carothers KE, Balsara RD, et al. Rational design of syn-safencin, a novel linear antimicrobial peptide derived from the circular bacteriocin safencin AS-48[J]. The Journal of Antibiotics, 2018, 71(6): 592-600. DOI:10.1038/s41429-018-0032-4 |
| [14] |
Acedo JZ, van Belkum MJ, Lohans CT, et al. Solution structure of acidocin B, a circular bacteriocin produced by Lactobacillus acidophilus M46[J]. Applied and Environmental Microbiology, 2015, 81(8): 2910-2918. DOI:10.1128/AEM.04265-14 |
| [15] |
Pan WH, Li PL, Liu Z. The correlation between surface hydrophobicity and adherence of Bifidobacterium strains from centenarians' faeces[J]. Anaerobe, 2006, 12(3): 148-152. DOI:10.1016/j.anaerobe.2006.03.001 |
| [16] |
Burgos MJG, Pulido RP, Del Carmen López Aguayo M, et al. The cyclic antibacterial peptide enterocin AS-48: isolation, mode of action, and possible food applications[J]. International Journal of Molecular Sciences, 2014, 15(12): 22706-22727. DOI:10.3390/ijms151222706 |
| [17] |
Wiedemann I, Bottiger T, Bonelli RR, et al. The mode of action of the lantibiotic lacticin 3147-a complex mechanism involving specific interaction of two peptides and the cell wall precursor lipid Ⅱ[J]. Molecular Microbiology, 2006, 61(2): 285-296. DOI:10.1111/j.1365-2958.2006.05223.x |
| [18] |
Ceotto-Vigoder H, Marques SLS, Santos INS, et al. Nisin and lysostaphin activity against preformed biofilm of Staphylococcus aureus involved in bovine mastitis[J]. Journal of Applied Microbiology, 2016, 121(1): 101-114. |
| [19] |
Larsen T, Fiehn NE. Dental biofilm infections - an update[J]. APMIS, 2017, 125(4): 376-384. DOI:10.1111/apm.12688 |
| [20] |
Camargo AC, Todorov SD, Chihib NE, et al. Lactic acid bacteria (LAB) and their bacteriocins as alternative biotechnological tools to control Listeria monocytogenes biofilms in food processing facilities[J]. Molecular Biotechnology, 2018, 60(9): 712-726. DOI:10.1007/s12033-018-0108-1 |
| [21] |
Yi LH, Luo LL, Lu X. Heterologous expression of two novel bacteriocins produced by Lactobacillus crustorum MN047 and application of BM1157 in control of Listeria monocytogenes[J]. Food Control, 2018, 86: 374-382. DOI:10.1016/j.foodcont.2017.11.042 |
| [22] |
Chopra L, Singh G, Kumar Jena K, et al. Sonorensin: a new bacteriocin with potential of an anti-biofilm agent and a food biopreservative[J]. Scientific Reports, 2015, 5: 13412. DOI:10.1038/srep13412 |
| [23] |
Jiang H, Tang X, Zhou QQ, et al. Plantaricin NC8 from Lactobacillus plantarum causes cell membrane disruption to Micrococcus luteus without targeting lipid Ⅱ[J]. Applied Microbiology and Biotechnology, 2018, 102(17): 7465-7473. DOI:10.1007/s00253-018-9182-3 |
| [24] |
Juturu V, Wu JC. Microbial production of bacteriocins: latest research development and applications[J]. Biotechnology Advances, 2018, 36(8): 2187-2200. DOI:10.1016/j.biotechadv.2018.10.007 |
| [25] |
He ZG, Kisla D, Zhang LW, et al. Isolation and identification of a Paenibacillus polymyxa strain that coproduces a novel lantibiotic and polymyxin[J]. Applied and Environmental Microbiology, 2007, 73(1): 168-178. DOI:10.1128/AEM.02023-06 |
| [26] |
Wu LN, Wu HJ, Chen LN, et al. Difficidin and bacilysin from Bacillus amyloliquefaciens FZB42 have antibacterial activity against Xanthomonas oryzae rice pathogens[J]. Scientific Reports, 2015, 5: 12975. DOI:10.1038/srep12975 |
| [27] |
Verdon J, Labanowski J, Sahr T, et al. Fatty acid composition modulates sensitivity of Legionella pneumophila to warnericin RK, an antimicrobial peptide[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2011, 1808(4): 1146-1153. DOI:10.1016/j.bbamem.2010.12.011 |
| [28] |
Bédard F, Fliss I, Biron E. Structure-activity relationships of the bacteriocin bactofencin A and its interaction with the bacterial membrane[J]. ACS Infectious Diseases, 2019, 5(2): 199-207. |
| [29] |
Baindara P, Singh N, Ranjan M, et al. Laterosporulin10: a novel defensin like class Ⅱd bacteriocin from Brevibacillus sp. strain SKDU10 with inhibitory activity against microbial pathogens[J]. Microbiology, 2016, 162(8): 1286-1299. DOI:10.1099/mic.0.000316 |
| [30] |
Tiwari SK, Noll KS, Cavera VL, et al. Improved antimicrobial activities of synthetic-hybrid bacteriocins designed from enterocin E50-52 and pediocin PA-1[J]. Applied and Environmental Microbiology, 2015, 81(5): 1661-1667. DOI:10.1128/AEM.03477-14 |
| [31] |
Du HC, Yang J, Lu XH, et al. Purification, characterization, and mode of action of plantaricin GZ1-27, a novel bacteriocin against Bacillus cereus[J]. Journal of Agricultural and Food Chemistry, 2018, 66(18): 4716-4724. DOI:10.1021/acs.jafc.8b01124 |
| [32] |
Iancu C, Grainger A, Field D, et al. Comparison of the potency of the lipid Ⅱ targeting antimicrobials nisin, lacticin 3147 and vancomycin against gram-positive bacteria[J]. Probiotics and Antimicrobial Proteins, 2012, 4(2): 108-115. DOI:10.1007/s12602-012-9095-x |
| [33] |
González C, Langdon GM, Bruix M, et al. Bacteriocin AS-48, a microbial cyclic polypeptide structurally and functionally related to mammalian NK-lysin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(21): 11221-11226. DOI:10.1073/pnas.210301097 |
| [34] |
Wiedemann I, Benz R, Sahl HG. Lipid Ⅱ-mediated pore formation by the peptide antibiotic nisin: a black lipid membrane study[J]. Journal of Bacteriology, 2004, 186(10): 3259-3261. DOI:10.1128/JB.186.10.3259-3261.2004 |
| [35] |
Galvez A, Valdivia E, Martinez M, et al. Effect of peptide AS-48 on Enterococcus faecalis subsp. liquefaciens S-47[J]. Antimicrobial Agents and Chemotherapy, 1989, 33(5): 641-645. DOI:10.1128/AAC.33.5.641 |
| [36] |
Yoneyama F, Imura Y, Ohno K, et al. Peptide-lipid huge toroidal pore, a new antimicrobial mechanism mediated by a lactococcal bacteriocin, lacticin Q[J]. Antimicrobial Agents and Chemotherapy, 2009, 53(8): 3211-3217. DOI:10.1128/AAC.00209-09 |
| [37] |
Heeney DD, Yarov-Yarovoy V, Marco ML. Sensitivity to the two peptide bacteriocin plantaricin EF is dependent on CorC, a membrane-bound, magnesium/cobalt efflux protein[J]. Microbiology Open, 2019, e827. |
| [38] |
Miao JY, Chen FL, Duan S, et al. iTRAQ-based quantitative proteomic analysis of the antimicrobial mechanism of peptide F1 against Escherichia coli[J]. Journal of Agricultural and Food Chemistry, 2015, 63(32): 7190-7197. DOI:10.1021/acs.jafc.5b00678 |
| [39] |
Abriouel H, Maqueda M, Gálvez A, et al. Inhibition of bacterial growth, enterotoxin production, and spore outgrowth in strains of Bacillus cereus by bacteriocin AS-48[J]. Applied and Environmental Microbiology, 2002, 68(3): 1473-1477. DOI:10.1128/AEM.68.3.1473-1477.2002 |
| [40] |
Grande Burgos MJ, Kovács AT, Mirończuk AM, et al. Response of Bacillus cereus ATCC 14579 to challenges with sublethal concentrations of enterocin AS-48[J]. BMC Microbiology, 2009, 9: 227. DOI:10.1186/1471-2180-9-227 |
| [41] |
Zhou ZY, Zhou XX, Li J, et al. Transcriptional regulation and adaptation to a high-fiber environment in Bacillus subtilis HH2 isolated from feces of the giant panda[J]. PLoS One, 2015, 10(2): e0116935. DOI:10.1371/journal.pone.0116935 |
| [42] |
Chanos P, Mygind T. Co-culture-inducible bacteriocin production in lactic acid bacteria[J]. Applied Microbiology and Biotechnology, 2016, 100(10): 4297-4308. DOI:10.1007/s00253-016-7486-8 |
| [43] |
Vriezen JAC, Valliere M, Riley MA. The evolution of reduced microbial killing[J]. Genome Biology and Evolution, 2009, 1: 400-408. DOI:10.1093/gbe/evp042 |
| [44] |
Maldonado-Barragán A, Caballero-Guerrero B, Martín V, et al. Purification and genetic characterization of gassericin E, a novel co-culture inducible bacteriocin from Lactobacillus gasseri EV1461 isolated from the vagina of a healthy woman[J]. BMC Microbiology, 2016, 16: 37. DOI:10.1186/s12866-016-0663-1 |
| [45] |
Ariana M, Hamedi J. Enhanced production of nisin by co-culture of Lactococcus lactis sub sp. lactis and Yarrowia lipolytica in molasses based medium[J]. Journal of Biotechnology, 2017, 256: 21-26. DOI:10.1016/j.jbiotec.2017.07.009 |
| [46] |
Hatziioanou D, Mayer MJ, Duncan SH, et al. A representative of the dominant human colonic Firmicutes, Roseburia faecis M72/1, forms a novel bacteriocin-like substance[J]. Anaerobe, 2013, 23: 5-8. DOI:10.1016/j.anaerobe.2013.07.006 |
| [47] |
Georgalaki M, Papadelli M, Chassioti E, et al. Milk protein fragments induce the biosynthesis of macedocin, the lantibiotic produced by Streptococcus macedonicus ACA-DC 198[J]. Applied and Environmental Microbiology, 2010, 76(4): 1143-1151. DOI:10.1128/AEM.00151-09 |
| [48] |
Bibalan MH, Eshaghi M, Rohani M, et al. Determination of bacteriocin genes and antibacterial activity of lactobacillus strains isolated from fecal of healthy individuals[J]. International Journal of Molecular and Cellular Medicine, 2017, 6(1): 50-55. |
| [49] |
Chattopadhyay MK, Jagannadham MV. A branched chain fatty acid promotes cold adaptation in bacteria[J]. Journal of Biosciences, 2003, 28(4): 363-364. DOI:10.1007/BF02705110 |
| [50] |
Du LH, Liu LP, Liu F, et al. Phenotypic and genotypic alterations of durancin GL-resistant Enterococcus durans strains[J]. Foodborne Pathogens and Disease, 2016, 13(6): 325-332. DOI:10.1089/fpd.2015.2094 |
| [51] |
Ramnath M, Beukes M, Tamura, et al. Absence of a putative mannose-specific phosphotransferase system enzyme ⅡAB component in a leucocin A-resistant strain of Listeria monocytogenes, as shown by two-dimensional sodium dodecyl sulfate-polyacrylamide gel electrophoresis[J]. Applied and Environmental Microbiology, 2000, 66(7): 3098-3101. DOI:10.1128/AEM.66.7.3098-3101.2000 |
 2020, Vol. 47
2020, Vol. 47